
Неравновесные процессы в катализе
.pdfсостояние молекулы в газовой фазе по всем степеням свободы: поступательным, вращательным, колебательным; 3) определить время жизни возбужденных состояний на поверхности.
Существуют методы лазерной адсорбционной спектроскопии (ЛАС), лазерного магнитного резонанса (ЛМР), внутрирезонаторной лазерной спектроскопии (ВРЛС), лазерно-индуцированная флуоресценция (ЛИФ), метод многофотонной ионизации (МФИ). Кратко охарактеризуем некоторые из них. ЛАС и ЛМР основаны на возможности выбрать энергию кванта лазера близкой к энергетическому расстоянию между двумя уровнями тонкой структуры в случае радикалов. Резонансные условия поглощения достигаются благодаряиспользованиювнешнегомагнитногополя. ЛИФпозволяет регистрировать очень малые концентрации радикалов и короткоживущих промежуточных продуктов химических реакций, а также получать детальную информацию о распределении продуктов реакциипосостояниям. Наиболеевысокойчувствительностьюиуниверсальностью обладает МФИ, с помощью которого осуществляются стимулированные квантовые переходы под действием нескольких лазерных импульсов, приводящие к быстрому резонансному возбуждению атомов или молекул до высоколежащих состояний, из которых они ионизируются. Возникающий атомный или молекулярный ион регистрируется обычно с помощью масс-спектрометра.
6.5. Струевые методы изучения дезактивации возбужденных молекул
Установку составляют: источник возбужденных молекул; реактор, позволяющий тем или иным способом изменять время контакта газа с исследуемой поверхностью; кювета регистрации концентрации возбужденных молекул. При этом изучают зависимость их концентрации от времени контакта с поверхностью реактора, на которую нанесено исследуемое вещество, а также от температуры и давления.
Важно, что струевые методы могут быть использованы для изучения кинетики гетерогенной дезактивации возбужденных молекул в тех случаях, когда метод молекулярного пучка неприменим. Константа скорости дезактивации возбужденных частиц, представ-
81

ляющая собой обратное время жизни возбужденной молекулы в реакторе, зависит от размеров последнего, вероятности дезактивации за одно соударение ε (коэффициент аккомодации) и коэффициента диффузии возбужденных молекул. Цель подобных исследований – определить коэффициент аккомодации ε. Если лимитирующей стадией является гетерогенная дезактивация возбужденных молекул, то
k VS 4v , где v – средняятепловаяскоростьвозбужденныхмолекул.
Рассматривалась дезактивация колебательно-возбужденных молекул СО2 на ряде поверхностей. Опыты проводились при комнатной температуре, и все исследуемые поверхности (пирекс, латунь, тефлон) были покрыты слоем СО2. Показано, что дезактивация происходитпутемрезонансногообменамеждуадсорбированнойиколе- бательно-возбужденной молекулами из газовой фазы.
Основные микроскопические механизмы релаксации колебательной энергии выделяют в зависимости от передачи энергии: 1) в оптические и акустические фононы решетки твердого тела; 2) в собственные поступательные степени свободы релаксирующей молекулы как целого; 3) во вращение релаксирующей молекулы; 4) в колебательные моды кристалла в случае релаксации на молекулярных кристаллах; 5) в адсорбированный слой, когда передача энергии в решетку маловероятна; 6) в электроны проводимости для металлов;
7)в электроны поверхностных состояний для полупроводников. Однако, строго говоря, струевые методы не являются прямыми
методами измерения скорости передачи колебательной или электронной энергии возбуждения адсорбированных молекул твердому телу. Метод же молекулярных пучков – прямой.
Порассеяниюмоноэнергетическихпучковполученырезультаты:
–наличиеилиотсутствиеактивационногобарьераприадсорбции;
–ориентация молекулы при ударном взаимодействии и вероятностьэнергообменаприэтом, возможностьпоступательного, вращательного и колебательного возбуждения при взаимодействии с поверхностью;
–корреляция вероятности взаимодействия с поверхностью со структурой и свойствами поверхности и, в частности, с перестройкой поверхности;
82
– зависимостьхарактеравозбужденияотпотенциалавзаимодействия молекулы с поверхностью.
Опыты же с пучками разной энергии неопровержимо доказываютрольпоступательнойэнергиивактивированнойхемосорбции. Во многихслучаяхнаблюдалиувеличениевероятностихемосорбцииот кинетической энергии пучка. Есть и прямые исследования передачи энергии между молекулами пучка и поверхностью, которые указывают на возможность ускорения при этом химической и каталитической реакции.
В таких экспериментах возможно изучение истинно неравновесного катализа (разные температуры поверхности и газа). Был разработан молекулярно-пучковый реактор с рециклом. Молекулы из сверхзвукового пучка соударялись с мишенью-катализатором, после каждого столкновения источник откачивали, молекулы собирали и вновь направляли в источник. Такое интегрирование степени превращения по многим циклам позволило довести чувствительность до 10–9–10–10 актов при одном столкновении. Добавляя в пространство между источником пучка и мишенью инертный газ, удалось «погасить» поступательно-возбужденные молекулы и изучить независимо влияние поступательной и колебательной энергии на процесс взаимодействия молекул с поверхностью, т. е. истинно неравновесный катализ. Была изучена изомеризация циклопропана в пропилен на слюде. Оказалось, что поступательная энергия молекул С3Н6 в пучке мало влияет на вероятность реакции, а колебательная энергия и температура поверхности влияют сильно. Скорость реакциизависитотколебательнойэнергиисEa = 235 кДж/мольпозакону Аррениуса, а от температуры поверхности – с Ea = 88 кДж/моль.
Предполагаемый механизм:
цикло-С3Н6 + поверхность → ĊН2СН2ĊН2(адс), ĊН2СН2ĊН2(адс) → СН3–СН=СН2 (адс), СН3–СН=СН2 (адс) → С3Н6(газ).
Для разрыва С–С связи на первой стадии необходимо 235 кДж/моль– колебательное возбуждение. Вероятность адсорбции бирадикала уменьшается с ростом поступательной энергии E . Влияние E скорее всего сказывается в следующих стадиях: активация
83
С–H связи и десорбция, однако это до конца не выяснено. В целом, есть четкие данные о влиянии поступательного возбуждения на скорость реакции. О степени влияния разных видов возбуждения можно сказать по данным обратного процесса – распределения энергии в продуктах реакции.
6.6. Диссипативные структуры в катализе
Образование упорядоченных структур, происходящее в результатевнутреннейперестройкисистемы, называетсясамоорганизацией. Самоорганизация – фундаментальное понятие, указывающее на развитие в направлении от менее сложных объектов к более сложным и упорядоченным формам организации вещества. В каждом конкретномслучаесамоорганизацияпроявляетсяпо-разному, этозависит от сложности и природы изучаемой системы. Разномасштабные самоорганизующиеся системы, независимо от того, к какому разделу науки они относятся, имеют единый алгоритм перехода от менее сложных и менее упорядоченных к более сложным и более упорядоченным состояниям.
Разработкой теории самоорганизации занимаются несколько научных дисциплин: термодинамика неравновесных (открытых) систем; синергетика; теория катастроф.
Самоорганизация не связана с особым классом веществ, но она существует лишь в специальных системах, отвечающих условиям:
а) сильнонеравновесные системы, открытые для притока энергии (вещества) извне;
б) наличие в системе положительной обратной связи.
Для возникновения самоорганизации необходимо выполнение следующих условий.
1. Величина движущей силы должна быть достаточно велика, чтобы система оказалась в области существования бифуркаций (т. е.
Δξ2 < Δξ < ξ3).
2. Объем системы должен быть достаточно велик и должен достигать некоторой критической величины, обеспечивающей необходимое количество незатухающих флуктуаций, взаимодействие которых создает упорядочение в системе.
3. Зависимость I(ξ) должна быть нелинейной.
84
4. Величина потока должна возрастать при увеличении движущей силы (dI / dξ > 0).
При обычных отклонениях от равновесия (отклонение от линейности) возникают новые стационарные состояния, стабилизирующиеся в результате обмена энергией с окружающей средой и организованные в пространстве, времени или одновременно как в пространстве, так и во времени. И.Р. Пригожин назвал их диссипативными структурами.
Пространственные, временные или пространственно-вре- менные структуры, которые могут возникать вдали от равновесия в нелинейной области при критических значениях параметров системы, называются диссипативными структурами.
Их формирование связано с резкими переходами от системы с одними параметрами к системе с другими. По аналогии с термодинамическими фазовыми переходами такие скачкообразные переходы называются кинетическими. Термин диссипативные структуры ввели для того, чтобы подчеркнуть их отличие от равновесных структур. Диссипативные структуры являют собой поразительный пример, демонстрирующий способность неравновесности служитьисточникомупорядоченности. Следуеттакжеотметить, что диссипативные структуры являются устойчивыми образованиями и их устойчивость определяется устойчивостью внешнего источника энергии.
Можно выделить следующие типы диссипативных структур:
–пространственно-неоднородные;
–периодические во времени (автоколебания);
–пространственно-временные периодические структуры (автоволны);
–существование нескольких стационарных состояний (бистабильные структуры типа «триггера», тристабильные структуры);
–структурысоскейлинговымисвойствами (отангл. scale – шкала, масштаб, размер), фракталы (пространственное самоподобие);
–динамические структуры с хаотическим поведением.
В гетерогенном катализе наблюдаются первые четыре типа. В области, далекой от равновесия, термодинамический подход и соотношения типа Гленсдорфа – Пригожина не работают; в этой области
85
существенную роль играет характер химической кинетики: заторможенность тех или иных стадий вследствие потенциального барьера.
Работы И.Р. Пригожина по теории необратимых процессов в открытых системах были удостоены Нобелевской премии в 1977 г.
6.7. Самоорганизация в физических явлениях
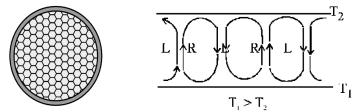
ЯчейкиБенара– структурированиеподдействиемтемпературного градиента в тонком слое жидкости (сосновое масло с алюминиевой пылью) (рис. 8а).
а) вид сверху |
б) конвективное упорядочение |
Рис. 8. Ячейки Бенара
При увеличении градиента температуры ( Т = Т1 – Т2) между горизонтальными стенками сосуда с жидкостью теплоперенос, первоначально осуществляемый путем конвекции, по достижении критического значения Т = ТС (соответствующего точке бифуркации) сменяется строго коррелированным движением молекул в микроячейках жидкости. Молекулы движутся согласованно, начиная с вращения по часовой (R) или против часовой (L) стрелки (рис. 8б). При дальнейшемувеличении Тячеистаяструктураразрушается, вместо нее появляется турбулентный хаос.
6.8. Самоорганизация в химии
Химическая реакция Белоусова – Жаботинского – процесс окисления малоновой СН(СООН)2 (или лимонной) кислоты бромитом калия КВrО3 в присутствии сульфата церия (III) Се2(SО4)3. При добавлении в раствор индикатора окислительно-восстановительной реакции (ферроина) можно следить за ходом реакции по изменению цвета или, более точно, по спектральному поглощению. При доста-
86
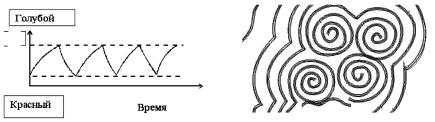
точно высокой концентрации веществ, участвующих в реакции, наблюдаются необычные явления: цвет раствора периодически (при определенных концентрациях) меняется от красного (при избытке Ce4+) до синего (при избытке Ce3+). Кривая изменения поглощения света (рис. 9) показывает, что в системе происходят колебания, причем могут наблюдаться как периодические, так и хаотические колебания. Таким образом, имеется автоколебательный процесс изменения концентрации четырехвалентного церия с одновременным варьированием цвета. На поверхности раствора появляются поверхностные волны (рис. 10).
Се |
3+ |
← |
Се |
4+ |
|
→ |
|
Рис. 9. Кривая изменения |
Рис. 10. Химические спиральные |
поглощения света |
волны на поверхности раствора |
Колебательная реакция была открыта Б.П. Белоусовым в 1951 г. Однако первое сообщение Белоусова об этой реакции, посланное тогда же в один из химических журналов, было отвергнуто. В отзыве говорилось, что публиковать работу не следует, потому что описанная в ней реакция невозможна. Такая же судьба постигла и второе сообщение, направленное в печать в 1955 г. Лишь в 1958 г. по настоянию С.Э. Шноля Белоусов сумел опубликовать маленький реферат своей работы в «Рефератах по радиационной медицине», издававшихся Институтом биофизики Министерства здравоохранения
СССР. С1964 г., когдаэтойреакциейсталзаниматьсяА.М. Жаботинский (аспирант С.Э. Шноля), изучение реакций подобного типа набирает темп. В 1980 г. Б.П. Белоусову (посмертно), Р.Р. Иваницкому, В.И. Кринскому, А.М. Жаботинскому и А.Н. Заикину за цикл работ по исследованию колебательных реакций была присуждена Ленинская премия.
87
6.9. Устойчивость и неустойчивость. Критические состояния. Бифуркации
Если отклонение открытой системы от состояния равновесия невелико, то неравновесное состояние можно описать теми же параметрами (температура, химический потенциал и другие), что и равновесное. Однако отклонения параметров от равновесных значений вызывают потоки вещества и энергии в системе. Такие процессы переноса приводят к производству энтропии. И.Р. Пригожиным в 1945 г. был сформулирован расширенный вариант термодинамики.
Воткрытойсистемеизменениеэнтропииможноразбитьнасумму двух вкладов:
dS = dSe + dSi, |
(8) |
где dSe – поток энтропии, обусловленный обменом энергией и веществом с окружающей средой, dSi – производство энтропии внутри системы.
Итак, открытая система отличается от изолированной наличием члена в выражении для изменения энтропии, соответствующего обмену. При этом знак члена dSe может быть любым в отличие от dSi.
ДлянеравновесногосостоянияS < Smax. Неравновесноесостояние более высокоорганизовано, чем равновесное, длякоторого S = Smax.
Формирование структуры – это возникновение новых свойств и отношений во множестве элементов системы. Формирование структур при необратимых процессах должно сопровождаться качественным скачком (фазовым переходом) при достижении в системе критических значений параметров. Переход от хаоса к порядку, происходящий при изменении значений параметров от докритических к сверхкритическим, изменяет симметрию системы. Поэтому такой переход аналогичен термодинамическим фазовым переходам. Переходы в неравновесных процессах называются кинетическими фазовыми переходами. Вблизи неравновесных фазовых переходов не существует непротиворечивого макроскопического описания (рис. 11). Флуктуации столь же важны, как и среднее значение. Например, макроскопические флуктуации могут приводить к новым типам неустойчивостей. Неустойчивости такого типа удобно изучать методами теории бифуркации [Николис и Пригожин, 1977]. В принципе, бифуркация есть не что иное, как возникновение при
88
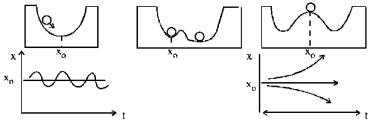
некотором критическом значении параметра нового решения уравнений (рис. 11в).
Итак, вдали от равновесия между химическими, кинетическими и пространственно-временными структурами реагирующих систем существует неожиданная связь, взаимодействия обусловлены короткодействующими силами (силами валентности, водородными связями и силами Ван-Дер-Ваальса). Для возникновения диссипативных структур требуется, чтобы размеры системы превышали некоторое критическое значение – сложную функцию параметров, описывающих реакционно-диффузионные процессы. При этом химические неустойчивости задают дальнейший порядок, посредством которого система действует как целое.
а |
б |
в |
Рис. 11: а – устойчивое, б – локально устойчивое, в – неустойчивое состояние равновесия (точка х0 ); флуктуация выводит шарик из равновесия, при этом возможны два устойчивых состояния равновесия
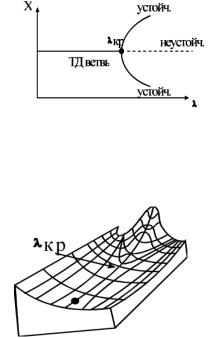
Рассмотримграфик, известныйподназваниембифуркационной диаграммы (рис. 12, 13). Здесь приведена в общем случае зависимость переменного состояния системы Х от управляющего параметра . При малых значениях возможно лишь одно устойчивое решение (единственное значение Х), поскольку в этой области система способна гасить внутренние флуктуации или внешние возмущения. Такуюветвьсостоянийназываюттермодинамическойветвью. При переходе критического значения параметра , обозначенного КР на рисунке, состояния на этой ветви становятся неустойчивыми, так как флуктуации или малые внешние возмущения уже не гасятся. Действуя подобно усилителю, система отклоняется от стационарногосостоянияипереходиткновомурежиму, прикоторомсуществуют два устойчивых состояния с различными значениями Х. Такой пере-
89
ход под действием флуктуаций называется явлением бифуркации, причем в момент перехода сама система совершает критический выбор устойчивого пути развития (в окрестности = КР) за счет случайных флуктуаций. Термин бифуркация буквально означает раздвоение. Бифуркация в широком понимании – приобретение нового качества движения динамической системы при малом изменении ее параметров (возникновение при некотором критическом значении параметра нового решения уравнений).
Рис. 12. Бифуркационная диаграмма. В области устойчивости термодинамической ветви для каждого значения λ существует единственное значение Х. В неустойчивой части термодинамической ветви возможно несколько равновероятных значений Х – рождение диссипативных структур в сверхкритической области (λ > λКР)
Рис. 13. Бифуркационная диаграмма. Трехмерное изображение
6.10.Примеры диссипативных структур в катализе
1.Упорядоченныепространственныеструктуры– изучаются методом дифракции рентгеновских лучей и электронов. Например, двухмерные поверхностные фазы в адсорбции и катализе. Именно фазовые превращения – это наиболее вероятные реакции образования или гибели активных центров на поверхности катализаторов.
90
