
Неравновесные процессы в катализе
.pdfКоордината реакции лишь в некоторых случаях является плавной линией, как на рис. 5. Обычно она – кривая в многомерном пространстве внутренних переменных, отражающая сложную комбинацию элементарных движений (поступательных, вращательных, колебательных, электронных), которая неодинакова на различных участках. Из-за криволинейности координату реакции нельзя рассматривать как независимую степень свободы. Во-первых, может нарушиться первоначально термически равновесное распределение энергиипопоступательнымстепенямсвободы, аво-вторых, система может вернуться в область реагентов даже после того, как она уже прошла через конфигурацию активированного комплекса в направлении продуктов реакции.
5. ИНДУКЦИЯ И КАТАЛИЗ ХИМИЧЕСКИХ РЕАКЦИЙ. СОПРЯЖЕННЫЕ РЕАКЦИИ
При исследовании функциональных особенностей и механизма деятельности живого организма как единой системы требуется знание законов взаимодействия отдельных органов; так и для расшифровки процессов, протекающих в химической системе, необходимо, помимо знания элементарных реакций, из которых состоят бруттопроцессы, учитывать взаимное влияние синхронно протекающих реакций. Термин «сопряжение реакции» ввел В. Оствальд. Большой вклад в исследование сопряженных реакций внес Н.А. Шилов, который трактовал эти процессы следующим образом: «я буду им (термином «сопряжение») пользоваться вообще для обозначения такой системы 2-х протекающих в одной среде реакций, из которого одна зависит в своем течении от другой... Сопряжение же реакций возможно лишь при сложных процессах, представляющих последовательность отдельных реакций и ведущих к образованию промежуточныхпродуктов». ПоШилову, «влияниеоднойреакциинадругую, может, вообще говоря, выразиться как в ускоряющем, так и в замедляющем действии».
В общем случае при рассмотрении различных вариантов взаимосвязанных реакций с позиций их взаимного усиления и ослабления пользуются понятием химическая интерференция (см. ниже).
51
При взаимном влиянии реакций (характерном только для сложных реакций) происходит химическая интерференция, которая может заключаться в уменьшении скорости накопления продуктов первичной реакции и ускорении образования продуктов вторичной реакции. Таеечасть, вкоторойпроисходитусилениевторичнойреакции, называется сопряженным процессом. В зависимости от конкретной цели явление, характеризующееся ускорением реакции за счет протекания в этой системе другой реакции, называется химической индукцией, а явление, когда вторичная реакция замедляет протекание первичной – химическим ингибированием.
Характеристики системы сопряженных реакций в классическом определении
Н.А. Шилов указывал, что число веществ, участвующих в явлении, может быть равно четырем, но наиболее распространенными являются реакции с участием трех типов компонентов:
А+ В (первая реакция),
А+ С (вторая реакция).
Здесь А – актор, В – индуктор, вызывает взаимодействием с актором вторичный процесс, С – акцептор. Фактор индукции равен отношению расхода акцептора к расходу индуктора: I = fАсс / fIn. Индуктор воздействует на вторичную реакцию в определенных количествах. Если индуктор полностью регенерируется, то вариант с бесконечным значением фактора индукции будет формально соответствовать каталитическому процессу (по Шилову). Он рассматривалкаталитическийпроцесскакчастныйслучайсопряженногопроцесса, в котором «превращение индуктора представляет замкнутый круг». Однако, по определению Шилова, катализ и индукция основаны на разных принципах: каталитическая система не может дать дополнительной работы, а химическая индукция, напротив, является источником полезной работы для другой, несамопроизвольной реакции.
Общая схема сопряженного процесса:
A + In = КП (первичная реакция), КП – конечные продукты. A + Асс = КП (вторичная реакция).
52
Характерные черты сопряженных реакций
1.Экзэргоническая реакция совершает полезную работу для протекания другой – эндэргонической – реакции, т. е. убыль свободной энергии в первичной реакции полностью покрывает возрастание свободной энергии во вторичной реакции. Не исключена также возможность ускорения самопроизвольной (вторичной) реакции, протекающей с уменьшением свободной энергии, но в данных условиях скорость которой может быть весьма незначительной (например, практически равной нулю);
2.Принцип независимости протекания химических реакций не выполняется;
3.Каналы связи между реакциями устанавливаются через общие промежуточные соединения;
4.Сопряженныереакциипротекаюттольковоткрытыхсистемах;
5.Сопрягаемые реакции обязательно должны быть сложными. Сопряженными могут быть и реакции, одна из которых замед-
ляетдругую(ингибирует). Например, еслицелеваяреакцияявляется каталитической, а в первичной реакции образуются промежуточные продукты, отравляющие катализатор. Другой случай – когда промежуточные продукты обеих реакций рекомбинируются или диспропорционируют (активные центры уничтожаются). Естественно,
при отрицательной химической индукции обе реакции должны быть самопроизвольными.
Ускоряющее действие одной реакции на другую может проявляться и без индукции – путем инициирования или синтеза катализатора в одной реакции для другой. Взаимное влияние синхронно протекающих реакций (интерференция) в системе охватывает значительно более широкий круг явлений, чем химическая индукция.
Рассмотрим различные виды сложных взаимодействий между реакциями, часть из которых можно объединить идеей об интерфе-
ренции.
Интерференция – взаимное усиление или ослабление реакций; в сопряженных процессах скорость образования конечных продуктовпервичнойреакцииснижается, аскоростьобразованияпродуктов вторичной реакции растет. Под интерферирующими химическими
процессами подразумевается такое взаимное влияние реакций,
53
течение которых синхронизировано во времени и пространстве.
Сопряженные процессы при таком подходе – частный случай ин-
терферирующих. Явление, состоящее в том, что синхронно про-
текающие в химической системе реакции взаимно усиливаются или ослабляются, называются химической интерференцией. Ин-
терференция – взаимное (inter) ударение (ferio). Взаимодействующие реакции можно назвать когерентными. При химической индукции самопроизвольно протекающая в системе химическая реакция совершает полезную работу для протекания в этой системе другой несамопроизвольной химической реакции, неосуществимой в отсутствие первой (термодинамическое сопряжение). Суждение о том, чтовтораяреакция«вызывает» первую, неверно. «Вызывать» можно за счет инициирования, а также при синтезе катализатора в первичной реакции для вторичной. Здесь же в течение всего времени реакции совершается полезная работа за счет первичной реакции.
5.1.Взаимосвязанные реакции
Впоследовательных реакциях взаимосвязь осуществляется путем синтеза на первой стадии промежуточного продукта, который является исходным для второй стадии. Тогда усиление первой сложной реакции приводит к ожидаемому усилению другой. Из параллельных реакций взаимное влияние испытывают только те реакции, которые в качестве одного из компонентов содержат хотя бы одно
общее для них вещество (в данной схеме – А). Через изменение СА – общего реагента – параллельные реакции как бы в неявной форме взаимно влияют на кинетику протекания каждой из них. Последо- вательно-параллельные реакции представляют собой комбинацию рассмотренных выше. В сопряженных процессах образующиеся в первичнойреакциипромежуточныесоединенияобусловливаютпротекание (ускорение) несамопроизвольной (самопроизвольной) вторичной реакции между актором и акцептором. При этом чаще всего меняется тип вторичной реакции и она в трансформированном виде становитсясамопроизвольнымпроцессом. Приинициированиироль промежуточныхсоединений– принципиальнодругая. Итак, взаимодействие между реакциями осуществляется с помощью стабильных промежуточных продуктов (последовательные реакции), промежу-
54
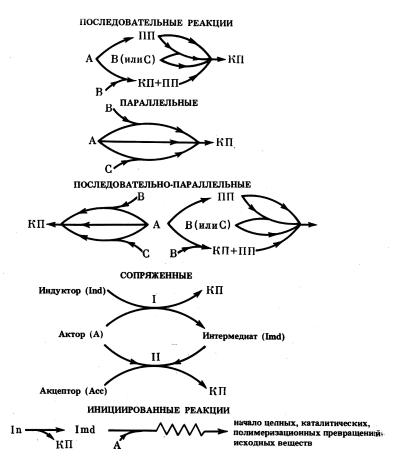
точных соединений (инициирование, сопряженные реакции) и при их отсутствии (определенный тип параллельных реакций). Общая схема приведена на рис. 6.
Рис. 6. Схематическое изображение взаимосвязанных реакций
Промежуточные частицы могут быть двух видов:
1. Короткоживущие частицы с высокой реакционной способностью, функционирующие in situ – свободные радикалы, комплексы с участием индуктора или катализатора с одним или несколькими
55

исходными реагентами, крайне нестабильные молекулярные образования и т. д. Это интермедиаты;
2.Валентно-насыщенные молекулы, ионы, комплексы. Они называются медиаторами.
С учетом вышеизложенного возможен следующий качественный критерий сложных процессов:
1.В последовательных или параллельно-последовательных реакциях участвуют частицы и 1-го, и 2-го типов.
2.Обязательным условием протекания параллельных реакций является непременное участие в каждой реакции присущего только ей промежуточного продукта 1-го рода.
3.Синхронно протекающие в химической системе реакции являются сопряженными только в том случае, когда они протекают с участием общих для обеих реакций промежуточных продуктов 1-го рода.
Сопряженные процессы с участием трех компонентов (различные типы)
1) Актор (А) входит в брутто-уравнение обеих сопряженных реакций:
A + In = КП (первичная реакция),
А+ Асс = КП (вторичная реакция).
2)Актор А не входит в явной форме в брутто-уравнение вторичной реакции:
A + In = КП,
С + Асс = КП.
Но А расходуется во вторичной реакции, участвуя в формировании общего активного промежуточного соединения (Х, Y), благодаря которомуустанавливаютсяканалысвязимеждусопрягаемымиреакциями. Механизм реиндуцирующего действия первичной реакции:
A + In = X + КП (первичная), |
(1) |
Х + С (или Асс) = Y + КП (вторичная), |
(2) |
Y + Асс (или С) = Х + КП. |
(3) |
С + Асс = КП (вторичная брутто-реакция).
56
Участие Х во вторичной реакции может быть двояким:
а) Х генерируется в конце вторичной реакции и играет роль катализатора или активного центра цепной реакции;
б) Х участвует в образовании Y и полностью расходуется во вторичной реакции, т. е. без регенерации в стадии завершения вторичной реакции. Тогда вместо стадии (3) можно записать реакцию
Y + Асс (или С) = КП.
В 1-м случае интерференция проявляется наиболее эффективно, но взаимодействие реакций осуществляется не за счет сопряжения. Второй – наиболее типичный для сопряженных процессов. К индуцирующему эффекту приводит собственно реакция (1) в результате передачи активного центра (промежуточного продукта) по (2). Тогда схема (1) – (3) трансформируется в следующем виде:
A + In → RIn → КП (индуцирующая реакция), RIn + C → Y + КП (реиндуцирующая реакция),
Y + Асс = КП.
Здесь раскрывается механизм индуцирующего действия первичной реакции на вторичную.
Иногда в сопряженных реакциях функции актора и индуктора выполняет одно и то же вещество. Такие вещества могут одновременно играть роль окислителя и восстановителя или же иметь кислотныеиосновныесвойства. Примеромявляетсяпероксидводорода:
2Н2О2 = 2Н2О + О2.
Однаизмолекул– окислитель, другая– восстановитель. Генерируемые в систему при распаде Н2О2 активные центры расходуются на образование конечного продукта по целевой (вторичной) реакции, что позволяет считать одну из молекул Н2О2 актором, а другую – индуктором.
Такой тип реакций может быть представлен в виде:
A + A (In) = X + КП (первичная),
А + Асс = КП (вторичная).
На самом деле Х + Асс = КП (индуцируемая стадия), но формально участвуют только два вещества.
57

Для обобщения можно вместо простого учета превращения индуктора учитывать расход актора по каждой реакции. Пример – трехкомпонентная система сопряженных реакций:
A In W1 X W2 B
A Acc W3 C
Обобщенная схема:
1 joA In X 2 jo .
Acc
Здесь первая реакция отражает брутто-превращение, а вторая реакция– механизмдействияпромежуточногопродуктаХ. Согласно этой обобщенной схеме
1 / fA fIn fA1 fA2 · 1 / ,
где fA1 и fA2 – количество актора, затраченное на образование конечных продуктов в первичной и вторичной реакциях.
Подставляя в выражение для фактора индукции, получим
D fA1 |
fAcc fA2 |
fAcc 1 |
или
D WA1 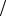 fAcc WA2
fAcc WA2 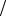 fAcc 1 .
fAcc 1 .
Здесь D – детерминанта (см. ниже).
Это уравнение носит универсальный характер и отражает явление индукции в любом его проявлении.
Различные формы химической интерференции
1A2 и fAcc ; 1 / fA 1 fIn ; D fAcc 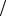 fA 1 .
fA 1 .
Всистеме в основном протекает первичная реакция; чем выше
еескорость, тем меньше значение фактора индукции I, который в пределе стремится к нулю; расход акцептора незначителен. Сопряжение незначительно.
2. fA2 fA1 – возможны три варианта системы с взаимосвязанными реакциями;1. fA f
а) fA2 fAcc D fAcc 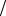 fA2 .
fA2 .
Расход индуктора фактически равен расходу 1 A2 . Химическая индукция наиболее эффективна, необходимо стремиться к этому предельному соотношению.
A2 . Химическая индукция наиболее эффективна, необходимо стремиться к этому предельному соотношению.
58
б) fAcc fA2 и 1 fA2 fIn ; D fAcc
fA2 fIn ; D fAcc 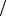 fA2 .
fA2 .
Чем эффективнее каталитическое действие промежуточного вещества на вторичную реакцию или на цепное превращение субстрата, тем выше D.
Катализатор в лучшем случае способствует достижению выходов продуктов, близких к равновесным (см. выше); при химической индукции могут наблюдаться выходы, превышающие равновесные. Если в первичной реакции аккумулируются активные центры в форме катализатора для другой, синхронно протекающей с ней реакции, то последняя обязательно должна быть самопроизвольной и для ее протекания первичная реакция не совершает полезной работы. При химической же индукции промежуточные вещества расходуются во вторичной реакции, используется химическая энергия, освобожденная в первичной реакции, и тем самым совершается полезная работа. Но если в первичной реакции синтезируется катализатор, то такие реакции нельзя считать сопряженными, так как это противоречит понятию химической индукции.
В то же время, например, в биохимии много сопряженных каталитическихпроцессов. Дляних D 1 , использованиекатализаторов приближает систему к идеальному варианту D 1 , и это вариант а). Итак, по значению D можно не только количественно оценить эффективность интерференции, но и установить для конкретных условий доминирующий тип взаимодействия. Если в систему наряду с исходным реагентом вводится катализатор К, который только ускоряет взаимодействие промежуточного продукта первичной реакции с А, и D , то имеет место химическое сопряжение.
При D первичная реакция генерирует в систему катализатор для вторичной самопроизвольной реакции; химическая индукция отсутствует. Отсюда следует, что D характеризует сопряженные реакции и является известным фактором индукции, только если 0 D . Этонеравенствохарактернотолькодлясистем, вкоторых проявляется химическое сопряжение.
Для инициированных цепных реакций D > 1 (всегда !) – и тем больше, чем длиннее цепь.
в) fA2 fAcc . Тогда D fAcc 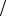 fA2 при данных условиях в принципе может иметь место химическая индукция. Однако мало-
fA2 при данных условиях в принципе может иметь место химическая индукция. Однако мало-
59

вероятно, чтобы вторичная реакция, требующая для осуществления двеилиболеемолекулактора, моглабыпротекатьсосколько-нибудь заметным выходом.
3. Актор поровну расходуется в обеих реакциях, т. е. fA |
fA . |
||||||
а) |
|
|
D fAcc fA1 fA2 fAcc |
1 |
2 |
||
fA2 |
fAcc |
2 fA2 / 2 ; |
|
||||
б) |
fA |
fAcc |
fAcc 2 fA . |
D ; |
|
|
|
|
2 |
|
|
2 |
|
|
|
|
|
|
fAcc |
2 fA |
, D ; |
|
|
в) |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
||
fA |
fAcc |
fAcc |
2 fA |
, D ; |
|
|
|
|
2 |
|
|
2 |
|
|
|
|
|
|
2 fA |
, D . |
|
|
|
|
|
|
fAcc |
|
|
||
|
|
|
|
2 |
|
|
|
Эти варианты химической интерференции уже обсуждены выше. Рассмотрим пример инициирующего действия Н2О2 (радикаловOH) иегоотличиеотсопряжения. Прикаталитическомдействии солей железа (+2) на реакцию разложения Н2О2 имеем:
Fe2 H2O2 Fe3 OH OH (инициирование);
OH CH2 CHCN HOCH2CHCN CH2 CHCN HO CH2
CHCN n CH2CHCN (продолжение цепи).
OH дает начало 1-й реакционной цепи, затем остается на неактивном конце цепи и не участвует в последних актах роста. Один радикал OH вызываетпревращениебольшогоколичествамономера, иН2О2 выполняетфункцииинициатора, новбрутто-уравнениецеле- вой реакции не входит. Концентрация Н2О2 в системе, где она играет роль инициатора, строго ограничена. Ограничение для реакций инициирования установлено Бенсоном: когдаскоростьпродолжения цепи в 10–100 раз больше скорости зарождения активных центров, в системе преобладают реакции продолжения и цепной процесс играет важную роль. Следовательно, для цепных реакций должно выполняться следующее условие:
10,
где ν – длина цепи.
Частный случай сопряженных процессов с тремя компонентами:
A + In → X,
X + In → В, X – промежуточное вещество.
Х + Асс → D,
60
