
Неравновесные процессы в катализе
.pdfВещества, вызывающие торможение ферментативной реакции, называются ингибиторами ферментов. Ингибирование ферментативных реакций заключается в том, что ингибитор образует с ферментом малоактивное соединение, не способное к каталитическому превращению. Концентрация активной формы фермента при этом снижается, что приводит к значительному снижению скорости реакции. Поэтому понятие «ингибирование» тождественно термину «отравление» катализатора. Последний термин преимущественно используетсявгетерогенномкатализе. Еслиингибированиефермента происходит за счет продукта реакции, то возникает явление, как бы противоположное автокатализу, – автоингибирование реакции. Обычно ингибитор связывается с ферментом обратимо, поэтому вывод его из реакционного объема приводит к разрушению неактивного комплекса фермент – ингибитор с образованием свободного фермента, что обусловливает увеличение скорости реакции. Явление ингибирования ферментов лежит в основе регулирования скорости ферментативных реакций в живых организмах.
2. ГЕТЕРОГЕННЫЙ КАТАЛИЗ
Одна из причин гетерогенной каталитической активности та же, что и в гомогенном катализе: катализатор ускоряет реакцию, снижая энергию активации лимитирующей стадии. Поэтому он, хотя и не смещает определяемый термодинамическим равновесием состав реакционной смеси, увеличивает скорость, с которой этот состав достигается. Так, для реакции диссоциации аммиака без катализатора энергия активации составляет 350 кДж/моль, а с вольфрамовым катализатором – 162 кДж/моль. Отличительной особенностью гетерогенных каталитических процессов является протекание их на поверхности катализатора, как правило, твердофазного. В общем случае классическими являются процессы, представляющие собой два типа гетерогенного катализа: 1) процессы, катализатор которых находитсявтвердойфазе, ареагирующиевещества– вжидкой; 2) процессы, катализатор которых находится в твердой фазе, а реагирующие вещества – в газовой. Следовательно, в любом случае изучение свойств и состояния твердых фаз является залогом успешного развития теории гетерогенного катализа.
21
Для рассмотрения простейших моделей гетерогенный каталитический процесс можно разделить на следующие стадии: 1) транспортреагирующихвеществкповерхностикатализатора(диффузия);
2)адсорбция реагирующих веществ на поверхности катализатора;
3)реакция на поверхности катализатора; 4) десорбция продуктов реакции с освобождением поверхности катализатора; 5) транспорт продуктов реакции в объеме (диффузия). Скорость каталитического процесса в целом может лимитироваться одной из этих стадий. В том случае, когда требуется сравнительная оценка активности катализаторов, процесс ведут так, чтобы скорость определялась второй стадией.
Рассмотрим характерные черты гетерогенных каталитических процессов.
Важнейшей из них является сродство катализатора к реагирующим веществам, обеспечивающее образование промежуточного соединения, имеющегонеустойчивыйхарактерилегкораспадающегося на конечные продукты с регенерацией катализатора.
Принято считать, что с максимальной скоростью каталитическая реакция осуществляется при строго определенных оптимальных величинах энергий связи между атомами молекул реагентов и атомами активных центров катализатора. Это положение, впервые сформулированное А.А. Баландиным в мультиплетной теории гетерогенного катализа как энергетическое соответствие, получило в дальнейшем и теоретическое, и экспериментальное подтверждение.
Катализаторы процессов гидрогенизации Pt, Ni, Cu образуют с водородом поверхностные соединения хемосорбционного типа Pt – H, Ni – H, Cu – H, а палладий даже растворяет водород, т. е. взаимодействие переходит с поверхности в объем. Окислительные катализаторы, например платина и палладий, образуют с кислоро-
дом сорбционные комплексы типа Pt · O2, Pd · O2, оксид меди CuО легко восстанавливается до металлической меди и вновь окисляется и так далее.
Как отмечалось выше, катализаторы обладают селективностью (избирательностью) действия, т. е. для одних и тех же веществ различные катализаторы способны вызвать разные процессы, приводящиекобразованиюразныхконечныхпродуктов. Например, вслучае
22
гетерогенного катализа на оксиде алюминия при 350 С идет дегидратация этилового спирта с образованием этилена
0
C2H5OH 350 C, Al2O3 C2H4 H2O.
На том же катализаторе при 250 С этот же процесс в основном приводит к синтезу эфира
2C2H5OH → (C2H5)2О + H2O.
На активной меди при 200 С идет дегидрирование с образованием альдегида
C2H5OH → CH3CHO + H2;
а на специально приготовленных медных катализаторах могут образовываться уксусно-этиловый эфир
2C2H5OH → CH3СООC2H5
и ацетон
2C2H5OH → CH3СОСH3 + 3H2 + СО.
На цинкхромоксидных катализаторах происходит синтез бутадиена
2C2H5OH → СH2 = CH – CH = CH2 + H2 + 2H2O.
В результате каталитического действия металлического натрия образуется бутиловый спирт
2C2H5OH → C4H9OH + H2O.
Раньше этому давали общее объяснение, исходя из свойств промежуточных соединений, образующихся при контакте исходных веществ с катализатором. Однако эти представления в каждом случае должны быть детализированы с учетом адсорбционных свойств катализатора и его строения.
2.1. Активация в гетерогенных каталитических реакциях. Применение метода переходного состояния в гетерогенном катализе
Сравнимскоростикаталитическойинекаталитическойреакций. Напишем для обоих случаев уравнения Аррениуса
kкат = C*=2e E*=2 /RT и k Ce E /RT .
Разделим первое уравнение на второе
23

k*=2k = qq*=2 e(E −E*=2 )/RT = CC*=2 e E /RT .
Здесь величину E называют кажущейся энергией активации. Остановимся на физическом смысле величины E . Пусть без
катализатора протекает биомолекулярная реакция A B AB* продукты.
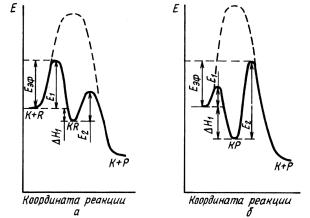
В присутствии катализатора весь процесс можно изобразить следующим образом: 1) адсорбция исходных веществ на поверхности катализатора A B K ABK . Это процесс экзотермический, так как АВК будет обладать меньшей потенциальной энергией, чем А + В + К; 2) перевод адсорбированного состояния в активное: ABA ABK *. Здесь требуется затрата энергии Еист, называемой истинной энергией активации каталитической реакции; 3) реакция в адсорбированном состоянии с образованием адсорбированных конечных продуктов: ABK * (продукты) К; 4) десорбция продуктов реакции, приводящая к регенерации катализатора: (продукты) К→К+ продукты. Этопроцессактивированныйиэндотермический. Рассмотрим графическое изображение реакционной схемы (рис. 2).
Из рис. 2 видно, что E – это Н адсорбции активного комплекса на катализаторе. Это справедливо при сделанном предположении обаналогииактивныхкомплексоввнекаталитическойикаталитической реакциях. В общем случае эта величина может включать в себя и изменение энтальпии, обусловленное перестройками внутри активного комплекса. Здесь существенно, что адсорбционный процесс экзотермичен ( E > 0), в результате чего ускоряется каталитический процесс по сравнению с некаталитическим.
Как определить кажущуюся и истинную энергии активации? Если на основе экспериментальных данных построить график
ln k* RTE lnC,
где k * – экспериментально определенная (кажущаяся) константа скоростигетерогеннойхимическойреакции, тополучимпрямуюлинию для каждой из рассматриваемых областей процесса. Дифференцирование по температуре выше приведенного соотношения даст
d ln k * |
|
E * |
. |
dT |
|
||
|
RT 2 |
||
24
Здесь Е* – кажущаяся энергия активации. Эта величина связана с истинной энергией активации Е выражением
E* E ,
где – теплота адсорбции реагирующего вещества, когда в качестве примера рассматривается реакция с участием одного, слабо адсорбирующегося газа, причем продукт реакции не тормозит процесса. Если реагирующее вещество адсорбируется слабо, а продукт реакции – сильно, то E* E 1 2 , где 1 и 2 – теплоты адсорбции соответственно исходных веществ и продуктов реакции.
Рис. 2. Профиль поверхности потенциальной энергии вдоль координаты реакции для двухстадийной каталитической реакции: а – лимитирует процесс первая стадия, Еэф = Е1; б – лимитирует процесс вторая стадия, Еэф = Е2 + H1 ( H1 < 0) (пунктир – профиль поверхности для реакции, протекающей в отсутствие катализатора)
Какотмечалосьвыше, протеканиегетерогеннойкаталитической реакции возможно лишь при условии непрерывной диффузии (молекулярной или конвективной) к реакционной поверхности и отводе продуктов реакции от нее. Скорость процесса в целом для этой последовательности будет определятьс я наиболее медленной стадией. Если это диффузия, то говорят, что процесс лежит в диффузионной области. Он чаще всего описывается уравнением реакции 1-го порядка, так как скорость диффузии пропорциональна концентрации. Если же процесс в целом определяется скоростью химической реак-
25

ции, то он лежит в реакционной области и описывается уравнением кинетики той реакции, которая протекает на поверхности катализатора. Если же скорости диффузии и реакции соизмеримы, имеется переходная область. Рассмотрим типичную аррениусовскую зависимость константы скорости гетерогенной реакции (рис. 3).
Рис. 3. Зависимость константы скорости гетерогенно-каталитической реакции от температуры в линейных координатах уравнения Аррениуса: 1 – внешнедиффузионная; 2 – внутридиффузионная; 3 – кинетическая области протекания процесса
Поскольку при понижении температуры скорость реакции убывает быстрее, чем скорость диффузии, то в области низких температур осуществляется реакционный контроль. Как уже отмечалось, энергия активации реакции выше, чем соответствующая величина для диффузии, и третий отрезок имеет наибольший угол наклона. С повышением температуры скорость реакции растет и постепенно становится соизмеримой со скоростью диффузии. Это переходная область. Инаконец, привысокихтемпературахосуществляетсядиффузионныйконтроль, энергияактивацииневелика, иневеликнаклон участка прямой. Можно показать, что в том случае, когда макроскопическая скорость реакции (константа k1) соответствует реакции 1-го порядка, имеет место соотношение
1 1 1 , k1 k 1
где k – константа скорости химической реакции на поверхности, а– константа скорости диффузии, являющаяся функцией коэффициента диффузии. При k >> процесс будет лежать в диффузионной области и k1 ≈ , если же k << – то в реакционной и k1 ≈ k.
26

2.2. Кинетика гетерогенно-каталитических реакций на равнодоступной поверхности
Любая гетерогенно-каталитическая реакция, протекающая в присутствии твердого катализатора, включает ряд стадий:
–массоперенос исходных веществ путем диффузии из объема газовой или жидкой фазы к внешней поверхности гранулы катализатора;
–массоперенос путем диффузии по порам гранулы к внутренней поверхности катализатора;
–адсорбция реагентов на поверхности катализатора;
–химическийактнаповерхностисучастиемоднойилинескольких хемосорбированных частиц;
–десорбция продуктов реакции и их обратный массоперенос в объем жидкой или газовой фазы.
Одна или несколько из этих стадий могут быть лимитирующими. Если массоперенос вещества не лимитирует, то вся поверхность внутри катализатора находится в одинаковых концентрационных условиях. В этом случае говорят, что каталитическая реакция протекает на равнодоступной поверхности.
Скорость гетерогенно-каталитической реакции равна количеству вещества, реагирующего на единице поверхности катализатора за единицу времени
Sdtdn1
изависитотстепенизаполненияповерхностимолекуламиреагентов.
Согласнозакону«действующихповерхностей» длямономолекулярной реакции А → В, протекающей на поверхности катализатора,
k ,
где – доля занятых мест на поверхности.
Скорость стадий адсорбции и десорбции может быть выражена, согласно этому закону, уравнениями
a ka PA 1 A и д kд ` ,
где РА – давление адсорбата в газовой фазе.
Для бимолекулярной реакции А + В = С + D имеются две возможности: 1) молекулы А и В реагируют между собой в адсорбиро-
27
ванном состоянии (механизм Лэнгмюра – Хиншельвуда); 2) адсорбированные молекулы А реагируют с молекулой В из газовой фазы (механизм Ридила – Или).
Для первого механизма скорость реакции на поверхности
д k ` B ,
а для второго
д k ` PB .
Закон «действующих поверхностей» может быть использован лишь в том случае, если активные центры, адсорбирующие молекулы А и В, хаотически перемешаны, т. е. упорядоченная адсорбция не имеет места. Гетерогенно-каталитические реакции включают несколько элементарных параллельно-последовательных стадий, протекающих на поверхности, при этом образуется одно или несколько промежуточных веществ. Поскольку обычно гетерогенно-каталити- ческие реакции протекают в стационарном или квазистационарном режиме, то сумма скоростей стадий, приводящих к образованию и расходованию промежуточных веществ, равна нулю
i,s s 0 ,
гдеνr,s – стехиометрическийкоэффициентr-гопромежуточноговеще- ствавs-стадии; υs – скоростьэтойстадии. Этоуравнение– уравнение стационарности (квазистационарности) каталитической реакции.
При протекании каталитической реакции устанавливается некоторая стационарная степень заполнения поверхности молекулами реагентов и продуктами реакции. При этом
i + 0 = 1,
где i – доля занятых активных центров; 0 – доля свободных активных центров.
С помощью приведенных уравнений может быть получено кинетическое уравнение каталитической реакции, если известен ее механизм. Так как обычно механизм реакции неизвестен, то для объяснения кинетических закономерностей той или иной реакции пользуются обобщенными схемами гетерогенно-каталитических реакций.
2.3. Макрокинетика гетерогенного катализа
Процессы, происходящие в гетерогенном катализе, весьма разнообразны, поэтому дать общую схему математического описания
28
процессавесьмазатруднительно. Сложностьструктурыгетерогенного катализа как одного из фундаментальных понятий химии и одновременноодногоизпроцессовхимическойтехнологиипроявляетсяв том, что составляющие его процессы протекают на разных уровнях. Один из наиболее разработанных способов описания химико-техно- логических процессов – это иерархическая структура математической модели (М.Г. Слинько). Модель строится путем последовательного перехода в описании процесса с одного уровня на другой. Выделим в гетерогенно-каталитическом процессе пять уровней.
1.Молекулярный уровень. Описание процессов, протекающих
вмасштабе порядка расстояния между двумя молекулами, – это закономерности химической кинетики.
2.Уровень малого объема. На этом уровне объектом описания является процесс на одном зерне катализатора. Здесь закономерности предыдущего уровня уже недостаточны. Необходимо дополнить их закономерностями процессов тепло- и массопереноса в зерне.
3.Уровень рабочей зоны аппарата – это слой гетерогенного катализатора, на этом уровне необходимо учитывать эффекты, связанные с характером движения потока.
4.Уровень аппарата. При переходе на него учитывают число, конфигурацию, взаимную связь и взаимное расположение рабочих зон, например несколько слоев катализатора в аппарате.
5.Уровень агрегата. Здесь учитываются взаимные связи между аппаратами.
Математическоеописаниеуровней3–5 рассматриваетсявхимической технологии и выходит за рамки курса. Математический анализ одновременного протекания химической реакции и процессов переноса на поверхности в зерне катализатора – предмет макрокинетики гетерогенного катализа.
Детализируем стадии гетерогенно-каталитического процесса (см. выше): диффузия исходных веществ из потока к внешней поверхности катализатора; диффузия исходных веществ в порах зерна катализатора; адсорбция исходных веществ на поверхности катализатора; собственно химическая реакция; десорбция продуктов с поверхности катализатора; диффузия продуктов с внутренней поверхности зерна катализатора (к поверхности пор); диффузия продуктов
свнешней поверхности зерна в поток.
29

Как отмечено выше, любая из этих стадий может контролировать процесс. Таким образом, кинетические закономерности гете- рогенно-каталитического процесса могут контролироваться как законами собственно химической кинетики, так и закономерностями массопереноса и законами адсорбции.
Всвязисэтимразличаютпятьосновныхкинетическихобластей работы гетерогенного катализатора: 1) внешнекинетическая область ; скоростьпроцессалимитируетсясамойхимическойреакцией на внешней поверхности зерна катализатора; 2) адсорбционная область; скорость процесса определяется адсорбцией исходного вещества или десорбцией продукта реакции; 3) внешнедиффузионная область; скорость процесса лимитируется скоростью диффузии входных веществ из потока к внешней поверхности катализатора или скоростью диффузии продуктов реакции от нее в поток; 4) внутридиффузионная область; скорость процесса контролируется диффузией исходных веществ от внешней поверхности зерна к его внутренней поверхности, или диффузией продуктов реакции в обратном направлении. Скорость диффузии, как будет доказано ниже, зависит в данном случае от кинетических параметров реак-
ции; 5) внутрикинетическая область*; скорость процесса опре-
деляется скоростью химической реакции, протекающей на поверхности пор зерна, то есть на его внутренней поверхности. Строгие границы между этими областями работы катализатора отсутствуют; они перекрываются промежуточными (переходными) областями, в которых сочетаются закономерности разных областей.
Внешнекинетическая область гетерогенного катализа
Рассмотрим кинетику гетерогенно-каталитической реакции на однороднойповерхности(модельидеальногоадсорбционногослоя). Аналогом закона действующих масс здесь выступает закон действующих поверхностей, согласно которому скорость элементарной химической реакции пропорциональна произведению поверхностных концентраций исходных веществ в степени, равной стехиометриче-
*Такая терминология сложилась исторически. Однако, поскольку существуют как кинетика реакции, так и кинетика диффузии, более корректно называть эти области соответственно внешне- и внутреннереакционными, или внешне- и внутреннехимическими.
30
