
- •1. Методы исследования органических соединений, содержащих ковалентно-связанный галоген
- •Идентификация галогенид-ионов
- •Количественное определение галогенидов
- •Методы идентификации органических соединений, содержащих ковалентно-связанный атом серы
- •Методы количественного определения органических соединений, содержащих ковалентно-связанный атом серы
- •3. Методы исследования органических соединений, Содержащих кратные связи
- •Методы идентификации органических соединений, содержащих кратные связи
- •Методы количественного определения органических соединений, содержащих кратные связи
- •4. Методы исследования веществ, содержащих спиртовый гидроксил
- •Методы идентификации веществ, содержащих спиртовый гидроксил
- •Количественное определение веществ, содержащих спиртовый гидроксил
- •5. Методы исследования веществ, содержащих енольный гидроксил
- •Методы идентификации веществ, содержащих енольный гидроксил
- •Количественное определение веществ, содержащих енольный гидроксил
- •6. Методы исследования веществ, содержащих альдегидную и кетонную группы
- •Методы идентификации веществ, содержащих альдегидную и кетонную группы
- •Количественное определение веществ, содержащих альдегидную группу
- •Количественное определение веществ, содержащих кетогруппу
- •Методы идентификации карбоновых кислот и их солей
- •Методы количественного определения карбоновых кислот
- •Методы количественного определения солей карбоновых кислот
- •8. Методы исследования веществ, содержащих сложноэфирную и амидную группы
- •Количественное определение веществ, содержащих сложноэфирную и амидную группы
- •9. Методы исследования веществ, содержащих третичный атом азота и алифатическую аминогруппу
- •Методы идентификации веществ, содержащих третичный атом азота, алифатическую аминогруппу
- •Методы количественного определения веществ, содержащих третичный атом азота и алифатическую аминогруппу
- •10. Методы исследования веществ, содержащих ароматическую аминогруппу и нитрогруппу
- •Методы идентификации веществ, содержащих ароматическую аминогруппу и нитрогруппу
- •Количественное определение веществ, содержащих ароматическую аминогруппу и нитрогруппу
- •11. Методы исследования веществ, содержащих фенольный гидроксил
- •Методы идентификации веществ, содержащих фенольный гидроксил
- •Количественное определение фенолов
- •Литература
Методы количественного определения солей карбоновых кислот
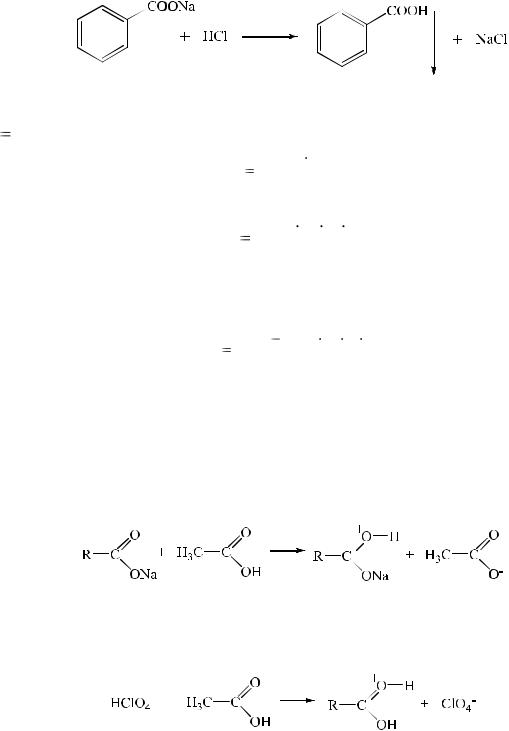
1.Ацидиметрия.
Вряде случаев количественное определение натриевых и калиевых солей органических кислот (натрия бензоат, натрия салицилат и др.) проводят ацидиметрически в присутствии органических растворителей (диэтиловый эфир, хлороформ) для извлечения образующейся при титровании органической кислоты. Титрование ведут при энергичном перемешивании.
Индикатор – метиленовый оранжевый в смеси с метиленовым синим.
f 1.
T |
|
Сэ( HCl) |
M (1/ z)препарата |
, |
||
HCl/ препарат |
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
X% |
VHCl |
K T 100 |
. |
|
||
|
|
a |
|
|
||
|
|
|
|
|
||
Расчетная формула содержания препарата с учетом контрольного опыта:
X % |
(V |
V к.о.) K T 100 |
. |
|
HCl |
HCl |
|||
|
|
|||
|
|
a |
|
2. Ацидиметрия в неводных средах (для веществ, проявляющих слабые основные свойства).
Некоторые соли щелочных металлов (лития и натрия оксибутират, калия ацетат и др.) проявляют слабые основные свойства, поэтому их количественно определяют в среде ледяной уксусной кислоты.
Титрантом служит раствор кислоты хлорной, которую также растворяют в ледяной уксусной кислоте.
32

Индикатор – кристаллический фиолетовый.
f 1/ z, z = количеству карбоксильных групп.
|
|
СэHClO |
M (1/ z) |
препарата |
|
|
THClO 4 / препарат |
|
4 |
|
|
, |
|
|
1000 |
|
|
|||
|
|
|
|
|
|
|
|
VHClO4 |
K T 100 |
|
|||
X% |
|
|
|
. |
|
|
|
a |
|
|
|||
|
|
|
|
|
|
|
Расчетная формула содержания препарата с учетом контрольного опыта:
|
(V |
V |
к.о. ) K T 100 |
|
X % |
HClO4 |
|
HClO4 |
. |
|
|
a |
||
|
|
|
|
3. Комплексонометрия.
Используется для количественного определения солей двух-, трех-, четырехвалентных металлов (магния, цинка, висмута и др.) прямой и обратный методы комплексонометрии.
К анализируемой пробе добавляется металлохромный индикатор, например, кислотный хром темно-синий, который в присутствии аммиачного буферного раствора, образует с ионом металла комплексное соединение, розового цвета. (Аммиачный буферный раствор добавляется, для того, чтобы связать выделившуюся кислоту, наличие которой мешает определению).
При титровании трилоном Б вначале связываются ионы металла, находящиеся в растворе.
33
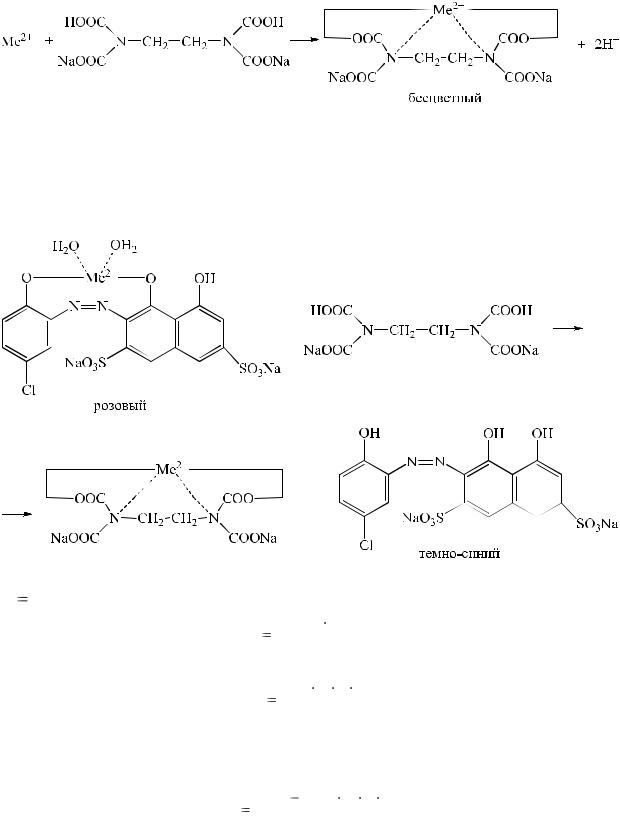
Затем трилон Б связывает ион металла, содержащийся в менее прочном комплексе MeInd-. В момент наступления точки эквивалентности высвобождается свободный индикатор, и раствор приобретает синюю окраску.
f 1.
T |
|
|
Сэ(трБ) |
M (1/ z)препарата |
, |
||||
трБ/ препарат |
|
|
|
1000 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
X % |
VтрБ |
K T 100 |
. |
|
|
|||
|
|
|
a |
|
|
||||
|
|
|
|
|
|
|
|
||
Расчетная формула содержания препарата с учетом контрольного |
|||||||||
опыта: |
|
|
|
|
|
|
|
|
|
|
|
(V |
|
V к.о. |
) K T 100 |
|
|
||
X % |
|
трБ |
трБ |
|
|
. |
|
||
|
|
|
|
a |
|
|
|||
|
|
|
|
|
|
|
|
||
34
