
- •1. Методы исследования органических соединений, содержащих ковалентно-связанный галоген
- •Идентификация галогенид-ионов
- •Количественное определение галогенидов
- •Методы идентификации органических соединений, содержащих ковалентно-связанный атом серы
- •Методы количественного определения органических соединений, содержащих ковалентно-связанный атом серы
- •3. Методы исследования органических соединений, Содержащих кратные связи
- •Методы идентификации органических соединений, содержащих кратные связи
- •Методы количественного определения органических соединений, содержащих кратные связи
- •4. Методы исследования веществ, содержащих спиртовый гидроксил
- •Методы идентификации веществ, содержащих спиртовый гидроксил
- •Количественное определение веществ, содержащих спиртовый гидроксил
- •5. Методы исследования веществ, содержащих енольный гидроксил
- •Методы идентификации веществ, содержащих енольный гидроксил
- •Количественное определение веществ, содержащих енольный гидроксил
- •6. Методы исследования веществ, содержащих альдегидную и кетонную группы
- •Методы идентификации веществ, содержащих альдегидную и кетонную группы
- •Количественное определение веществ, содержащих альдегидную группу
- •Количественное определение веществ, содержащих кетогруппу
- •Методы идентификации карбоновых кислот и их солей
- •Методы количественного определения карбоновых кислот
- •Методы количественного определения солей карбоновых кислот
- •8. Методы исследования веществ, содержащих сложноэфирную и амидную группы
- •Количественное определение веществ, содержащих сложноэфирную и амидную группы
- •9. Методы исследования веществ, содержащих третичный атом азота и алифатическую аминогруппу
- •Методы идентификации веществ, содержащих третичный атом азота, алифатическую аминогруппу
- •Методы количественного определения веществ, содержащих третичный атом азота и алифатическую аминогруппу
- •10. Методы исследования веществ, содержащих ароматическую аминогруппу и нитрогруппу
- •Методы идентификации веществ, содержащих ароматическую аминогруппу и нитрогруппу
- •Количественное определение веществ, содержащих ароматическую аминогруппу и нитрогруппу
- •11. Методы исследования веществ, содержащих фенольный гидроксил
- •Методы идентификации веществ, содержащих фенольный гидроксил
- •Количественное определение фенолов
- •Литература
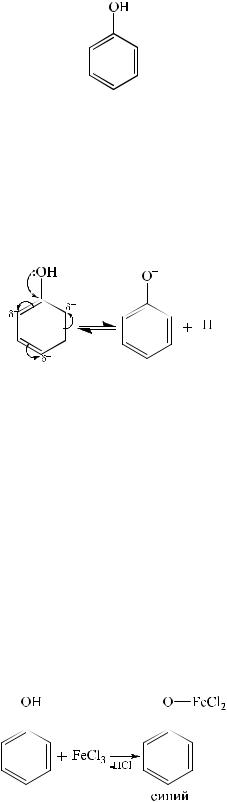
11. МЕТОДЫ ИССЛЕДОВАНИЯ ВЕЩЕСТВ, СОДЕРЖАЩИХ ФЕНОЛЬНЫЙ ГИДРОКСИЛ
Фенольный гидроксил связан с ароматическим кольцом и проявляет слабые кислотные свойства вследствие взаимодействия неподеленной пары электронов атома кислорода с π-электронами ароматического ядра.
В свою очередь гидроксильная группа оказывает влияние на бензольное кольцо, повышая электронную плотность в орто- и параположениях, облегчая замещение атомов водорода в этих положениях.
Для фенолов характерны реакции кислотно-основного взаимодействия, окисления, замещения, конденсации.
Фенольный гидроксил содержат препараты группы фенолов (фенол, тимол, резорцин), фенолокислот и их производных (салициловая кислота, метилсалицилат, фенилсалицилат и др.); производные фенантренизохинолина (морфин, апоморфин) и многие другие.
Методы идентификации веществ, содержащих фенольный гидроксил
1. Реакция комплексообразования с солями железа (III). В результате образуются соединения, окрашенные чаще всего в синий цвет. Окраска зависит от количества и расположения фенольных гидроксилов.
52
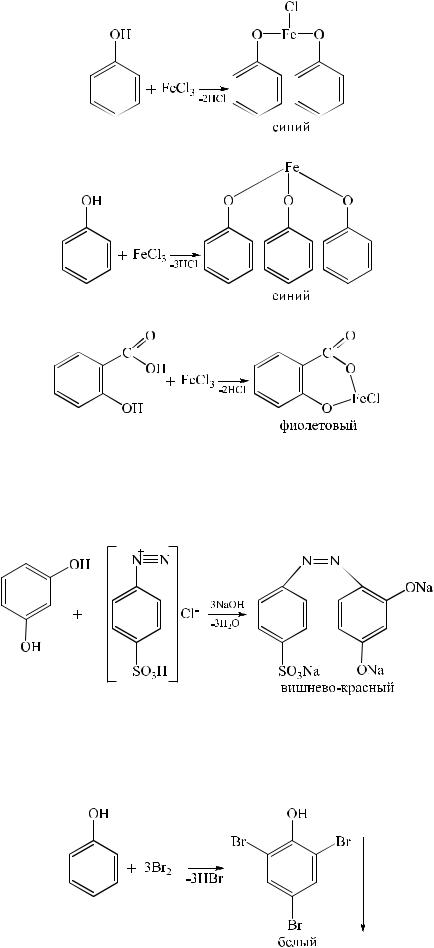
2. Реакция азосочетания. В результате взаимодействия фенола с диазореактивом образуется азокраситель вишневого, красного или оранжевокрасного цвета.
3. Реакции электрофильного замещения. Фенолы вступают в реакции нитрования, сульфирования, но наибольшее распространение получила реакция галогенирования (бромирование, йодирование).
53
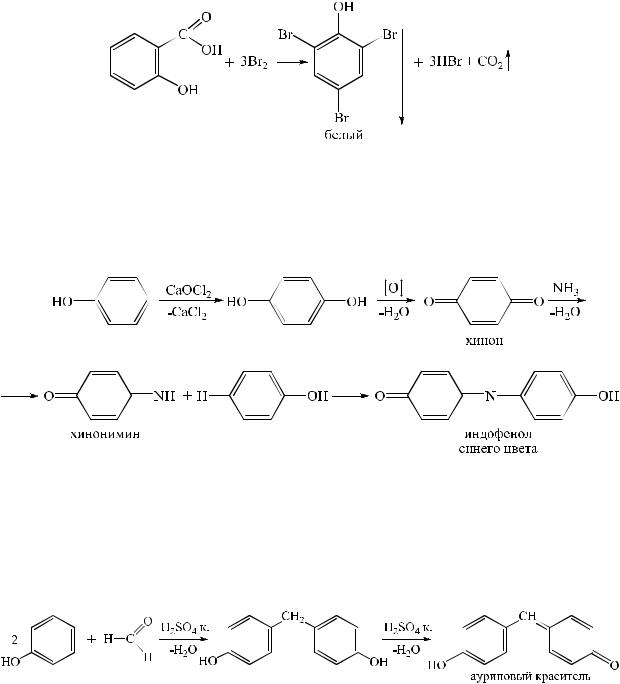
Выделяется белый осадок трибромфенола и происходит обесцвечивание бромной воды.
Салициловая кислота в присутствии избытка брома декарбоксилируется, образуя трибромфенол.
4. Реакции окисления. Фенолы легко окисляются, что сопровождается изменением окраски препаратов. В качестве окислителей можно использовать гипохлориты, бромную воду в присутствии аммиака и др. окислители.
5. Реакции конденсации. Фенолы вступают в реакции конденсации со спиртами, альдегидами, органическими кислотами, ангидридами кислот и др. Характерной для фенолов является реакция конденсации с реактивом Марки (смесь формальдегида и концентрированной серной кислоты). В результате образуется ауриновый краситель темно-вишневого цвета.
Еще одной разновидностью реакции конденсации является реакция Либермана, основанная на взаимодействии фенолов с нитрозосоединениями, которые получаются при действии на фенолы азотистой кислотой:
54

Количественное определение фенолов
1.Броматометрия.
Воснове метода лежит реакция галогенирования (бромирования) фенолов. Применяют как прямое, так и обратное броматометрическое титрование. В случае прямого способа титруют исследуемое вещество калия броматом в присутствии калия бромида до обесцвечивания раствора индикатора метилового оранжевого или метилового красного.
После добавления избыточной капли калия бромата образующийся
избыток брома обесцвечивает индикатор. |
|
f 1/ z, z = количеству атомов брома, |
участвующих в реакции |
электрофильного замещения. В данном случае f |
1/ 4 . |
TKBrO / препарат
3
X%
Сэ( KBrO ) M (1/ z)препарата ,
3
1000
VKBrO3  K
K  T
T  100 .
100 .
a
Расчетная формула содержания препарата с учетом контрольного опыта:
|
(V |
V к.о. ) K T 100 |
|
X % |
KBrO 3 |
KBrO3 |
. |
|
a |
||
|
|
|
55
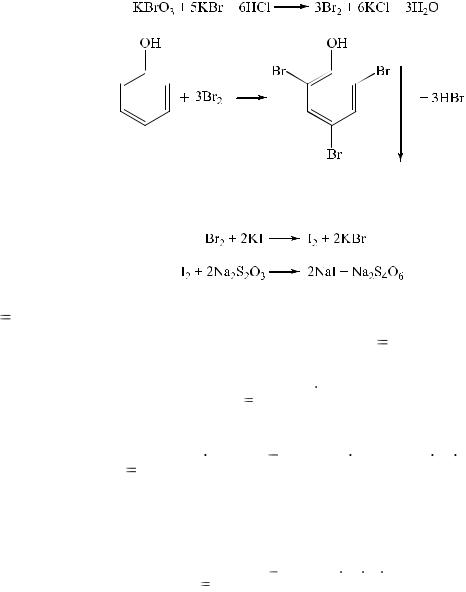
Чаще применяют обратное броматометрическое титрование, при котором берут заведомый избыток калия бромата и калия бромида. Часть выделившегося брома идет на бромирование ароматического кольца:
Избыток брома устанавливают йодиметрически, индикатор – крахмал:
f 1/ z, z = количеству атомов брома, |
участвующих в реакции |
||||||||||||||||
электрофильного замещения. В данном случае f |
1/ 6 . |
|
|
||||||||||||||
|
TKBrO / препарат |
|
|
Сэ( KBrO ) |
|
M (1/ z) |
препарата |
, |
|
|
|||||||
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|||||
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X% |
(VKBrO |
K KBrO |
VNa S O |
K Na S O |
|
) T 100 |
. |
||||||||||
3 |
|
|
|
3 |
|
2 |
2 |
3 |
2 |
2 |
|
3 |
|
||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
a |
|
|
|
|
|
|
|
|
|
Расчетная формула содержания препарата с учетом контрольного |
|||||||||||||||||
опыта: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
к.о. |
|
|
|
VNa S O ) |
K T 100 |
|
|
|
|
|||||
|
X % |
|
(VNa S O |
. |
|
|
|||||||||||
|
|
2 |
2 |
3 |
2 |
2 |
3 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||||||
a
Аналогично препараты фенолов можно определить йодиметрическим и йодхлорметрическим методами.
2. Алкалиметрия в неводной среде.
Так как фенолы проявляют очень слабые кислотные свойства, титрование их в водной среде невозможно. Поэтому в качестве растворителей используют диметилформамид, н-бутиламин, пиридин, этилендиамин и др.
При растворении в основном растворителе препарата фенола происходит усиление кислотных свойств последнего:
56
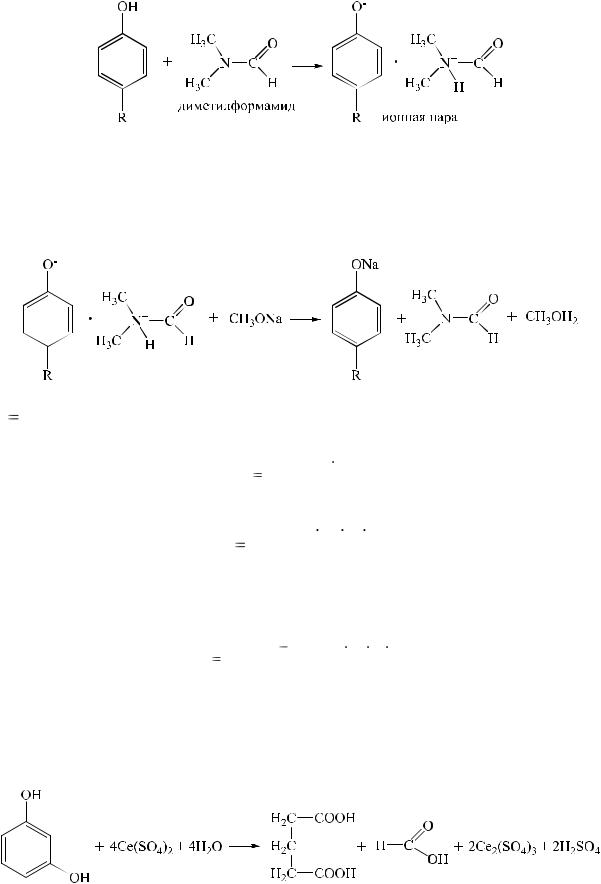
Затем ионная пара взаимодействует с титрантом. В качестве титранта используют растворы метилата натрия, метилата лития или раствор натрия гидроксида в смеси метилового спирта и бензола. Индикатор – тимоловый синий, ализариновый желтый.
f 1/ z, z = количеству фенольных гдроксилов.
TCH ONa/ препарат |
|
Сэ(CH ONa) M (1/ z)препарата |
, |
|||||||
|
|
3 |
|
|
|
|
|
|||
|
|
|
1000 |
|
|
|
||||
3 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
VCH3ONa |
K T 100 |
|
|
|
||||
X% |
|
|
|
|
|
. |
|
|
|
|
|
|
|
a |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Расчетная формула содержания препарата с учетом контрольного |
||||||||||
опыта: |
|
|
|
|
|
|
|
|
|
|
|
(V |
|
|
V к.о. |
|
) K T 100 |
|
|
|
|
X % |
CH ONa |
CH ONa |
|
|
. |
|
|
|||
|
3 |
|
3 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
a
3. Цериметрия.
Данный метод основан на способности фенолов окислятся. При этом молекула фенола окисляется до специфических продуктов:
Избыток титранта устанавливают йодиметрически:
57
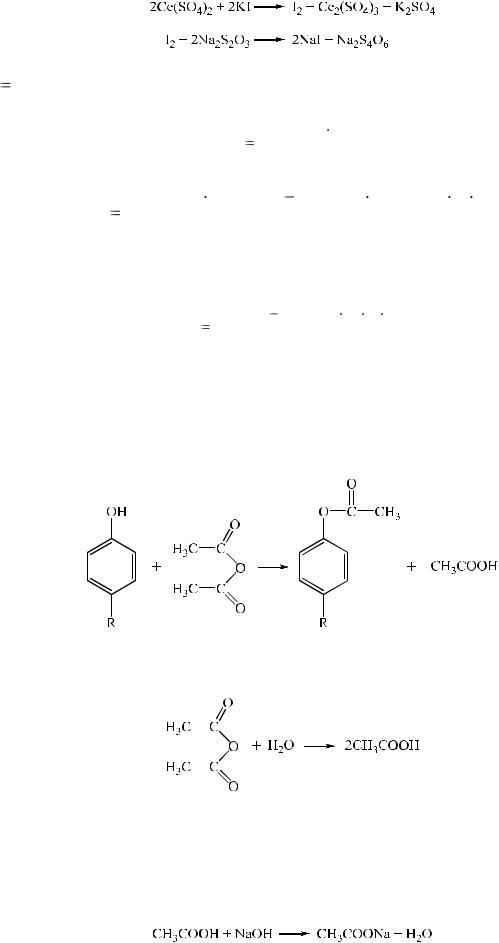
f 1/ z, z = количеству отданных электронов.
|
TCe(SO ) |
|
|
|
Сэ(Ce(SO ) |
) |
|
M (1/ z)препарата |
, |
|
|
|||||||||||
|
|
|
|
|
|
|
|
4 |
2 |
|
|
|
|
|
|
|
|
|
|
|||
|
/ препарат |
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|||||||
|
4 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
X% |
(VCe(SO ) |
|
KCe(SO |
|
) |
|
VNa S O |
|
K Na S O |
|
) T 100 |
|||||||||||
4 |
2 |
|
|
|
|
4 |
|
2 |
|
|
|
2 |
2 |
|
3 |
2 |
2 |
|
3 |
. |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
a |
|
|
|
|
|
|
|
|
|
|
|
Расчетная формула содержания препарата с учетом контрольного |
||||||||||||||||||||||
опыта: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
к.о. |
|
|
|
|
|
VNa S O ) |
K T 100 |
|
|
|
|
|
||||||
|
X % |
|
(VNa S O |
|
|
. |
|
|
|
|
||||||||||||
|
|
2 |
2 |
|
3 |
|
|
2 |
2 |
|
3 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
a
4. Метод ацетилирования.
Метод количественного определения веществ, содержащих как фенольный, так и спиртовый гидроксил, основанный на реакции этерификации избытком уксусного ангидрида:
Избыток уксусного ангидрида разлагают водой:
Затем натрия гидроксидом оттитровывают уксусную кислоту, образовавшуюся в результате реакции этерификации и в результате разложения избытка уксусного ангидрида. Следовательно, необходима постановка контрольного опыта!
58
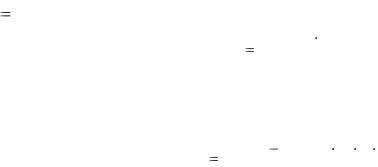
f 1.
T |
Сэ( NaOH) M (1/ z)препарата |
, |
NaOH/ препарат |
1000 |
|
|
|
Расчетная формула содержания препарата с учетом контрольного опыта:
X % |
(V к.о. |
V ) K T 100 |
. |
|
NaOH |
NaOH |
|||
|
|
|||
|
|
a |
|
59
