
- •1. Методы исследования органических соединений, содержащих ковалентно-связанный галоген
- •Идентификация галогенид-ионов
- •Количественное определение галогенидов
- •Методы идентификации органических соединений, содержащих ковалентно-связанный атом серы
- •Методы количественного определения органических соединений, содержащих ковалентно-связанный атом серы
- •3. Методы исследования органических соединений, Содержащих кратные связи
- •Методы идентификации органических соединений, содержащих кратные связи
- •Методы количественного определения органических соединений, содержащих кратные связи
- •4. Методы исследования веществ, содержащих спиртовый гидроксил
- •Методы идентификации веществ, содержащих спиртовый гидроксил
- •Количественное определение веществ, содержащих спиртовый гидроксил
- •5. Методы исследования веществ, содержащих енольный гидроксил
- •Методы идентификации веществ, содержащих енольный гидроксил
- •Количественное определение веществ, содержащих енольный гидроксил
- •6. Методы исследования веществ, содержащих альдегидную и кетонную группы
- •Методы идентификации веществ, содержащих альдегидную и кетонную группы
- •Количественное определение веществ, содержащих альдегидную группу
- •Количественное определение веществ, содержащих кетогруппу
- •Методы идентификации карбоновых кислот и их солей
- •Методы количественного определения карбоновых кислот
- •Методы количественного определения солей карбоновых кислот
- •8. Методы исследования веществ, содержащих сложноэфирную и амидную группы
- •Количественное определение веществ, содержащих сложноэфирную и амидную группы
- •9. Методы исследования веществ, содержащих третичный атом азота и алифатическую аминогруппу
- •Методы идентификации веществ, содержащих третичный атом азота, алифатическую аминогруппу
- •Методы количественного определения веществ, содержащих третичный атом азота и алифатическую аминогруппу
- •10. Методы исследования веществ, содержащих ароматическую аминогруппу и нитрогруппу
- •Методы идентификации веществ, содержащих ароматическую аминогруппу и нитрогруппу
- •Количественное определение веществ, содержащих ароматическую аминогруппу и нитрогруппу
- •11. Методы исследования веществ, содержащих фенольный гидроксил
- •Методы идентификации веществ, содержащих фенольный гидроксил
- •Количественное определение фенолов
- •Литература
X% |
|
VHg( NO ) |
|
K T 100 |
|
||||||
|
|
|
3 |
|
2 |
|
. |
|
|||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
a |
|
|
|
Расчетная формула содержания препарата с учетом контрольного |
|||||||||||
опыта: |
|
|
|
|
|
|
|
|
|
|
|
|
(V |
Hg ( NO ) |
|
V |
к.о. |
|
) K T 100 |
|
|||
X % |
|
Hg ( NO ) |
|
|
. |
||||||
3 |
2 |
|
|
|
3 |
2 |
|
||||
|
|
|
|
|
|
|
|||||
a
10. МЕТОДЫ ИССЛЕДОВАНИЯ ВЕЩЕСТВ, СОДЕРЖАЩИХ АРОМАТИЧЕСКУЮ АМИНОГРУППУ И НИТРОГРУППУ
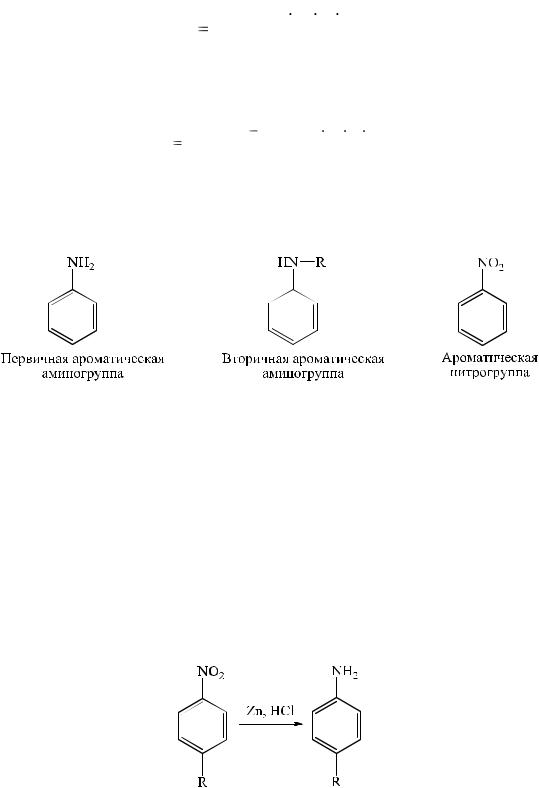
Первичную или вторичную ароматическую аминогруппу содержат производные п-аминобензойной кислоты (новокаин, анестезин, дикаин, натрия диклофенак и др.) и п-аминосалициловой кислоты (п- аминосалицилат), сульфаниламиды (сульфацил-натрий, стрептоцид и др.). Некоторые лекарственные препараты образуют соединения с первичной ароматической аминогруппой в результате гидролитического разложения: производное п-аминосалициловой кислоты (бепаск), п-аминофенола (парацетамол.), бензодиазепина (феназепам, нитразепам и др.) либо в результате восстановления ароматической нитрогруппы: производные нитрофенилалкиламина (левомицетин), 8-оксихинолина (нитроксолин), производные 5-нитрофурана (фурацилин, фуразолидон и др.).
Взаимное влияние атомов в молекуле сказывается на свойствах ароматических аминов. Неподеленная электронная пара атома азота первичной ароматической аминогруппы участвует в сопряжении с π- электронной системой бензольного кольца. В результате происходит смещение электронной плотности, которое приводит к активации орто- и пара-положений в ароматическом ядре и снижению основности атома азота в
46
аминогруппе. Таким образом, ароматические амины являются слабыми основаниями.
Для ароматических аминов характерны реакции образования азокрасителя, конденсации, галогенирования, окисления.
Методы идентификации веществ, содержащих ароматическую аминогруппу и нитрогруппу
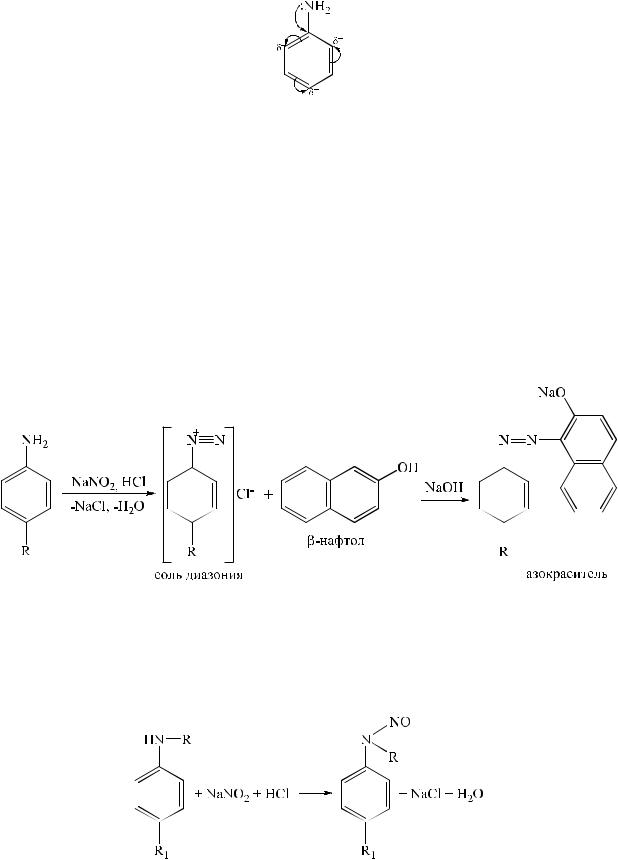
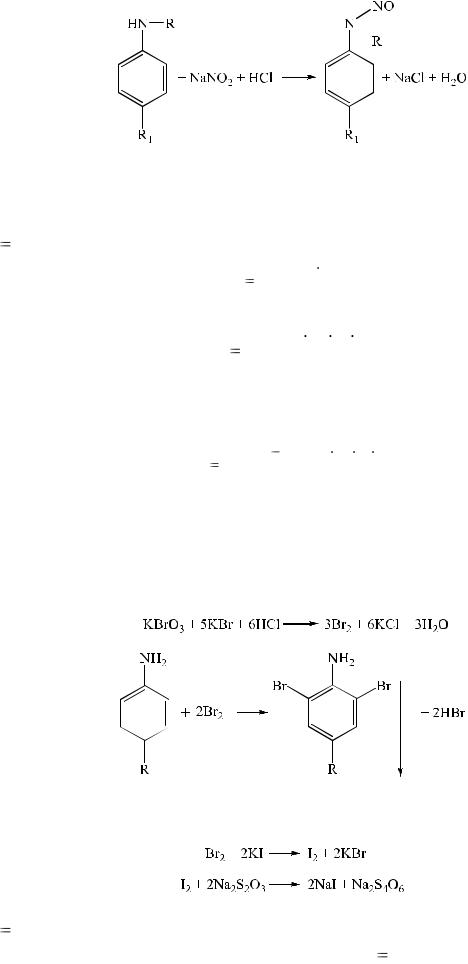
1. Реакция образования азокрасителя. Реакция диазотирования протекает под действием натрия нитрита в кислой среде. В результате образуются нестойкие соли диазония. При последующем добавлении щелочного раствора какого-либо фенола (β-нафтол, резорцин и др.) образуется азокраситель вишневого, красного или оранжево-красного цвета.
Азокраситель также можно получить, если к соли диазония прибавить слабокислый раствор какого-либо ароматического амина.
Вторичные амины под действием натрия нитрита образуют нитрозосоединения.
47
Эти реакции положены в основу нитритометрического метода анализа ароматических аминов.
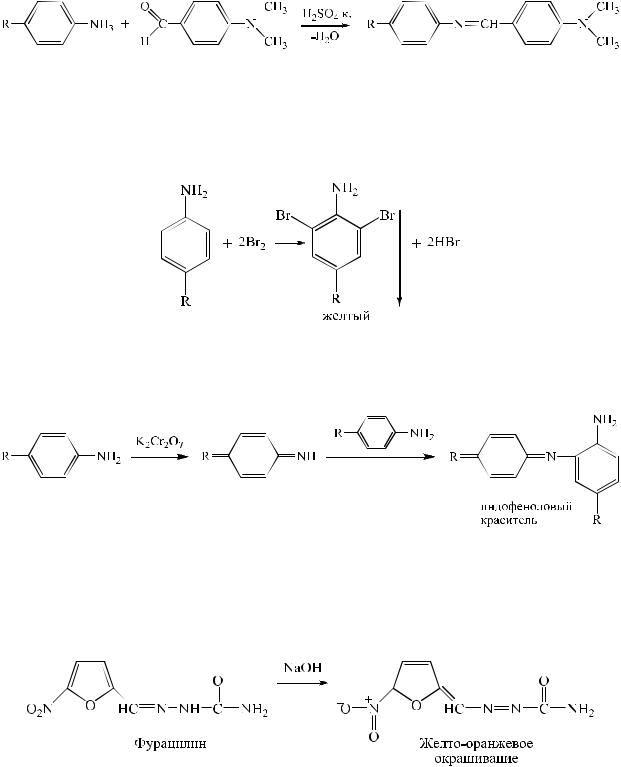
2.Реакции конденсации. Ароматические амины вступают в реакции конденсации с 2,4-динитрохлорбензолом, альдегидами и другими веществами. В результате взаимодействия аминов с альдегидами образуются основания Шиффа – окрашенные в желтый или оранжево-желтый цвет соединения.
3.Реакции галогенирования. Замещение происходит в орто- и параположения относительно аминогруппы. В результате реакции бромирования образуются белые или желтые осадки, и происходит обесцвечивание бромной воды.
4. Реакции окисления. Под действием различных окислителей ароматические амины образуют индофеноловые красители.
5. Реакция на ароматическую нитрогруппу.
При действии щелочи на соединение, содержащее нитрогруппу, происходит усиление окраски до желтого, желто-оранжевого или красного цветов в результате образование аци-соли.
48
Количественное определение веществ, содержащих ароматическую аминогруппу и нитрогруппу
1. Нитритометрия.
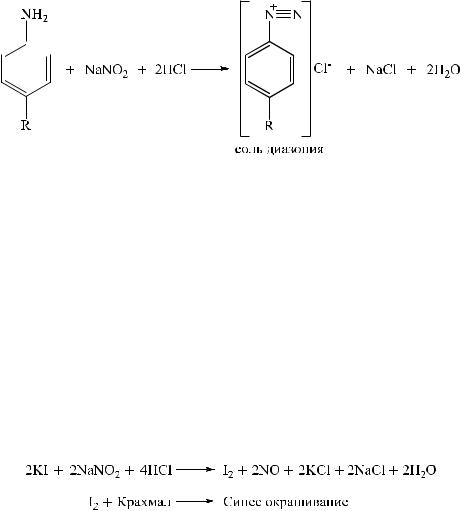
Метод основан на реакции диазотирования первичных и вторичных ароматических аминов нитритом натрия, который используют в качестве титранта. Титрование ведут в кислой среде (в среде хлористоводородной кислоты), при пониженной температуре, чтобы предотвратить разложение азотистой кислоты и соли диазония; в качестве катализатора используют калия бромид. Реакция диазотирования протекает во времени, поэтому титрование ведут медленно.
Точку эквивалентности можно зафиксировать тремя способами:
1)потенциометрически;
2)с помощью внутренних индикаторов – тропеолина 00 (переход окраски от красной к желтой), тропеолина 00 в смеси с метиленовым синим (переход окраски от красно-фиолетовой к голубой), нейтрального красного (переход окраски от красно-фиолетовой к синей);
3)с помощью внешних индикаторов, например, йодкрахмальной бумаги. Йодкрахмальная бумага – пористая беззольная фильтровальная бумага,
пропитанная раствором крахмала с калия йодидом и высушенная в темном месте. Титрование ведут до тех пор, пока капля титруемого раствора, взятая через 1 минуту после прибавления титранта, не будет немедленно вызывать синее окрашивание на полоске йодкрахмальной бумаги.
Вторичные ароматические амины с нитритом натрия образуют нитрозосоединения:
49
Условия титрования аналогичные.
Нитросоединения вступают в реакцию диазотирования после предварительного восстановления нитрогруппы в аминогруппу.
f 1.
|
Сэ( NaNO ) |
M (1/ z)препарата |
|
|
2 |
|
|
|
|
TNaNO / препарат |
|
|
|
, |
|
1000 |
|
||
2 |
|
|
|
|
|
|
|
|
|
X% |
|
VNaNO |
K T 100 |
|
||||||
|
|
|
2 |
|
|
. |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
|
|
|
|
Расчетная формула содержания препарата с учетом контрольного |
||||||||||
опыта: |
|
|
|
|
|
|
|
|
|
|
|
(V |
NaNO |
|
V к.о. |
|
|
) K T 100 |
|
||
X % |
|
2 |
NaNO |
2 |
|
|
. |
|||
a
2. Броматометрия.
Как правило, используется обратный способ титрования. Метод основан на реакции электрофильного замещения с образованием диили трибромпроизводных.
Избыток брома устанавливают йодиметрически, индикатор – крахмал :
f 1/ z, z = количеству атомов брома, |
участвующих в реакции |
электрофильного замещения. В данном случае f |
1/ 4 . |
50 |
|
|
TKBrO / препарат |
Сэ( KBrO ) |
M (1/ z)препарата |
, |
|
|
||||||
|
|
3 |
|
|
|
|
|
|
|
|||
|
|
|
1000 |
|
|
|
|
|
||||
|
3 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
X% |
(VKBrO |
K KBrO |
VNa S O |
|
K Na S O |
|
|
) T 100 |
||||
3 |
3 |
2 |
2 |
3 |
2 |
2 |
3 |
. |
||||
|
|
|
||||||||||
a
Расчетная формула содержания препарата с учетом контрольного опыта:
|
к.о. |
|
|
VNa S O |
) K T 100 |
|
||
X % |
(VNa S O |
. |
||||||
2 |
2 |
3 |
2 |
2 |
3 |
|
||
|
|
|
||||||
a
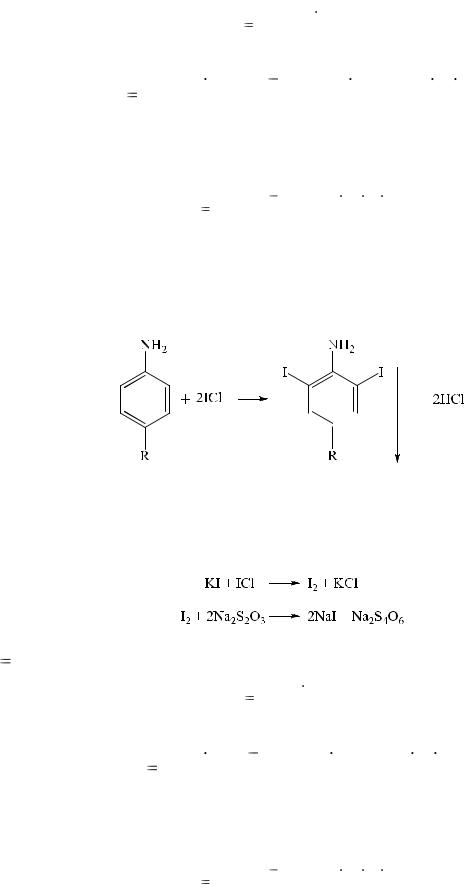
3. Йодхлорметрия.
Данный метод, как и броматометрия, основан на реакции электрофильного замещения с образование дийодпроизводных:
Затем прибавляют 10% раствор калия йодида, который взаимодействует с избытком йодмонохлорида, и выделившийся йод оттитровывают раствором тиосульфата натрия:
f 1/ 4 .
|
T |
|
|
Сэ( ICl) |
|
M (1/ z)препарата |
, |
|
|
|
||||||
|
ICl / препарат |
|
|
|
|
1000 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
(VICl K ICl |
|
VNa S O |
|
|
K Na S O |
) T 100 |
. |
||||||||
X% |
|
|
2 |
2 |
|
|
3 |
|
2 |
2 |
3 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
a |
|
|
|
|
|
|
|
|
|
Расчетная формула содержания препарата с учетом контрольного |
||||||||||||||||
опыта: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
к.о. |
|
|
|
|
|
|
|
) K T 100 |
|
|
|
|||
|
X % |
(VNa S O VNa S O |
. |
|
|
|||||||||||
|
2 |
2 |
3 |
2 |
2 |
3 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||||||
a
51
