
- •1. Методы исследования органических соединений, содержащих ковалентно-связанный галоген
- •Идентификация галогенид-ионов
- •Количественное определение галогенидов
- •Методы идентификации органических соединений, содержащих ковалентно-связанный атом серы
- •Методы количественного определения органических соединений, содержащих ковалентно-связанный атом серы
- •3. Методы исследования органических соединений, Содержащих кратные связи
- •Методы идентификации органических соединений, содержащих кратные связи
- •Методы количественного определения органических соединений, содержащих кратные связи
- •4. Методы исследования веществ, содержащих спиртовый гидроксил
- •Методы идентификации веществ, содержащих спиртовый гидроксил
- •Количественное определение веществ, содержащих спиртовый гидроксил
- •5. Методы исследования веществ, содержащих енольный гидроксил
- •Методы идентификации веществ, содержащих енольный гидроксил
- •Количественное определение веществ, содержащих енольный гидроксил
- •6. Методы исследования веществ, содержащих альдегидную и кетонную группы
- •Методы идентификации веществ, содержащих альдегидную и кетонную группы
- •Количественное определение веществ, содержащих альдегидную группу
- •Количественное определение веществ, содержащих кетогруппу
- •Методы идентификации карбоновых кислот и их солей
- •Методы количественного определения карбоновых кислот
- •Методы количественного определения солей карбоновых кислот
- •8. Методы исследования веществ, содержащих сложноэфирную и амидную группы
- •Количественное определение веществ, содержащих сложноэфирную и амидную группы
- •9. Методы исследования веществ, содержащих третичный атом азота и алифатическую аминогруппу
- •Методы идентификации веществ, содержащих третичный атом азота, алифатическую аминогруппу
- •Методы количественного определения веществ, содержащих третичный атом азота и алифатическую аминогруппу
- •10. Методы исследования веществ, содержащих ароматическую аминогруппу и нитрогруппу
- •Методы идентификации веществ, содержащих ароматическую аминогруппу и нитрогруппу
- •Количественное определение веществ, содержащих ароматическую аминогруппу и нитрогруппу
- •11. Методы исследования веществ, содержащих фенольный гидроксил
- •Методы идентификации веществ, содержащих фенольный гидроксил
- •Количественное определение фенолов
- •Литература

|
(V к.о. |
V |
) K T 100 |
|
X % |
соли Мора |
соли Мора |
|
. |
|
a |
|
||
|
|
|
|
Возможно применение и других методов оксидиметрии для количественного определения препаратов альдегидов.
3. Йодиметрия, основанная на реакции с реактивом Несслера.
f 1/ 2 .
TI2 / препарат |
Сэ( I2 ) |
M (1/ z)препарата |
, |
|
|
1000 |
|
||
|
|
|
|
|
X% |
(VI |
|
K I |
|
VNa S O |
|
|
K Na S O |
) T 100 |
. |
||||||||
|
2 |
2 |
|
|
2 |
2 |
|
|
3 |
|
2 |
2 |
3 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
a |
|
|
|
|
|
|
|
|
Расчетная формула содержания препарата с учетом контрольного |
||||||||||||||||||
опыта: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
к.о. |
|
|
VNa S O |
) K T 100 |
|
|
|
|||||||
|
X % |
|
(VNa S O |
. |
|
|
||||||||||||
|
|
2 |
2 |
3 |
|
|
2 |
|
2 |
3 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
a
Количественное определение веществ, содержащих кетогруппу
1. Оксимный метод.
Метод основан на способности кетонов образовывать оксим при взаимодействии с раствором гидроксиламина гидрохлорида. При этом выделяется эквивалентное количество хлористоводородной кислоты, которую оттитровывают щелочью:
27

f 1.
T |
|
Сэ( NaOH) M (1/ z)препарата |
, |
|||
NaOH/ препарат |
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
X% |
VNaOH |
K T 100 |
. |
|
||
|
|
a |
|
|
||
|
|
|
|
|
||
Расчетная формула содержания препарата с учетом контрольного опыта:
X % |
(V |
V к.о. ) K T 100 |
. |
|
NaOH |
NaOH |
|||
|
|
|||
|
|
a |
|
Эту реакцию можно использовать и для гравиметрического определения кетонов. Образовавшийся осадок оксима отфильтровывают, высушивают до постоянной массы и взвешивают.
7.МЕТОДЫ ИССЛЕДОВАНИЯ КАРБОНОВЫХ КИСЛОТ
ИИХ СОЛЕЙ
Карбоновыми кислотами, называются соединение, в которых содержится карбоксильная группа.
Карбоновые кислоты обладают кислотными свойствами за счет наличия подвижного протона водорода в карбоксильной группе. В водных растворах они слабо диссоциированны, кислая среда обнаруживается с помощью индикаторов.
А также в молекулах карбоновых кислот есть электрофильный центр – атом углерода карбоксильной группы, при участии которого карбоновые кислоты вступают в реакции нуклеофильного замещения.
Методы идентификации карбоновых кислот и их солей
Карбоновые кислоты и их соли можно идентифицировать с помощью:
1. реакций соле- и комплексообразования с катионами тяжелых металлов. Малорастворимые кислоты сначала переводят в натриевую или калиевую водорастворимую соль, затем проводят реакцию с солями тяжелых металлов
28

(железа (III) хлорида, меди (II) сульфата, кобальта нитрата, ртути (II) нитрата, свинца ацетата и др.).
При проведении реакции необходимо учитывать, что при растворении кислот в растворе натрия (калия) гидроксида, эти реактивы не должны быть добавлены в избытке, иначе гидроксиды тяжелых металлов маскируют своей окраской результаты основной реакции.
Соответственно, водорастворимые лекарственные средства, представляющие собой соли соединений кислотного характера (натриевые, калиевые, литиевые и др.), могут сразу вступать в реакцию обмена с катионами тяжелых металлов с образованием солей.
2. Соли карбоновых кислот можно идентифицировать по наличию соответствующего катиона.
а) на ион натрия, реакция с пикриновой кислотой:
б) на ион калия, реакция с кислотой винной в присутствии раствора натрия ацетата:
в) на ион кальция, реакция с аммония оксалатом:
29
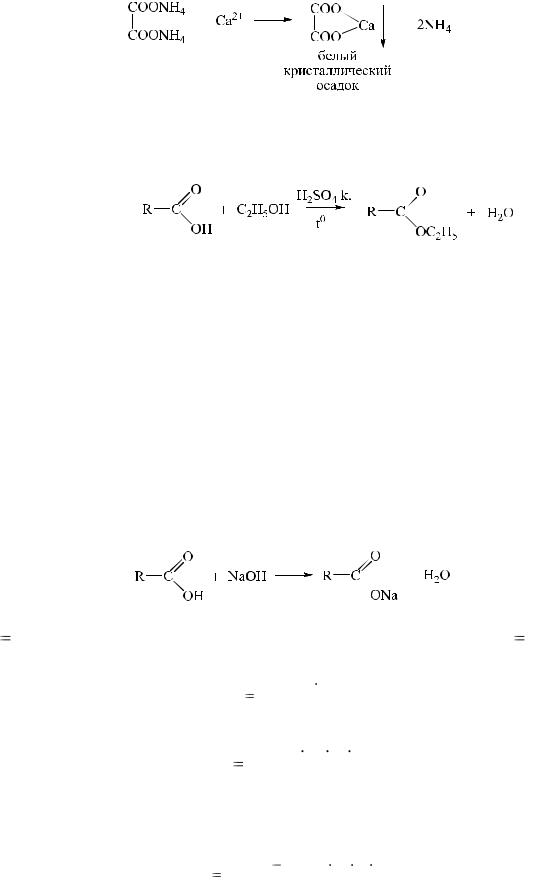
3. Реакции нуклеофильного замещения со спиртами в присутствии водоотнимающих средств.
При образовании низкомолекулярных эфиров, летучих соединений, появляется характерный запах, высокомолекулярных – выпадают белые осадки с определенной температурой плавления.
Методы количественного определения карбоновых кислот
1. Алкалиметрия в водных и спиртовых средах (для веществ с сильно выраженными кислотными свойствами).
Для карбоновых кислот характерны реакции нейтрализации с сильными основаниями. В случае нерастворимых в воде соединений их растворяют в спирте или ацетоне. Титрантом служит раствор натрия (калия) гидроксида, индикатор – фенолфталеин.
f 1/ z, z = количеству карбоксильных групп. В данном случае f 1.
T |
|
Сэ( NaOH) M (1/ z)препарата |
, |
|||
NaOH/ препарат |
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
X% |
VNaOH |
K T 100 |
. |
|
||
|
|
a |
|
|
||
|
|
|
|
|
||
Расчетная формула содержания препарата с учетом контрольного опыта:
X % |
(V |
V к.о. ) K T 100 |
. |
|
NaOH |
NaOH |
|||
|
|
|||
|
|
a |
|
2. Алкалиметрия в неводных средах (для веществ слабокислотного характера).
30
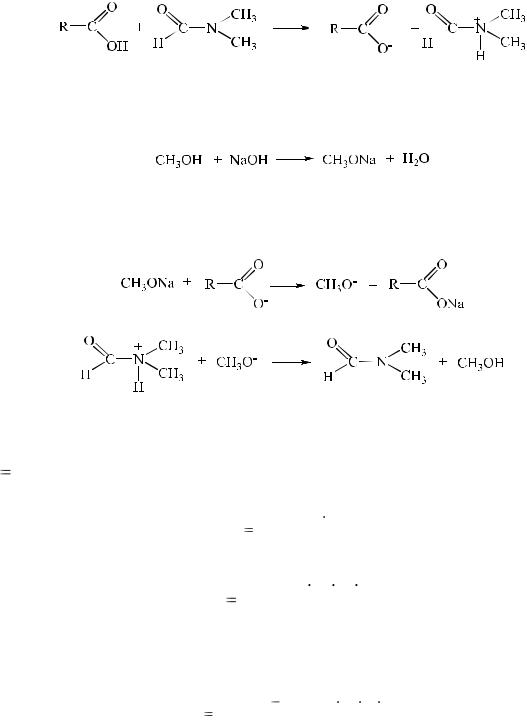
В качестве растворителя используют раствор диметилформамида или его смесь с бензолом, а также этилендиамин, бутиламин, пиридин. В присутствии данных растворителей происходит усиление кислотных свойств анализируемого вещества.
Титрантом служит раствор гидроксида натрия в смеси метилового спирта и бензола или раствор метилата натрия (метилата лития).
Соединения, растворенные в диметилформамиде, количественно взаимодействуют с метилатом натрия.
Индикатор – тимоловый синий. Параллельно проводят контрольный
опыт.
f 1/ z, z = количеству карбоксильных групп.
TCH ONa/ препарат |
|
Сэ(CH ONa) M (1/ z)препарата |
, |
|||||||
|
|
3 |
|
|
|
|
|
|||
|
|
|
1000 |
|
|
|
||||
3 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
VCH3ONa |
K T 100 |
|
|
|
||||
X% |
|
|
|
|
|
. |
|
|
|
|
|
|
|
a |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Расчетная формула содержания препарата с учетом контрольного |
||||||||||
опыта: |
|
|
|
|
|
|
|
|
|
|
|
(V |
|
|
V к.о. |
|
) K T 100 |
|
|
|
|
X % |
CH ONa |
CH ONa |
|
|
. |
|
|
|||
|
3 |
|
3 |
|
|
|
|
|
||
a
31
