
- •1. Методы исследования органических соединений, содержащих ковалентно-связанный галоген
- •Идентификация галогенид-ионов
- •Количественное определение галогенидов
- •Методы идентификации органических соединений, содержащих ковалентно-связанный атом серы
- •Методы количественного определения органических соединений, содержащих ковалентно-связанный атом серы
- •3. Методы исследования органических соединений, Содержащих кратные связи
- •Методы идентификации органических соединений, содержащих кратные связи
- •Методы количественного определения органических соединений, содержащих кратные связи
- •4. Методы исследования веществ, содержащих спиртовый гидроксил
- •Методы идентификации веществ, содержащих спиртовый гидроксил
- •Количественное определение веществ, содержащих спиртовый гидроксил
- •5. Методы исследования веществ, содержащих енольный гидроксил
- •Методы идентификации веществ, содержащих енольный гидроксил
- •Количественное определение веществ, содержащих енольный гидроксил
- •6. Методы исследования веществ, содержащих альдегидную и кетонную группы
- •Методы идентификации веществ, содержащих альдегидную и кетонную группы
- •Количественное определение веществ, содержащих альдегидную группу
- •Количественное определение веществ, содержащих кетогруппу
- •Методы идентификации карбоновых кислот и их солей
- •Методы количественного определения карбоновых кислот
- •Методы количественного определения солей карбоновых кислот
- •8. Методы исследования веществ, содержащих сложноэфирную и амидную группы
- •Количественное определение веществ, содержащих сложноэфирную и амидную группы
- •9. Методы исследования веществ, содержащих третичный атом азота и алифатическую аминогруппу
- •Методы идентификации веществ, содержащих третичный атом азота, алифатическую аминогруппу
- •Методы количественного определения веществ, содержащих третичный атом азота и алифатическую аминогруппу
- •10. Методы исследования веществ, содержащих ароматическую аминогруппу и нитрогруппу
- •Методы идентификации веществ, содержащих ароматическую аминогруппу и нитрогруппу
- •Количественное определение веществ, содержащих ароматическую аминогруппу и нитрогруппу
- •11. Методы исследования веществ, содержащих фенольный гидроксил
- •Методы идентификации веществ, содержащих фенольный гидроксил
- •Количественное определение фенолов
- •Литература
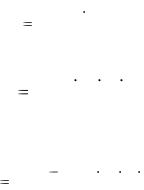
T |
|
Сэ( HCl) |
M (1/ z)препарата |
, |
||
HCl/ препарат |
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
X% |
VHCl |
K T 100 |
. |
|
||
|
|
a |
|
|
||
|
|
|
|
|
||
Расчетная формула содержания препарата с учетом контрольного опыта:
X % |
(V |
V к.о.) K T 100 |
. |
|
HCl |
HCl |
|||
|
|
|||
|
|
a |
|
Для определения лекарственных веществ, амидная группа которых легко поддается щелочному гидролизу, используют упрощенный вариант метода Къельдаля. Он сводится к разрушения препарата 30% раствором натрия гидроксида в колбе Къельдаля и последующей отгонке выделившегося аммиака в приемник с борной кислотой. Далее поступают как указано в вышеприведенной схеме.
9. МЕТОДЫ ИССЛЕДОВАНИЯ ВЕЩЕСТВ, СОДЕРЖАЩИХ ТРЕТИЧНЫЙ АТОМ АЗОТА И АЛИФАТИЧЕСКУЮ АМИНОГРУППУ
Соединения, содержащие атом азота (дибазол, теофилин, кодеин, морфина гидрохлорид, атропина сульфат, папаверина гидрохлорид и др.), проявляют основные свойства, что обусловлено наличием в нем неподеленной электронной пары электронов. Сила основных свойств зависит от природы и количества, связанных с азотом радикалов. Ароматические амины проявляют менее выраженные основные свойства по сравнению с алифатическими аминами. А также чем больше у атома азота радикалов и чем они развлетвленнее, тем слабее проявляются основные свойства данных соединений.
Методы идентификации веществ, содержащих третичный атом азота, алифатическую аминогруппу
Вещества основного характера и их соли, образуют простые или комплексные соли с «цветными» и «общеосадительными» реактивами, а также соли участвуют в реакции нейтрализации с образованием нерастворимых оснований.
1. С пикриновой кислотой. Образование игольчатых кристаллов желтого цвета, характерной формы с определенной температурой плавления.
39
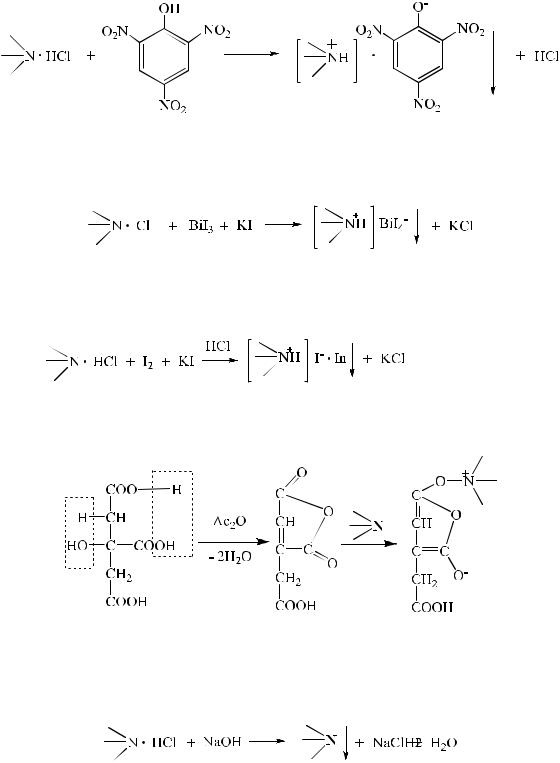
2.С реактивом Драгендорфа. Образование комплексной соли, в виде осадка желтого цвета.
3.С реактивом Бушарда (Люголя, Вагнера). Образование комплексной соли, в виде осадка бурого цвета.
, где n=4, 6, 8.
4. С лимонной кислотой в среде уксусного ангидрида.
5.С растворами щелочей. При нейтрализации солей выделяются органические основания в виде белого осадка с определенной температурой плавления.
Атакже к группе «цветных» реактивов относят: концентрированную кислоту серную, концентрированную кислоту азотную, реактив Марки, реактив Эрдмана.
6.Для алифатических аминов, кроме вышеперечисленных реакций, проводят нингидриновую пробу.
40
Методы количественного определения веществ, содержащих третичный атом азота и алифатическую аминогруппу
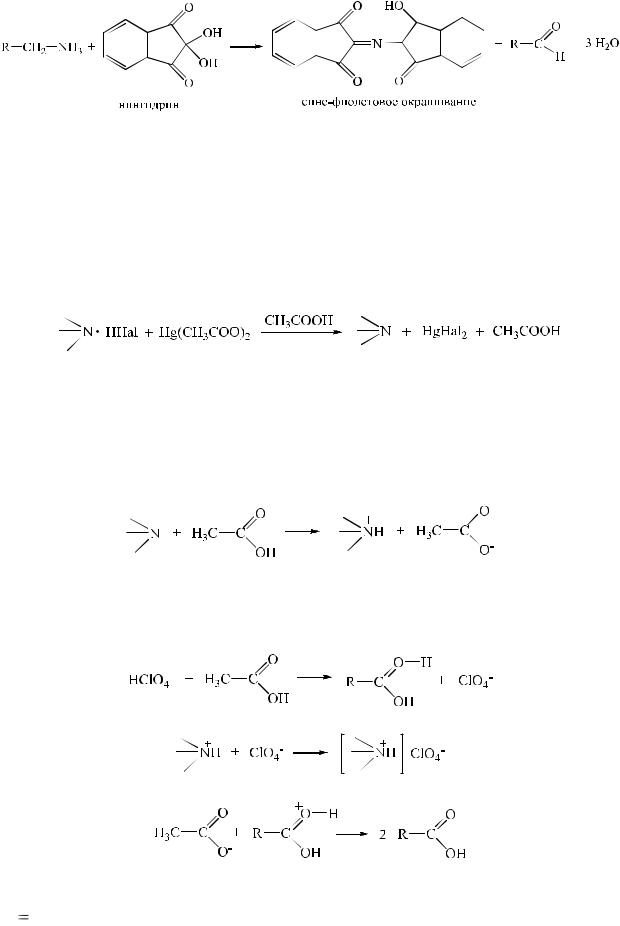
1. Ацидиметрия в неводных средах.
При количественном определении солей галогеноводородных кислот органических оснований добавляют ртути (II) ацетат, для подавления диссоциации галогеноводородных кислот.
Далее количественное определение солей проводится аналогично количественному определению органических оснований.
Титрование выполняют, используя в качестве кислотного растворителя для усиления слабых основных свойств безводные уксусную и муравьиную кислоты, уксусный ангидрид и их смеси.
Титрантом служит раствор кислоты хлорной, которую также растворяют в ледяной уксусной кислоте.
Индикатор – кристаллический фиолетовый.
f 1/ z, z = количеству атомов азота основного характера в структуре соединения.
41
THClO / препарат
4
X%
Сэ( HClO ) M (1/ z)препарата ,
4
1000
VHClO4  K
K  T
T  100 .
100 .
a
Расчетная формула содержания препарата с учетом контрольного опыта:
|
(V |
V к.о. ) K T 100 |
|
X % |
HClO4 |
HClO4 |
. |
|
a |
||
|
|
|
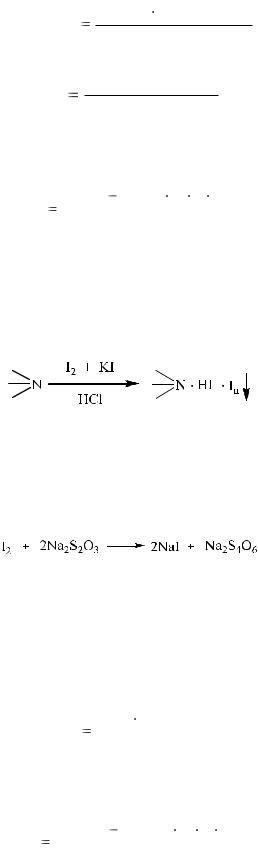
2. Иодиметрия.
Для количественного определения веществ основного характера используют также иодиметрию, основанную на способности анализируемых веществ образовывать комплексы с раствором иода:
Для этого используют титрованный раствор иода, который добавляют в избытке. Полученный осадок комплекса препарата с титрантом отфильтровывают, а оставшийся в растворе иод оттитровывают раствором натрия тиосульфата:
Индикатор – крахмал.
Параллельно проводят контрольный опыт.
Иодиметрия используется только для веществ, имеющих постоянный состав полииодида (димедрол, атропин и др.). Фактор эквивалентности зависит от состава полииодида и может быть равен 1/4, 1/6 и т.д.
TI2 / препарат |
Сэ( I2 ) |
M (1/ z)препарата |
, |
|
|
1000 |
|
||
|
|
|
|
|
Расчетная формула содержания препарата с учетом контрольного опыта:
|
к.о. |
|
|
VNa S O |
) K T 100 |
|
||
X % |
(VNa S O |
. |
||||||
2 |
2 |
3 |
2 |
2 |
3 |
|
||
|
|
|
||||||
a
3. Метод Къельдаля.
Метод основан на минерализации лекарственного вещества под воздействием серной кислоты концентрированной при нагревании в присутствии катализаторов. При этом выделяется аммония гидросульфат,
42

который перегоняют с паром в приемник, содержащий борную кислоту. Затем образовавшуюся смесь мета- и тетраборатов оттитровывают раствором хлористоводородной кислоты.
В качестве катализатора в методе Къельдаля используют соли меди, индикатор – смесь метилового оранжевого и метиленового синего.
f 1/ z, z = количеству атомов азота в молекуле определяемого вещества.
T |
|
Сэ( HCl) |
M (1/ z)препарата |
, |
||
HCl/ препарат |
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
X% |
VHCl |
K T 100 |
. |
|
||
|
|
a |
|
|
||
|
|
|
|
|
||
Расчетная формула содержания препарата с учетом контрольного опыта:
X % |
(V |
V к.о.) K T 100 |
. |
|
HCl |
HCl |
|||
|
|
|||
|
|
a |
|
4. Ацидиметрия в водных и спиртовых средах.
Данным методом определяются органические основания с сильными основными свойствами (кодеин). Титранты – растворы сильных кислот (хлороводородной или серной кислотами) в водных или спиртовых средах.
Индикатор – метиленовый оранжевый.
f 1/ z, z = количеству атомов азота основного характера в структуре соединения.
T |
|
Сэ( HCl) |
M (1/ z)препарата |
, |
||
HCl/ препарат |
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
X% |
VHCl |
K T 100 |
. |
|
||
|
|
a |
|
|
||
|
|
|
|
|
||
Расчетная формула содержания препарата с учетом контрольного опыта:
43

X % |
(V |
V к.о.) K T 100 |
. |
|
HCl |
HCl |
|||
|
|
|||
|
|
a |
|
5. Алкалиметрия.
Алкалиметрически определяются соли слабых органических оснований. Титрант – раствор натрия гидроксида. Для предупреждения взаимодействия высвобождающегося основания с индикатором добавляется органический растворитель (хлороформ, диэтиловый эфир), извлекающий основание.
f 1/ z, z = количеству связанных молекул галогенводородных кислот.
T |
|
Сэ( NaOH) M (1/ z)препарата |
, |
|||
NaOH/ препарат |
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
X% |
VNaOH |
K T 100 |
. |
|
||
|
|
a |
|
|
||
|
|
|
|
|
||
Расчетная формула содержания препарата с учетом контрольного опыта:
|
(V |
Vê.î. |
) K T 100 |
|
|
X% |
NaOH |
NaOH |
|
|
. |
|
a |
|
|
||
|
|
|
|
|
|
6. Аргентометрия.
Аргентометрически определяют количественное содержание солей органических оснований и галогенводородных кислот. Метод прямого титрования по Мору применять не рекомендуется, так как при растворении данных солей в воде образуется слабокислая среда, ведущая к растворению осадка серебра хромата, возникающего в точке эквивалентности.
а) Метод Фольгарда.
Титрование проводят в азотнокислой среде. Метод заключается в осаждении галогенидов избытком раствором серебра нитрата, избыток последнего оттитровывается раствором аммония роданида в присутствии индикатора железоаммонийных квасцов до появления красной окраски, свойственной железа (III) роданиду.
44

f 1.
X%
TAgNO / препарат |
Сэ( AgNO ) M (1/ z)препарата |
, |
|
|||
|
3 |
|
|
|
||
|
1000 |
|
|
|
||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
(VAgNO3 K AgNO3 |
VNH4 NCS |
K NH4 NCS ) T 100 |
||||
|
|
|
|
|
|
. |
|
|
a |
|
|
|
|
|
|
|
|
|
|
|
Расчетная формула содержания препарата с учетом контрольного опыта:
|
(V к.о. |
V |
NH NCS |
) K T 100 |
|
X % |
NH NCS |
|
|
. |
|
4 |
|
4 |
|
||
|
|
|
|
a
б) Метод Фаянса.
Титрование осуществляется в уксуснокислой среде в присутствии адсорбционных индикаторов: хлориды и бромиды определяют с бромфеноловым синим, иодиды – с эозинатом натрия. Титрант – серебра нитрат.
f 1.
TAgNO / препарат
3
X%
Сэ( AgNO ) M (1/ z)препарата ,
3
1000
VAgNO3  K
K  T
T  100 .
100 .
a
7. Меркуриметрия.
Для солей органических оснований и галогенводородных кислот может быть рекомендован меркуриметрический метод. Титрантом служит раствор ртути (II) нитрата, индикатором – дифенилкарбазид.
f 1.
THg( NO ) / препарат |
Сэ( Hg( NO ) |
) |
M (1/ z)препарата |
, |
|||
3 |
2 |
|
|
|
|||
|
|
|
1000 |
|
|||
3 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
45
