
- •Адренопозитивные средства
- •Классификация адренопозитивных средств
- •Зависимость действия адренореактивных средств от их химической структуры
- •A1,a2-адреномиметики
- •A1-адреномиметики
- •A2-адреномиметики
- •B1,b2-адреномиметики
- •B1-адреномиметики
- •B2-адреномиметики
- •Адреномиметики непрямого действия (симпатомиметики)
Адренопозитивные средства
- Иду к турецкому седлу, - зарычал Филипп Филиппович и окровавленными скользкими перчатками выдвинул серо-желтый мозг Шарика из головы. На мгновение он скосил глаза на морду Шарика, и Борменталь тотчас же сломал вторую ампулу с желтой жидкостью и вытянул ее в длинный шприц.
- В сердце? – робко спросил он.
- Что вы еще спрашиваете? – злобно заревел профессор, - все равно он уже 5 раз у вас умер. Колите! Разве мыслимо? – Лицо у него при этом стало, как у вдохновенного разбойника.
Доктор с размаху легко всадил иглу в сердце пса.
- Живет, но еле-еле, - робко прошептал он.
М. Булгаков «Собачье сердце»
Адренопозитивными (син.: адреномиметиками, адреностимулирующими) называют лекарственные средства, которые стимулируют проведение импульсов в адренергических синапсах, усиливают адренергические влияния, воспроизводя эффекты медиатора норадреналина. Все адренопозитивные средства могут быть разделены на 2 группы:
Прямые адреномиметики – лекарственные средства, которые непосредственно стимулируют адренорецепторы.
Непрямые адреномиметики (симпатимометики) – лекарственные средства, которые усиливают проведение импульсов в адренергических синапсах, не влияя непосредственно на рецепторы.
Классификация адренопозитивных средств
Адреномиметики прямого действия:
,-адреномиметики:
1,2,1,2-адреномиметики:эпинефрин;
1,2,1-адреномиметики:норэпинефрин, дофамин.
-адреномиметики:
1,2-адреномиметики:нафазолин, ксилометазолин
1-адреномиметики:фенилэфрин, метоксамин, мидодрин;
2-адреномиметики:клонидин, апраклонидин, тизанидин.
-адреномиметики:
1,2-адреномиметики:изопреналин;
1-адреномиметики:добутамин;
2-адреномиметики:
короткого действия: фенотерол, орципреналин, тербуталин, сальбутамол;
длительного действия: кленбутерол, сальметерол.
Адреномиметики непрямого действия (симпатомиметики): эфедрин, кокаин.
Зависимость действия адренореактивных средств от их химической структуры
Схема
1. Возможные участки присоединения
заместителей и связанные с ними эффекты. 1
– обеспечение и-адренореативности,
разрушение КОМТ, защита от проникновения
через ГЭБ.
2
– резистентность к действию МАО. 3
– усиление -адренореактивности
и ослабление -адренореативности.
4
– непрямое действие на симпатические
синапсы.
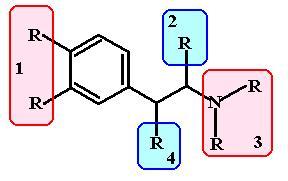
Заместители у бензольного кольца (участок 1 на схеме 1). Гидроксилы в 3 и 4 положениях необходимы для реализации адреномиметического действия лекарства. Удаление одной ОН-группы резко ослабляет -адреномиметическую активность лекарства, при сохранении его -адреномиметического действия. Напротив, перемещение гидроксогруппы из положения 4 в положение 5 резко усиливает 2-адреномиметическую активность лекарства.Кроме того, удаление гидроксогрупп из бензольного кольца защищает лекарство от метаболизма КОМТ и повышает его растворимость в липидах, облегчая проникновение через ГЭБ и усиливая центральные эффекты.
Замещения в аминогруппе (участок 3 на схеме 1).Чем больший размер имеет заместитель в этом положении, тем более выражен-адреномиметический эффект лекарства и тем слабее его-адренореативное действие. Участок стереоселективен:l-замещенные изомеры в 10 раз более активны, чемd-изомеры.
Замещения у углерода в -положении цепи (участок 4 на схеме 1).Заместители в этом положении повышают устойчивость соединения к метаболизму при участии МАО и усиливают его симпатомиметическую активность (непрямое адреномиметическое действие). Этот участок также стереоселективен:d-изомеры в 10 раз более активные симпатомиметики центрального действия, чемl-изомеры.
Замещения у углерода в -положении цепи (участок 2 на схеме 1). Необходимы для реализации прямого действия вещества на рецептор, обеспечивают процесс депонирования симпатомиметических аминов в везикулах варикозного утолщения.
,-адреномиметики
,-адреномиметики – это лекарственные средства, которые при введении в организм человека активируют как-, так и-адренорецепторы.
Эпинефрина гидрохлорид (Epinephrine hydrochloride, Adrenaline hydrochloride)Эндогенный катехоламин, который вырабатывается мозговым веществом надпочечников и играет роль гормона.
М Д:
Эпинефрин при введении в организм
связывается со всеми типами адренорецепторов
и активирует их. Чувствительность
адренорецепторов к адреномиметикам
различная. При введении малых доз
эпинефрина (1-2 мкг/мин внутривенно)
проявляется его влияние, главным образом,
на2-адренорецепторы.
В дозе 4 мкг/мин эпинефрин начинает
стимулировать и1-адренорецепторы.
Только высокие дозы лекарства (10-20
мкг/мин) позволяют ему оказать стимулирующее
действие на-адренорецепторы.
Д:
Эпинефрин при введении в организм
связывается со всеми типами адренорецепторов
и активирует их. Чувствительность
адренорецепторов к адреномиметикам
различная. При введении малых доз
эпинефрина (1-2 мкг/мин внутривенно)
проявляется его влияние, главным образом,
на2-адренорецепторы.
В дозе 4 мкг/мин эпинефрин начинает
стимулировать и1-адренорецепторы.
Только высокие дозы лекарства (10-20
мкг/мин) позволяют ему оказать стимулирующее
действие на-адренорецепторы.
ФК: При введении внутрь эпинефрин неэффективен, т.к. быстро разрушается МАО печени и кишечника, не проникая в системный кровоток. Применяют эпинефрин исключительно парентерально. Действие его непродолжительное и сохраняется от 0,5 до 2 ч после введения, в связи с быстрым разрушением в тканях.
ФЭ:
1. Местное действие.При нанесении на слизистые оболочки эпинефрин вызывает сужение сосудов. Это связано с его активирующим действием на1-адренорецепторы гладких мышц сосудов. Под влиянием эпинефрина1-адренорецепторы черезG-белок передают сигнал на фосфолипазу С, которая гидролизует фосфатидилинозитол бифосфатPIP2до инозитол трифосфата (IP3) и диацилглицерола (DAG):
Молекулы IP3открывают Са2+-каналы внутриклеточных депо и вызывают выход ионов Са2+в цитоплазму.
DAGактивирует Са2+-каналы клеточной мембраны и обеспечивает поступление ионов Са2+в клетку извне.
Повышение внутриклеточного уровня ионов кальция приводит к дефосфорилированию киназы легких цепей миозина и ее активации. Активная форма киназы, в свою очередь, фосфорилирует легкие цепи молекул миозина и придает им АТФ-азную активность: легкие цепи получают способность за счет энергии гидролиза АТФ запускать акт сокращения.
При инстилляции в глаз эпинефрин активирует 1-адренорецепторыm. dilatator pupillaeи вызывает расширение зрачка, за счет сокращения этой мышцы. Кроме того, эпинефрин вызывает понижение внутриглазного давления за счет снижения продукции водянистой влаги. Полагают, что здесь играют роль несколько механизмов:
За счет активации 1-адренорецепторов сосудов эпинефрин вызывает сокращение сосудов цилиарной мышцы и снижает фильтрацию водянистой влаги.
За счет активации 2-адренорецепторов эпителия цилиарного тела эпинефрин тормозит секрецию жидкости в заднюю камеру глаза1.
Эпинефрин стимулирует увеосклеральный путь оттока водянистой влаги из глаза.
На аккомодацию глаза эпинефрин практически не влияет. Это связано с тем, что мышца цилиарного тела получает исключительно парасимпатическую иннервацию и имеет только М3-холинорецепторы на своих гладкомышечных клетках.
2. Влияние на сердечно-сосудистую систему.
А. Миокард.В миокарде преобладают1-адренорецепторы. За счет активации этих рецепторов эпинефрин оказывает кардиостимулирующее действие. При соединении эпинефрина с1-адренорецепторами они переходят в активное состояние и черезGs-белок стимулируют аденилатциклазу, расположенную у внутренней поверхности мембраны клетки. Активированная аденилатциклаза обеспечивает образование цАМФ из АТФ, концентрация цАМФ в клетке возрастает. Зависимые от цАМФ протеинкиназы А фосфорилируют белки Са2+-каналов мембран кардиомиоцитов, при этом время пребывания канала в активном состоянии удлиняется, а скорость его активации возрастает.
Т.о. под влиянием эпинефрина облегчается поступление ионов Са2+в кардиомиоцит во время фазы медленной диастолической деполяризации. Это сопровождается повышением автоматизма, проводимости и возбудимости клеток проводящей системы сердца. Возрастает возбудимость и сократимость рабочего миокарда.
Увеличение автоматизма и проводимости под влиянием эпинефрина приводит к повышению ЧСС, а рост сократимости миокарда сопровождается увеличением сердечного выброса, систола становится более энергичной и короткой, ударный объем крови, который сердце изгоняет в сосуды, возрастает.
Однако, действие эпинефрина на миокард имеет и отрицательные стороны. Усиливая работу миокарда эпинефрин одновременно повышает его потребность в кислороде. КПД сердца (отношение сердечный выброс/потребление кислорода) падает, т.к. увеличение кислородного запроса миокарда происходит неадекватно росту выполняемой им работы. Причин такого состояния несколько:
Увеличение силы сокращений требует подключения дополнительных миофибрилл, а, следовательно, и дополнительного количества АТФ для обеспечения энергии.
Эпинефрин суживает вены и увеличивает заполнение сердца венозной кровью, которая ранее была в них депонирована (возрастает преднагрузка). За счет сужения артериальных сосудов возрастает их периферическое сопротивление току крови (постнагрузка). Т.о. миокард должен затратить дополнительную энергию на прокачивание большего объема крови и преодоление сопротивления сосудов ее движению.
Эпинефрин увеличивает в миокарде липолитический путь получения энергии (-окисление жирных кислот), который позволяет одномоментно получить большое количество АТФ, но требует повышенного расходования АТФ.
Эпинефрин разобщает окисление и фосфорилирование в дыхательной цепи и не каждый из циклов окисления субстрата завершается образованием АТФ.
Повышение возбудимости рабочего миокарда может приводить к образованию в нем гетеротопных очагов возбуждения, т.е. участков, которые становятся аномальными водителями ритма в обход синоаурикулярного узла.
В. Кровеносные сосуды.Действие эпинефрина на кровеносные сосуды зависит как от вида рецепторов, которые несут сосуды, так и от дозы самого эпинефрина.
Сосуды кожи и внутренних органов (за исключением печени и миокарда) несут только -адренорецепторы. Эпинефрин активирует эти рецепторы, вызывает сужение сосудов. Действуя на1-подтип постсинаптических рецепторов, эпинефрин вызывает передачу сигнала наGq-белки и затем на фосфолипазу С, которая гидролизуетPIP2мембраны доDAGиIP3.DAGспособствует открытию Са2+-каналов мембраны гладкомышечной клетки, аIP3освобождает Са2+из внутриклеточного депо. При участии кальмодулина ионы кальция активируют киназу легких цепей миозина, которая фосфорилирует легкие цепи миозина и запускает процесс сокращения сосудов (см. схему 2). Действуя на2-внесинаптические рецепторы сосудов, эпинефрин черезGi-белок тормозит работу аденилатциклазы и в клетке понижается образование цАМФ. Этот посредник необходим для активации зависимой от него протеинкиназы А (фермента, стимулирующего киназу фосфорилазы, которая путем фосфорилирования блокирует работу киназы легких цепей миозина). Таким образом, в условиях снижения концентрации цАМФ, активность киназы фосфорилазы падает и она не может воспрепятствовать развитию сокращения клетки – киназа легких цепей миозина остается длительно в дефосфорилированном состоянии и обеспечивает работу легких цепей миозина и сокращение гладкомышечных клеток.

Схема 2. Регуляция тонуса гладкомышечных клеток сосуда. Сокращение гладкомышечной клетки (ГМК) и вазоконстрикция возникают в тот момент, когда легкие цепи миозина находятся в фосфорилированном состоянии (LC-PO4). Фосфорилирование цепей выполняет фермент киназа легких цепей миозина (KLC). 1-адренорецепторы при активации передают сигнал на Gq-белок и фосфолипазу С (ФлС), которая гидролизует фосфатидил инозитол бифосфат (PIP2) до инозитол трифосфата (IP3) и диацилглицерола (DAG), вызывающих увеличение концентрации кальция в клетке. Под влиянием ионизированного кальция киназа легких цепей миозина дефосфорилируется и переходит в активную форму, которая индуцирует акт сокращения. 2-адренорецепторы оказывают на клетку противоположное действие, которое связано со стимуляцией через Gs-белок адениалциклазы (АС) и увеличением уровня цАМФ в клетке. Зависимые от цАМФ протеинкиназы (PkA) активируют киназу фосфорилазы (KP), которая за счет фосфорилирования переводит KLC в фосфорилированную форму, не позволяя ей инициировать сокращение клетки. 2-адренорецепторы тормозят работу АС и уровень цАМФ в клетке понижается, затрудняя при этом работу PkA и KP.
Сосуды скелетных мышц, печени и миокарда. Эти сосудистые регионы несут как , так и2-адренорецепторы. Конечное действие эпинефрина на эти сосуды будет зависеть от его дозы. В малых дозах эпинефрин будет активировать только2-адренорецепторы, которые более чувствительны к нему. Активируя эти рецепторы, лекарство черезGs-белок приведет к повышению активности аденилатциклазы и усилению образования в клетке цАМФ. В результате, зависимая от цАМФ протеинкиназа А будет стимулировать киназу фосфорилазы, которая путем фосфорилирования вызовет инактивацию киназы легких цепей миозина. В отсутствие активной киназы не происходит фосфорилирование легких цепей миозина и они не смогут обеспечить акт сокращения. Т.о. малые дозы эпинефрина будут вызывать релаксацию сосудов этих бассейнов.
В высоких дозах эпинефрин вызовет 2-фазную реакцию: вначале, за счет активации -адренорецепторов, произойдет сужение сосудов (по описанному выше механизму), а затем, по мере разрушения эпинефрина его -адреностимулирующее действие будет уменьшаться и начнет превалировать влияние на 2-адренорецепторы, которые вызовут релаксацию сосудов.
В целом, после введения эпинефрина в обычных терапевтических дозах он мало изменяет мозговой кровоток, значительно (до 40%) уменьшает кровоток в сосудах висцерального бассейна (в том числе и в почках, но фильтрация и диурез при этом значительно не страдают). Происходит перераспределение кровотока из сосудов большого круга в сосуды малого круга кровообращения (высокие дозы эпинефрина способны вызвать отек легких).
С. Влияние на уровень АД.Изменение АД под влиянием эпинефрина можно объяснить на основе его влияния на сердце и сосуды. При введении в вену со скоростью 0,1-0,4 мкг/мин эпинефрин вызывает повышение систолического давления (САД), некоторое снижение диастолического давления (ДАД), при этом среднее давление незначительно повышается2.
Повышение САД объясняется кардиостимулирующим действием эпинефрина (повышением ЧСС и сердечного выброса), сужением висцеральных сосудов и гиперсекрецией ренина, возникающей за счет активации 1 и 1-адренорецепторов юкстагломерулярного аппарата почек.
Понижение диастолического давления связано с вазодилятацией сосудов скелетных мышц (на мышечную массу приходится до 50% всего сосудистого бассейна организма, поэтому снижение ДАД достаточно заметно). Более того, в присутствии -адреноблокирующих средств, введение эпинефрина вызывает т.н. парадоксальный рефлексDaleв виде резкого падения АД, вследствие2-адреномиметического вазодилятирующего действия эпинефрина.
3. Влияние на органы с гладкой мускулатурой.
Дыхательные пути. Гладкие мышцы бронхиол богаты 2-адренорецепторами. Эпинефрин воздействует на эти рецепторы и вызывает релаксацию бронхов, улучшая их проходимость. Бронходилятирующий эффект эпинефрина выражен в большей степени при исходном наличии бронхоспазма. При синдроме бронхиальной обструкции эпинефрин не только расширяет бронхи, но и устраняет отек их слизистой оболочки (за счет-адреномиметического действия), препятствует выбросу из тучных клеток медиаторов воспаления (гистамина, серотонина, лейкотриенов).
ЖКТ. Эпинефрин вызывает расслабление гладких мышц желудка и кишечника, снижает их перистальтику и закрывает сфинктерные жомы. Расслабление гладких мышц опосредовано прямо, через активацию 2-адренорецепторов (в результате чего увеличивается уровень цАМФ и инактивируется киназа легких цепей миозина), а также связано с действием эпинефрина на пресинаптические2-адренорецепторы нейронов метасимпатической нервной системы. В результате активации этих рецепторов снижается выделение медиаторов, которые стимулируют моторику ЖКТ (ацетилхолин, холецистокинин).
Мочевой пузырь. Эпинефрин вызывает расслабление m. detrusor urinae(2-адреномиметический эффект) и сокращает мышцы в области мочевого треугольника (участок между точками входа мочеточников и выхода уретры из пузыря) за счет воздействия на1-адренорецепторы. В итоге, под влиянием эпинефрина несколько снижается частота мочеиспусканий.
Миометрий. Матка несет как 1-, так и2-адренорецепторы, причем, активация-адренорецепторов повышает ее тонус, а активация2-адренорецепторов снижает тонус и сократительную активность миометрия. Конечный эффект эпинефрина будет зависеть от состояния матки и вида организма:
-
небеременная матка
беременная матка
крысы
расслабление
расслабление
кролики
сокращение
сокращение
кошки
расслабление
сокращение
человек
сокращение
расслабление
4. Влияние на ЦНС.
Эпинефрин оказывает слабое влияние на функции головного мозга. Это связано с тем, что ГЭБ изначально задерживает вещества, которые являются медиаторами. Такая особенность ГЭБ сложилась в ходе эволюции, чтобы обеспечить постоянное функционирование мозга вне зависимости от поступления медиаторов в организм с продуктами питания из внешней среды.
Тем не менее, эпинефрин избирательно проникает в гипоталамус и продолговатый мозг, оказывая тонизирующее действие на дыхательный центр и центр теплопродукции. В высоких дозах эпинефрин способен поступать и в другие отделы ЦНС, вызывая головную боль, страх, беспокойство, тремор, рвоту.
4. Влияние на обменные процессы.
Обмен углеводов. Эпинефрин при введении в организм вызывает гипергликемию. Это связано с его действием на мышцы, печень и поджелудочную железу.
В скелетных мышцах и печени, активируя 2-адренорецепторы, эпинефрин стимулирует аденилатциклазу, увеличивает синтез цАМФ и активность зависимых от него протеинкиназ А (PkA). PkA фосфорилирует киназу фосфорилазы, которая, при этом, переводит неактивную фосфорилазу В в фосфорилазу А, которая обеспечивает процесс гидролиза гликогена печени и мышц до глюкозо-6-фосфата. В то же самое время,PkAфосфорилирует гликоген-синтазу и переводит ее из активной «D» формы в неактивную «I» форму. Таким образом, на фоне эпинефрина усиливается гликогеногенолиз и уменьшается скорость синтеза гликогена.
В поджелудочной железе эпинефрин, за счет активации 2-адренорецепторов-клеток тормозит секрецию инсулина и, в то же время, через активацию2-адренорецепторов-клеток усиливает секрецию гликогена.
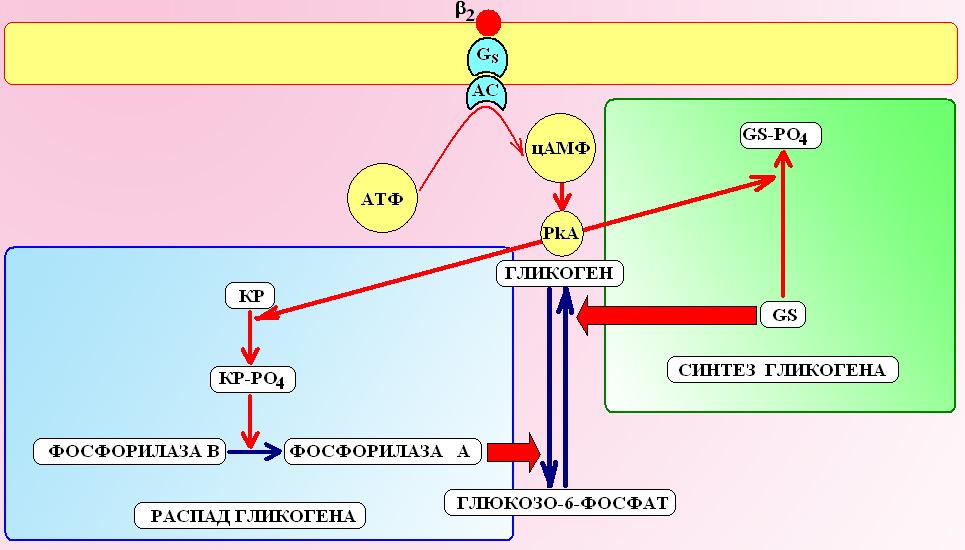
Схема 3. Влияние -адреномиметиков на метаболизм глюкозы. При активации 2-адренорецепторов сигнал передается на аденилатциклазу (АС) и в клетке увеличивается концентрация цАМФ и активность зависимых от них протенкиназ А (PkA). PkA вызывают фосфорилирование киназы фосфорилазы (КР) и гликогенсинтазы (GS). Фосфорилированная форма гликогенсинтазы является неактивной и синтез гликогена из глюкозы сокращается. Напротив, фосфорилированная форма КР активна и повышает активность фосфорилазы (при этом фосфорилаза из формы В переходит в форму А), которая способствует распаду гликогена до глюкозо-6-фосфата.
Обмен липидов. Воздействуя на 2и3-адренорецепторы жировой ткани, эпинефрин стимулирует триглицеридлипазу и усиливает распад триглицеридов до свободных жирных кислот, повышает калоригенную функцию бурой жировой ткани.
Минеральный обмен. Влияние эпинефрина на минеральный обмен реализуется через 2-адренорецепторы и проявляется наиболее ярко при его введении в дозах 0,05 мкг/мин (т.к. в этом случае он практически не оказывает влияния на- и1-адренорецепторы. Эпинефрин активирует2-адренорецепторы скелетных мышц и открывает т.н.maxi-K+-каналы, по которым начинается утечка ионов К+из мышц и возникает гиперкалиемия. Затем, посредством тех же рецепторов, эпинефрин активируетNa+/K+-АТФазу скелетных мышц и гиперкалиемия может смениться некоторой гипокалиемией, за счет активной закачки ионов К+в мышцы.
Влияние на горомнальный профиль. Введение эпинефрина сопровождается снижением уровня инсулина и повышением концентрации глюкагона, ренина и его продуктов (ангиотензинов IиII).
Показания к применению и режимы дозирования:
В расчете на резорбтивное действие эпинефрин применяют при следующих состояниях:
Неотложная помощь при анафилактическом шоке. Эпинефрин вводят в виде внутривенной инфузии, а при невозможности пунктирования периферических вен, выполняют инъекцию в корень языка. Введение эпинефрина позволяет стабилизировать работу сердца, повысить АД, устраняет бронхоспазм. Обычно вводят 0,3-0,5 мг эпинефрина. Следует помнить, что подкожное и внутримышечное введение эпинефрина при этом состоянии не всегда эффективно, т.к. падение АД при шоке вызывает глубокое нарушение циркуляции в тканях и абсорбция эпинефрина резко замедляется. В тканях языка венозные сосуды фиксированы внешним растяжением мышц, поэтому они не спадаются при шоке и могут быть использованы для инъекции лекарства.
Гипертензивный эффект эпинефрина иногда провоцирует определенный соблазн использовать его для стабилизации АД при кардиогенном, геморрагическом и травматическом шоках. Однако, следует помнить, что при всех этих состояниях уже имеет место вазоконстрикторная реакция (которая и обеспечивает минимальный уровень сохранения АД). Если провести вливание эпинефрина, то дальнейшее сужение сосудов лишь усугубит растройства кровообращения.
Купирование гипогликемической комы при неэффективности инъекций глюкозы. Обычно прибегают к подкожному введению 0,3-0,5 мг эпинефрина.
Купирование бронхоспазма при астматическом статусе (следующими друг за другом приступами удушья без периодов облегчения дыхания). Прибегают к подкожному или внутримышечному введению 0,3-0,5 мг эпинефрина каждые 15 мин до исчезновения удушья.
Оживление здорового сердца при травмах, утоплении, синдроме Морганьи-Адамса-Стокса в случае асистолии миокарда (при фибрилляции желудочков эпинефрин малоэффективен). Обычно вводят 0,3-0,5 мл эпинефрина в разведении на 10 мл физиологического раствора. Инъекцию выполняют внутрисердечно выполняют внутрисердечно в области IV-Vмежреберья слева на расстоянии 5,0-7,5 см от края грудины. Перед введением следует убедиться, что игла находится в полости желудочка, т.к. инъекция эпинефрина в толщу мышцы способна вызвать трудно купируемую фибрилляцию желудочков.
В расчете на местное действие эпинефрин используется как сосудосуживающее средство при:
Остановке кровотечений из мелких сосудов носа, после экстракции зуба (закладывают тампоны, смоченные эпинефрином в разведении 1:1.000-1:20.000 (0,005%-0,1% растворы);
Для уменьшения абсорбции местноанестезирующих средств из области введения и удлинения, тем самым, их эффекта (эпинефрин добавляют из расчета 1-2 капли на 10 мл анестетика, создавая разведение 1:50.000-1:100.000). Кроме того, одновременно уменьшаются токсические резорбтивные эффекты анестетика.
В глазной практике изредка эпинефрин используют для инстилляции в глаз в виде 1-2% раствора, чтобы снизить внутриглазное давление при открытоугольной глаукоме.
НЭ:
Тахикардия, тахиаритмия вплоть до развития фибрилляции желудочков.
Повышение потребности миокарда в кислороде может спровоцировать приступ стенокардии у пациентов с ИБС.
Быстрое внутривенное введение может вызвать гипертонический криз с развитием инсульта.
При резкой отмене эпинефрина у лиц, которые его получали в течение длительного времени, возможно развитие острой сосудистой недостаточности (коллапса). Поэтому введение эпинефрина уменьшают постепенно, на 0,1-0,3 мг/сут.
Следует помнить, что пациенты, которые получают лекарственные средства, ослабляющие эндогенные симпатические влияния (резерпин, ганглиоблокаторы, антидепрессанты из группы ингибиторов МАО) весьма чувствительны к действию эпинефрина и он должен использоваться только в низких дозах.
Эпинефрин нестоек в щелочных растворах, под действием света и воздуха он быстро окисляется до розоватых солей адренохрома и коричневых – меланина.
ФВ: раствор 0,1% в ампулах по 1 мл и флаконах по 10 мл.
Н орэпинефрин
(Norepinephrine,
Noradrenaline)
представляет собой синтетический аналог
эндогенного нейромедиатора симпатических
нейронов норадреналина. Основным
источником норадерналина являются
симпатические нейроны. В надпочечниках
здорового человека содержится только
10-20% норадреналина от всего количества
катехоламинов, но при феохромоцитоме
(опухоли мозгового вещества надпочечников)
его количество может достигать 97% от
всех катехоламинов.
орэпинефрин
(Norepinephrine,
Noradrenaline)
представляет собой синтетический аналог
эндогенного нейромедиатора симпатических
нейронов норадреналина. Основным
источником норадерналина являются
симпатические нейроны. В надпочечниках
здорового человека содержится только
10-20% норадреналина от всего количества
катехоламинов, но при феохромоцитоме
(опухоли мозгового вещества надпочечников)
его количество может достигать 97% от
всех катехоламинов.
МД: Норэпинефрин стимулирует 1,2и1-адренорецепторы. Он практически не влияет на2-адренорецепторы. По силе действия норэпинефрин в 2-10 раз слабее эпинефрина, но по эффективности в отношении1-адренорецепторов он не уступает эпинефрину, а по-адреностимулирующему действию даже превосходит эпинефрин.
ФЭ:
Местное действие. Норэпинефрин подобно эпинефрину вызывает сужение сосудов коди и слизистых, которое выражено настолько сильно, что может привести к местной ишемии и некрозу тканей. При инстилляции в глаз норэпинефрин снижает внутриглазное давление и вызывает мидриаз.
Влияние на сердечно-сосудистую систему.
А. Миокард.Активируя1-адренорецепторы миокарда норэпинефрин повышает силу сердечных сокращений подобно эпинефрину, однако, его влияние на ЧСС отличается от действия эпинефрина:
В изолированном миокарде (in vitro) норэпинефрин, за счет активации1-адренорецепторов проводящей системы приводят к увеличению автоматизма, проводимости, возбудимости миокарда и в итоге – повышению ЧСС.
В целостном организме (in vivo) тахикардии не возникает. Напротив, при введении норэпинефрина возникает рефлекторная брадикардия. Это связано с тем, что под влиянием норэпинефрина происходит сужение сосудов и повышается АД. Увеличение АД сопровождается интенсивным раздражением рефлексогенных зон дуги аорты и каротидного синуса. Барорецепторы этих зон передают нервные импульсы по афферентным нервам в ядра одиночного пути, которые тормозят работу сосудодвигательного центра и снижают симпатический тонус. Одновременно возрастает активность ядер блуждающего нерва и развивается рефлекторная брадикардия.
В. Сосуды и уровень АД.Норэпинефрин вызывает сужение сосудов всех бассейнов, активируя1и2-адренорецепторы. При этом ухудшается кровоток в головном мозге, легких, коже, органах пищеварительного тракта, почках и скелетных мышцах.
Он в 5-10 раз сильнее, чем эпинефрин повышает уровень АД, при этом увеличивается как систолическое, так и диастолическое давление (пульсовое давление при этом понижается). Одновременно возрастает среднее давление.
Норэпинефрин оказывает минимальное влияние на гладкие мышцы бронхов, матки и углеводный обмен. Это связано с тем, что симпатические влияния на эти органы опосредуются через 2-адренорецепторы, на которые эпинефрин практически не действует.
Норэпинефрин плохо проникает через ГЭБ, но в высоких дозах он может вмешиваться в центральные нейромедиаторные процессы, вызывая немотивированную агрессию, дисфорию (злобное настроение), экспульсивное поведение (в популярной литературе норэпинефрин часто называют «гормон агрессии»).
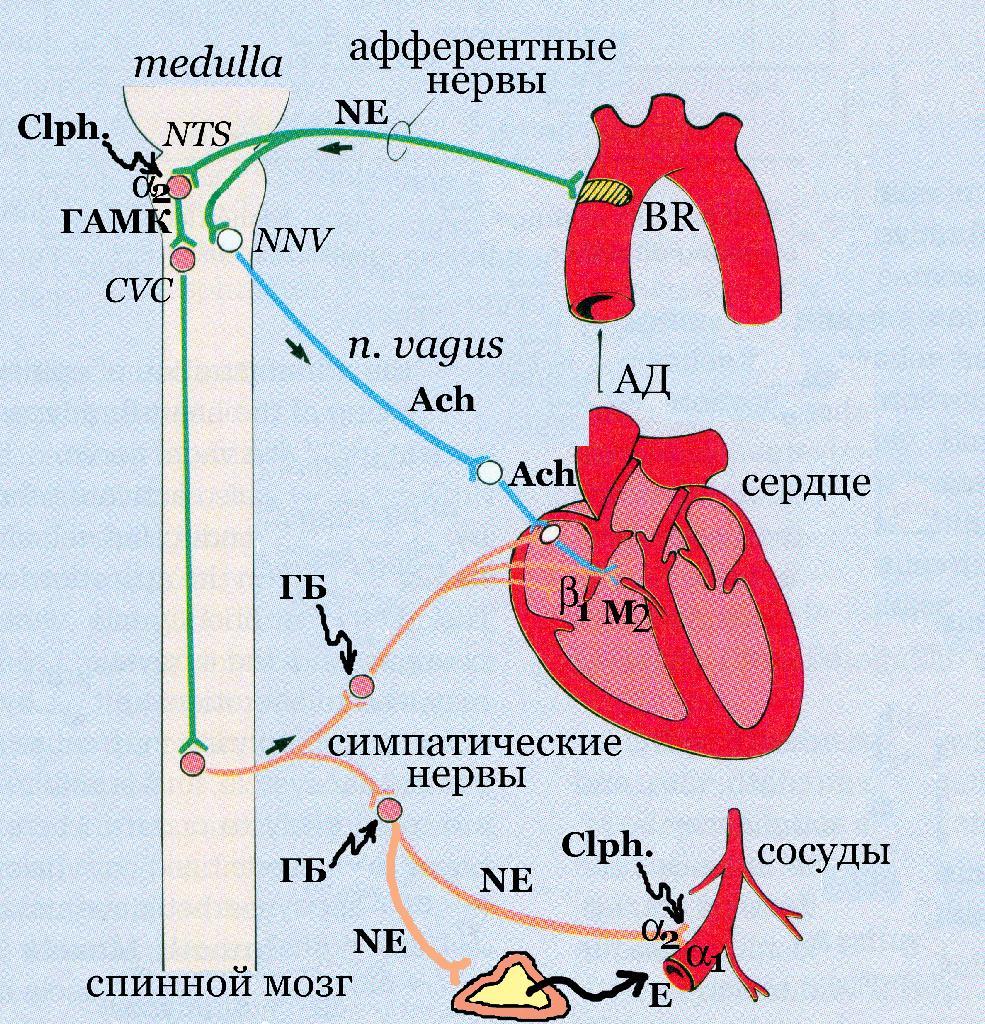
Схема 4. Реализация барорефлекса под влиянием норэпинефрина. Норэпинефрин (NE) активирует -адренорецепторы периферических сосудов, что способствует их сужению и возрастанию АД. Барорецепторы дуги аорты (BR) воспринимают это повышение и по адренергическим нервам передают импульсы в продолговатый мозг (medulla). Здесь происходит активация ядер блуждающего нерва (NNV) и, как следствие, возрастают угнетающие влияния этого нерва на ЧСС. С другой стороны, происходит включение ядра одиночного пути (NTS) ГАМК-ергические нейроны которого осуществляют тормозные влияния на ядра сосудодвигательного центра (CVC) и снижают тонус симпатических кардиостимулирующих нервов. Ганглиоблокаторы (ГБ) прерывают барорефлекс за счет нарушения передачи эфферентных импульсов в области ганглиев. Клонидин (Cloph.) активирует тормозное звено барорефлекса через центральную группу 2-адренорецепторов NTS.
Применение в медицинской практике и режимы дозирования.
Основное применение норэпинефрина – купирование сосудистого коллапса, возникшего вследствие травм, хирургических вмешательств или интоксикаций. Следует помнить, что растворы норэпинефрина крайне нестойки и уже через 5-10 мин пребывания на свету подвергаются спонтанной деградации. Обычно норэпинефрин вводят в виде инфузии на 5-10% растворе глюкозе, защищая флакон черным пакетом от действия света. Глюкоза имеет кислую реакцию и, поэтому, дополнительно стабилизирует норэпинефрин. Начальная скорость инфузии составляет 2-4 мкг/мин под контролем АД. При необходимости ее можно повышать до 16 мкг/мин.
Действие норэпинефрина крайне непродолжительно – уже через 5 минут после окончания инфузии АД начинает снижаться.
НЭ: Норэпинефрин вызывает такие же нежелательные эффекты как и эпинефрин. При подкожном или внутримышечном введении он вызывает сильный спазм сосудов, ишемию и некроз ткани. При развитии такого осложнения следует ввести в область инъекции -адреноблокирующие средства (фентоламин, тропафен), согреть ткани сухим теплом.
ФВ: раствор 0,2% в ампулах по 1 мл в виде битартрата.
Допамин (Dopamine, Intropine) Является непосредственным метаболическим предшественником норадреналина, выполняет роль нейромедиатора в дофаминергических нейронах.
М Д:
В низких дозах допамин стимулирует
преимущественно дофаминовые рецепторы
(D-рецепторы), В настоящее
время выделяют 5 видовD-рецепторов.
Рецепторы типовD1иD5располагаются
на гладкомышечных клетках внутренних
органов и сосудов. Рецепторы типовD2-D4лежат на нейронах ЦНС. Поскольку допамин,
подобно другим нейромедиаторам,
практически не проникает через ГЭБ, при
его введении возникают эффекты,
характерные только для стимуляцииD1иD5рецепторов.
Д:
В низких дозах допамин стимулирует
преимущественно дофаминовые рецепторы
(D-рецепторы), В настоящее
время выделяют 5 видовD-рецепторов.
Рецепторы типовD1иD5располагаются
на гладкомышечных клетках внутренних
органов и сосудов. Рецепторы типовD2-D4лежат на нейронах ЦНС. Поскольку допамин,
подобно другим нейромедиаторам,
практически не проникает через ГЭБ, при
его введении возникают эффекты,
характерные только для стимуляцииD1иD5рецепторов.
D1иD5рецепторы связаны сGs-белками. При активации они передают сигнал на аденилатциклазу внутренней стороны мембраны клетки, повышая ее активность. В итоге, в клетках усиливается синтез цАМФ и зависимые от негоPkAобеспечивают активацию киназы фосфорилазы, которая, путем фосфорилирования переводит киназу легких цепей миозина в неактивную форму и акт сокращения гладкомышечной клетки не реализуется.
В более высоких дозах допамин активирует 1-адренорецепторы миокарда и только в очень высоких концентрациях способен стимулировать1и2-адренорецепторы сосудов.
ФЭ:
В небольших дозах 0,5-3,0 мкг/кг/мин допамин активирует D1-рецепторы гладкомышечных клеток сосудов почек, кишечника, миокарда и головного мозга. В результате вазодилятации улучшается кровоток (перфузия) этих органов, в почках возрастает фильтрация, что сопровождается увеличением диуреза.
В дозах 5-10 мкг/кг/мин допамин активирует 1-адренорецепторы миокарда и увеличивает его автоматизм, проводимость, возбудимость и сократимость. Повышается сила сердечных сокращений (растет сердечный выброс и ударный объем крови), увеличивается ЧСС. В связи с кардиостимулирующим эффектом допамина у пациента возможно некоторое повышение систолического давления (за счет роста сердечного выброса и ЧСС), но диастолическое и средние давление при этом остаются прежними.
В высоких дозах 20-50 мкг/кг/мин допамин стимулирует -адренорецепторы сосудов и вызывает их сокращение с увеличением как систолического, так и диастолического давления. За счет сужения сосудов допамин в такой дозе ухудшает почечный кровоток и уменьшает диурез.
Применение в медицинской практике и режим дозирования. Допамин вводят внутривенно капельно медленно под контролем АД, ЦВД и ЭКГ при следующих состояниях:
Тяжелая, рефрактерная к терапии хроническая застояная сердечная недостаточность - используют диуретические дозы (0,5-5,0 мкг/кг/мин);
Острая сердечная недостаточность (кардиальная астма при инфаркте миокарда) - используют кардиотонические дозы (5-10 мкг/кг/мин);
Кардиогенный, токсический и послеоперационный шок – используют вазотонические дозы допамина (более 10 мкг/кг/мин) в сочетании с инфузиями плазмозаменителей.
Длительность терапии допамином не должна превышать 2-3 сут, т.к. к нему быстро развивается толерантность (привыкание).
НЭ:
В кардиотонических и вазотонических дозах за счет активации 1и-адренорецепторов допамин вызывает те же нежелательные эффекты, что и эпинефрин: тахиаритмии, повышение потребности миокарда в кислороде, легочная и сердечная гипертензия.
Следует помнить, что допамин оказывает угнетающее действие на периферические хеморецепторы, поэтому его быстрое вливание может вызвать временное апноэ.
Допамин не проникает через ГЭБ у взрослых лиц, но у детей проницаемость ГЭБ барьера для него достаточно высока, поэтому при введении допамина у них иногда могут проявляться центральные эффекты (изменение эмоциональной сферы, психозоподобные состояния).
D2-рецепторы триггерной зоны рвотного центра в ЦНС лежат в области днаIVжелудочка, кнаружи от ГЭБ. За счет активации этих рецепторов допамин может вызывать тошноту и рвоту.
Высокие дозы допамина могут привести к развитию желудочного кровотечения, спровоцировать бронхоспазм. При попадании лекарственного средства под кожу возможно развитие ее некроза.
ФВ: раствор 2% в ампулах по 10 мл; 1% в ампулах по 5 мл; 4% в ампулах по 5 мл.
