
- •Анализ лекарственных средств первой группы
- •Вещества неорганической природы
- •Анализ лекарственных веществ второй и третьей группы
- •Метод пиролитического восстановления
- •Рентгено-спектральный флуоресцентный анализ неорганических лекарственных средств
- •Идентификация галогенов.
- •Физико-химические методы анализа
- •Спектрофотометрия лекарственных веществ второй группы
- •Спектральные характеристики лекарственных веществ второй (смешанной) группы в 0,1 моль/л растворе кислоты хлористоводородной
- •Анализ лекарственных веществ, уф-спектры которых не имеют максимумов поглощения
- •Значение Rf производных барбитуровой кислоты
- •Времена удерживания производных барбитуровой кислоты
- •Основные испытания для дифференциации лекарственных веществ, относящихся к II группе и являющихся солями органических кислот
- •Анализ лекарственных веществ II группы, уф-спектры которых имеют максимумы поглощения
- •С раствором железа (III) хлорида
- •Реакция образования азокрасителя
- •Реакция образования азокрасителя после предварительного нагревания препарата в кислой среде
- •Реакция образования ауринового красителя.
- •Спектральные характеристики лекарственных веществ органической структуры в 0,1 моль/л растворе кислоты хлористоводородной
- •Анализ веществ, имеющих в ультрафиолетовой области один максимум поглощения
- •Анализ веществ, имеющих в ультрафиолетовой области два максимума поглощения
- •Используемая и рекомендуемая литература для преподавателей
-
Анализ лекарственных веществ второй и третьей группы
Идентификацию веществ второй и третьей группы начинают с установления элементарного става. При этом определяют наличие или отсутствие в анализируемом образце ковалентно-связанных азота, серы и галогена. Ниже приведены наиболее простые и надежные методики обнаружения указанных элементов, основанные на разрушении органической части.
Обнаружение азота
При прокаливании азотосодержащих веществ со смесью безводных натрия карбоната и натрия тиосульфата атомы органических соединений превращаются в ионы тиоцианата, которые с катионами трехвалентного железа образуют окрашенные в красный цвет комплексы.
Методика. В сухую пробирку помещают 0,15 г анализируемого вещества и 0,3 г смеси для спекания, состоящей из безводных натрия карбоната и натрия тиосульфата, взятых в соотношении 9:1. После тщательного перемешивания стеклянной палочкой содержимое пробирки прокаливают 6 – 7 мин в пламени спиртовки до обугливания. В случае минерализации возгоняющихся веществ, после перемешивания, насыпают сверху дополнительный слой смеси для спекания. По окончании прокаливания пробирку охлаждают на воздухе и к ее содержимому небольшими порциями при перемешивании прибавляют 3 – 4 мл кислоты азотной до прекращения выделения углекислого газа и создания рН = 1 – 2.
Раствор фильтруют и фильтрат делят на 2 части. К первой части прибавляют 5 капель 3 % раствора железа (III) хлорида. Вторая часть фильтрата служит контролем. При наличии в испытуемом веществе азота появляется красное или оранжевое окрашивание. Если окрашивание желто-оранжевое, опыт следует повторить, увеличив в 2 раза массу вещества и количества реактивов.
Обнаружение серы
Метод пиролитического восстановления
При прокаливании с натрия формиатом органического вещества, содержащего серу, процесс деструкции при 250 °С сопровождается восстановлением, в результате которого выделяется сероводород. Последний легко обнаруживают по запаху и реакции образования сульфида свинца.
Методика. В сухую пробирку помещают 0,05 г анализируемого вещества и 0,05 г безводного натрия формиата и тщательно перемешивают стеклянной палочкой. Верхнюю часть пробирки плотно обертывают фильтровальной бумагой, на которую наносят 1 – 2 капли раствора свинца ацетата. Смесь прокаливают в пламени спиртовки в течение 5 минут. При наличии серы на внутренней поверхности бумаги появляется пятно, окрашенное в черный цвет. В некоторых случаях возможно ошибочное обнаружение серы вследствие высокой чувствительности метода.
Таблица 2
Рентгено-спектральный флуоресцентный анализ неорганических лекарственных средств
|
№ п/п |
Химическая формула |
Определяемый элемент |
Диапазон длин волн, mA |
Количество линий |
N, имп./с (max) |
|
1 |
Na2SO4×10H2O |
- |
- |
- |
- |
|
2 |
NaCl |
- |
- |
- |
- |
|
3 |
Na2B4O7×10H2O |
- |
- |
- |
- |
|
4 |
NaHCO3 |
- |
- |
- |
- |
|
5 |
NaNO2 |
- |
- |
- |
- |
|
6 |
NaBr |
Br |
850-1150 |
Kb 933 Ka 1044 |
11105 57636 |
|
7 |
Na2S2O3×5H2O |
- |
- |
- |
- |
|
8 |
Al(OH)3 |
- |
- |
- |
- |
|
9 |
KCl |
- |
- |
- |
- |
|
10 |
KAl(SO4)2×12H2O |
- |
- |
- |
- |
|
11 |
KI |
I |
2550-3000 |
Lg 2582 Lb 2751 Ln 2774 La 2910 Le 2938 |
37 38 17 12 61 |
|
12 |
CaCO3 |
Ca |
3060-3130 |
Kb 3090 |
38 |
|
13 |
CaO |
Ca |
3060-3130 |
Kb 3090 |
38 |
|
14 |
CaSO4×1/2H2O |
Ca |
3060-3130 |
Kb 3090 |
10 |
|
15 |
MgSO4×7H2O |
- |
- |
- |
- |
|
16 |
MgO |
- |
- |
- |
- |
|
17 |
Магния карбонат основной |
- |
- |
- |
- |
|
18 |
BaSO4 |
Ba |
2200-2850 |
Lg 2241 Lb 2404 Ln 2516 La 2568 Le 2776 |
65 117 49 163 110 |
|
19 |
FeSO4×7H2O |
Fe |
1700-2000 |
Kb 1757 Ka 1938 |
3770 15585 |
|
20 |
Висмута нитрат основной |
Bi |
900-1200 |
Lb 955 Ln 1059 La 1145 |
24056 273 23004 |
|
21 |
ZnSO4×7H2O |
Zn |
1250-1500 |
Kb 1295 Ka 1436 |
10971 50325 |
|
22 |
ZnO |
Zn |
1250-1500 |
Kb 1295 Ka 1436 |
10971 80376 |
|
23 |
PbO |
Pb |
827-1400 |
Lg 1840 Lb 983 Ln 1092 La 1176 Le 1350 |
629 13886 225 12566 365 |
|
24 |
Pb(CH3COO)2×3H2O |
Pb |
827-1400 |
Lg 1840 Lb 983 Ln 1092 La 1176 Le 1350 |
525 11424 201 10565 296 |
|
25 |
NH4Cl |
- |
- |
- |
- |
|
26 |
NH4Br |
Br |
850-1150 |
Kb 933 Ka 1044 |
16806 85442 |
|
27 |
Na2HPO4×12H2O |
- |
- |
- |
- |
|
28 |
NaHPO4×12H2O |
- |
- |
- |
- |
|
29 |
H2BO3 |
- |
- |
- |
- |
|
30 |
S |
- |
- |
- |
- |
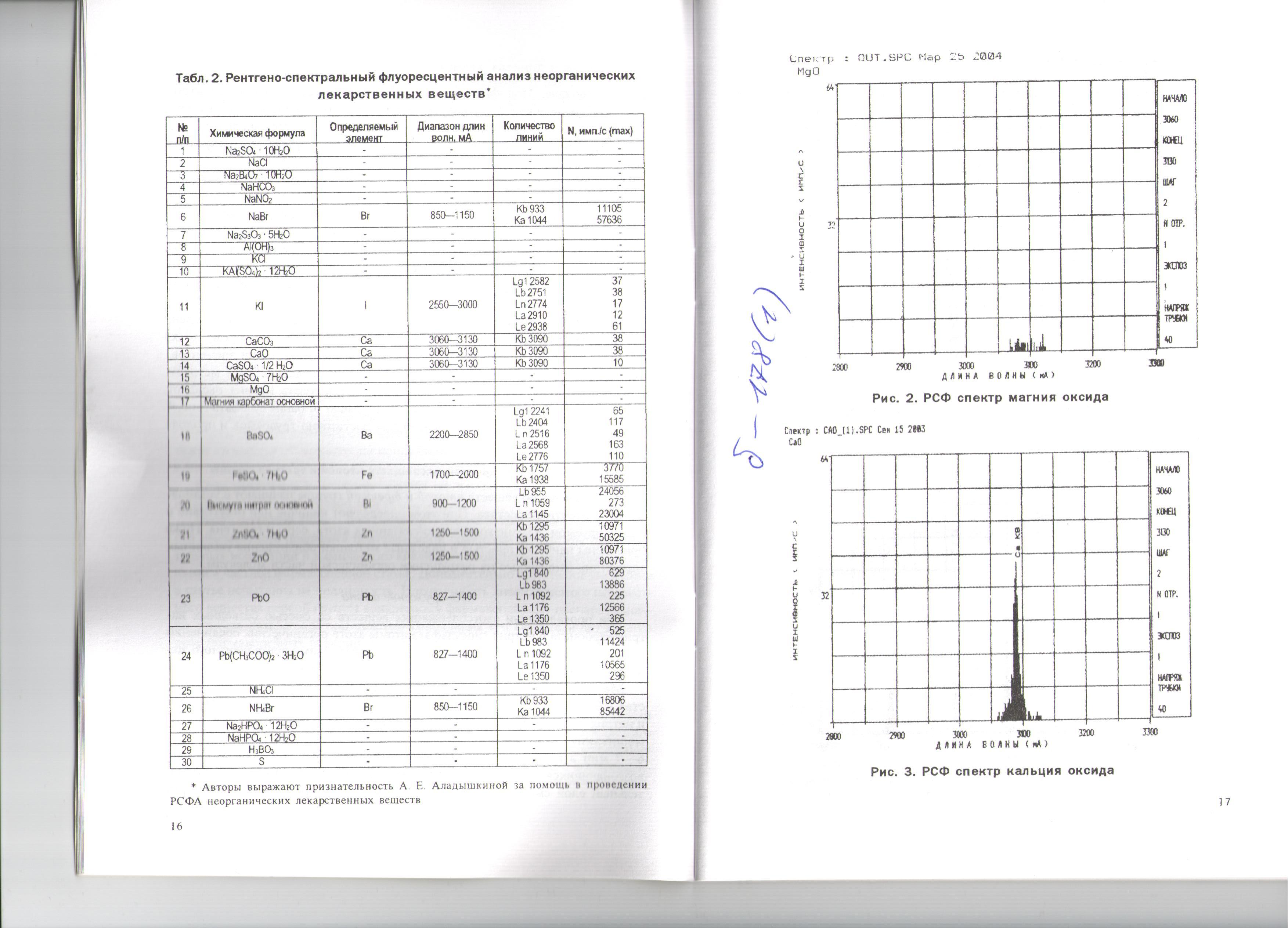
Рисунок 1. РСФ спектр магния оксида

Рисунок 2. РСФ спектр кальция оксида

Рисунок 3. РСФ спектр кальция сульфата

Рисунок 4. РФС спектр бария сульфата
Окислительный метод
При минерализации смесью концентрированной азотной и хлористоводородной кислот (1:1), входящая в состав органического вещества сера окисляется до сульфат-иона, который обнаруживают с помощью хлорида бария.
Методика. К 0,1 г анализируемого вещества прибавляют по 2 мл концентрированных азотной и хлористоводородной кислот и выпаривают в вытяжном шкафу на водяной бане досуха. Остаток смешивают с 2 мл воды, фильтруют и к фильтрату прибавляют по 3 капли кислоты хлористоводородной разведенной и 5 % раствора бария хлорида. Образование белого кристаллического осадка бария сульфата свидетельствует о наличии в исследуемом веществе серы.
Обнаружение галогена (хлора, брома, йода)
Наличие в молекуле лекарственного вещества ионо- или ковалентно-связанных атомов хлора, брома и йода легко подтверждается простой и доступной чувствительной пробой Бейльштейна. Для идентификации галогенов необходимо использовать метод минерализации и соответствующие качественные реакции.
Проба Бейльштейна.
При сжигании галогеносодержащих веществ на медной проволоке или сетке в пламени спиртовки образуются летучие галогениды меди. Которые окрашивают пламя в зеленый или сине-зеленый цвет.
Методика. Медную проволоку длиною 10 – 12 см с загнутым в форме ушка концом или медную сетку, предварительно обработанную кислотой азотной разведенной, промывают водой очищенной, прокаливают в пламени спиртовки до исчезновения окраски пламени. Если зеленое окрашивание пламени не исчезает в течение одной минуты, то это свидетельствует о наличие в спирте веществ, содержащих галоген, и такую спиртовку для проведения опыта использовать нельзя. После охлаждения проволоки, в ее ушко помещают 3 – 6 мг вещества и вновь вносят в пламя. Если пламя спиртовки окрашивается в зеленый или сине-зеленый цвет, то можно сделать предположение о наличии в испытуемом веществе галогена. При отсутствии характерной окраски пламени делают вывод об отсутствии галогена в анализируемом соединении.
