
- •Содержание
- •Лабораторная работа № 1 определение отношения заряда электрона к его массе методом магнетрона
- •Краткая теория
- •Выполнение работы
- •8. При вычислениях используйте следующие данные, характеризующие установку:
- •Выполнение работы
- •1. Устройство и принцип работы модуля «Опыт Франка и Герца»
- •2. Снятие зависимости анодного тока от напряжения на сетке с использованием двухкоординатного графопостроителя н-307/1
- •Контрольные вопросы и задания
- •Рекомендуемая литература
- •Лабораторная работа № 3 изучение неон-гелиевого лазера
- •Краткая теория
- •Устройство Ne-He лазера
- •Механизм образования инверсии в Ne-He лазере
- •Спектр излучения Ne-He лазера
- •Выполнение работы
- •1. Определение длины волны излучения Ne-He лазера
- •2. Исследование распределения интенсивности в лазерном пучке
- •3. Определение расходимости лазерного пучка
- •Контрольные вопросы и задания
- •Рекомендуемая литература
- •Лабораторная работа № 4 изучение сериальных закономерностей в спектре атома водорода
- •Краткая теория
- •Краткое описание установки
- •Выполнение работы
- •Контрольные вопросы и задания
- •Рекомендуемая литература
- •Справочные материалы
- •Лабораторная работа № 5 спектр атома водорода. Атом бора
- •Краткая теория
- •Выполнение работы
- •1. Экспериментальное исследование спектра поглощения
- •1.1. Схема эксперимента
- •1.2. Метод измерения уровней энергии
- •1.3. Исследование спектра. Уровни энергии
- •1.4. Уровни энергии. Параметрическая зависимость
- •2. Обобщенная формула Бальмера. Спектральные серии
- •3. Постулаты Бора
- •4. Система атомных единиц
- •5. Атом водорода
- •5.1. Атом Бора (круговые орбиты)
- •5.2. Атом Бора – Зоммерфельда
- •Контрольные вопросы и задания
- •2. Модель атома по Эрнесту Резерфорду
- •3. Случай многократных столкновений
- •4. Случай однократных столкновений
- •Выполнение работы
- •1. Рассеяние на атоме Томсона
- •2. Рассеяние на атоме Резерфорда
- •3. Рассеяние на многоатомных мишенях
- •4. Расчёт вероятности рассеяния
- •5. Оценка времени экспозиции
- •Контрольные вопросы и задания
- •Рекомендуемая литература
- •Лабораторная работа № 7 изучение спектра атома натрия
- •Краткая теория
- •Экспериментальная установка
- •Выполнение работы
- •Справочные материалы
- •Контрольные вопросы и задания
- •Рекомендуемая литература
3. Определение расходимости лазерного пучка
1. Получите распределения интенсивности по диаметру на двух расстояниях от лазера – ближайшем и максимальном.
2. Распечатайте полученные результаты.
3. Оцените погрешности полученных значений.
4. Объясните полученные результаты.
Контрольные вопросы и задания
1. Чем принципиально отличается излучение лазера от излучения газового разряда?
2. Каков механизм образования инверсии населённости в Ne-He смеси?
3. Объясните термин «отрицательная абсолютная температура», применяемый иногда при описании инверсии.
4. Каков спектр излучения газового лазера?
5. Что такое собственный тип колебаний резонатора?
6. Какова роль уровня 1S неона?
7. Что такое диэлектрическое зеркало? Каковы его достоинства?
8. Как зависит усиление в активной среде от давления газовой смеси в трубке и её диаметра?
9. Является ли исследуемый Ne-He лазер одночастотным?
Рекомендуемая литература
Савельев И. В. Курс общей физики. Т. 3: Квантовая оптика, атомная физика, физика атомного ядра и элементарных частиц. СПб.: Лань, 2006.
Сивухин Д. В. Общий курс физики. Т. 5: Атомная и ядерная физика. М.: ФИЗМАТЛИТ, 2006.
Справочник по интегральным микросхемам / под ред. В. Ф. Тарабрина. М.: Энергия, 2008.
Справочник по лазерам: в 2 т.; пер. с англ. / под ред. А. М. Прохорова. М.: Сов. радио, 1978.
Фриш С. Э., Тиморева А. В. Курс общей физики. Т. 3: Оптика. Атомная физика. СПб.: Лань, 2007.
Лабораторная работа № 4 изучение сериальных закономерностей в спектре атома водорода
Цель работы:
– изучить сериальные закономерности в видимой области спектра атома водорода;
– измерить длины волн основных линий спектра водорода в серии Бальмера и рассчитать значение постоянной Ридберга;
– оценить погрешности измерений.
Краткая теория
Одна из важнейших закономерностей строения атомных спектров – их сериальная структура. Сериальные закономерности представляют собой яркое проявление квантовых свойств излучающих атомных систем. Линии линейчатого спектра атомов газа, находящегося при низком давлении, могут быть объединены в определённые группы – серии. Длины волн всех линий, принадлежащих к одной и той же серии, связаны между собой.
Наиболее полное решение задачи о спектральных закономерностях даёт квантовая механика. Согласно теории состояние одноэлектронного атома может быть охарактеризовано набором из четырёх квантовых чисел. В первом приближении (без учёта тонкой структуры) состояние атома характеризуется следующими квантовыми числами: n, l, ml, ms.
1. Главное квантовое число n, которое принимает целые значения, n = 1, 2, 3, …, определяет энергию стационарного состояния и служит мерой протяжённости соответствующего «электронного облака».
2. Азимутальное или орбитальное квантовое число l определяет значение орбитального механического момента количества движения, принимает (при заданном n) значения: 0, 1, 2, 3, …, n – 1.
Состояния электронов с l = 0, 1, 2, 3, … обозначаются строчными латинскими буквами s, p, d, f и далее по алфавиту. Например, состояние, характеризующееся l = 0, называют s-состоянием, а электрон в этом состоянии – s-электроном. Значение главного квантового числа указывают перед условным обозначением орбитального квантового числа. Например, электроны в состоянии с n = 2 и l = 0 и 1 обозначают соответственно символами 2s и 2р.
3. Орбитальное магнитное квантовое число ml даёт значение проекции механического момента на выделенное направление и при заданном l принимает следующие значения: ml = 0, ±1, ±2, ..., ± l, т.е. всего 2l + 1 значений.
Физический смысл магнитного квантового числа можно понять, учитывая, что момент импульса (механический орбитальный момент) электрона L есть вектор; тогда величина Llz = ml определяет проекцию этого вектора на ось z (на рис. 21 рассмотрены p- и d-состояния).
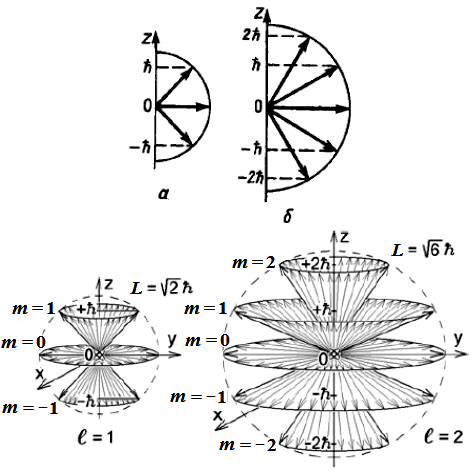
Рис. 21. Проекции орбитального момента электрона
на выделенное направление
4. Спиновое квантовое число ms определяет значение проекции спинового момента электрона µs на выделенное направление и принимает два значения ms = ± s (s = 1/2 – спин электрона).
Состояниям атома водорода с одним и тем же n и различными остальными квантовыми числами соответствуют одинаковые значения энергии, т.е. энергетические уровни вырождены по l, ml и (приближённо) ms. В не кулоновском центрально-симметричном поле вырождение по l снимается.
Сериальные закономерности в наиболее простой форме проявляются в спектре одноэлектронного атома водорода, для которого они и были открыты впервые.
Рассмотрим атом водорода и сходные с ним ионы (модель так называемого водородоподобного атома), т.е. предположим, что имеется атомная система, состоящая из ядра с зарядом Zе и одного электрона с зарядом –е, где Z – порядковый номер элемента в периодической системе Д. И. Менделеева.
Кулоновская сила F взаимодействия между ядром и электроном играет роль центростремительной силы, равной для круговой орбиты
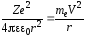 , (29)
, (29)
где me – масса электрона; r – радиус орбиты.
В электрическом поле ядра электрон обладает потенциальной энергией
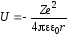 . (30)
. (30)
Полная энергия электрона равна сумме потенциальной и кинетической энергии.
С учётом (29) и (30) и знаков в этих выражениях получаем
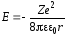 . (31)
. (31)
Согласно классической электромагнитной теории вращающийся по орбите электрон возбуждает вокруг себя переменное электромагнитное поле, распространяющееся в пространстве со скоростью света. Иначе говоря, ускоренно движущийся электрон при своем вращении вокруг ядра должен излучать, а поэтому и терять часть энергии. Таким образом, согласно классической механике энергия электрона всё время уменьшается. Из формулы (31) следует, что меньшему значению энергии (с учётом знака) соответствует меньший радиус. В результате электрон должен «упасть» на ядро. Из формулы (29) следует, что с уменьшением радиуса орбиты скорость движения электрона возрастает, т.е. период обращения уменьшается. Это должно привести к непрерывному увеличению частоты излучаемых электромагнитных волн, т.е. атом должен излучать непрерывный (сплошной спектр). Однако в действительности атом – устойчивая система и может излучать лишь линейчатый спектр. Выход из создавшегося противоречивого положения был предложен Нильсом Бором. Основываясь на гипотезе Макса Планка о квантовом характере излучения и поглощения, Бор сформулировал законы, описывающие состояние и движение электронов в атоме в виде определенных постулатов, которые дают объяснение экспериментальным данным. Постулаты эти таковы.
1. Электрон в атоме может вращаться только по строго определённым орбитам, радиусы которых определяются из условия
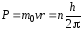 , (32)
, (32)
где P – момент количества движения электрона; n – главное квантовое число; h – постоянная Планка.
Все другие виды орбит «запрещены». Таким образом, Бор постулировал, что энергия электрона в атоме может принимать строго определённые дискретные значения.
2. Вращаясь по стационарным орбитам, электрон не излучает и не поглощает электромагнитных волн.
3. Излучение происходит лишь при переходе электрона из стационарного состояния с большим значением энергии в стационарное состояние с меньшим значением энергии (фотон) строго определённой частоты. Излучение атома монохроматично, и частота его определяется фундаментальным соотношением (условие частот Бора):
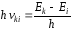 , (33)
, (33)
где hki – энергия излученного фотона.
Из соотношения (33) следует, что излучение происходит при переходе электрона с внешних орбит на внутренние. Если же электрон переходит с внутренних орбит на внешние, то энергия электрона поглощается. Вычислим радиусы стационарных орбит и полную энергию электрона в водородоподобном атоме. С учетом (29) и условия квантования Бора (32) для значений радиусов стационарных орбит и энергий стационарных состояний имеем соответственно
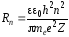 , (34)
, (34)
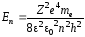 . (35)
. (35)
Из формулы (35) следует, что квантовое число n представляет энергию электрона в атоме, так как остальные величины постоянные. В общем случае атомная система, состоящая из ядра и одного электрона, приходя из стационарного состояния, характеризуемого главным квантовым числом nk, испускает по условию частот Бора спектральные линии с частотами
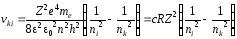 , (36)
, (36)
где постоянная величина
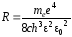 (37)
(37)
называется постоянной Ридберга.
Таким образом, следуя определению волновых частот, получаем следующее выражение:
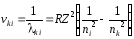 . (38)
. (38)
Полученное соотношение (38) выражает один из самых точных законов в физике. Из него, прежде всего, следует, что все линии спектра могут быть объединены в серии.
Серией называется совокупность спектральных линий, описываемых формулой (38) при ni = const, т.е. серия возникает при переходе с вышележащих орбит nk = ni + 1, ni + 2, …, ni + на орбиту с заданным квантовым числом ni.
Формулу (38) можно представить в следующем виде:
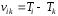 , (39)
, (39)
где
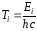 и
и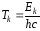 – сериальные термы, пропорциональные
значениям энергии атома с точностью до
некоторой аддитивной постоянной. В этой
связи приобретает физический смысл и
постоянная РидбергаR,
а именно R
– число, пропорциональное энергии атома
в основном состоянии.
– сериальные термы, пропорциональные
значениям энергии атома с точностью до
некоторой аддитивной постоянной. В этой
связи приобретает физический смысл и
постоянная РидбергаR,
а именно R
– число, пропорциональное энергии атома
в основном состоянии.
В спектр испускания водорода входит несколько серий, расположенных в различных областях спектра:
а) серия Лаймана (ni = 1) – крайняя ультрафиолетовая область:
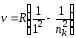 ,
,
где nk = 2, 3, …, ;
б) серия Бальмера (ni = 2) – видимая и близкая ультрафиолетовая области:
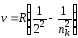 ,
,
где nk = 3, 4, …, ;
в) серия Пашена (ni = 3) – инфракрасная область спектра:
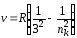 ,
,
где nk = 4, 5, …, ;
г) серия Брэкета (ni = 4) – инфракрасная область спектра:
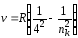 ,
,
где nk = 5, 6, …, .
Схема энергетических уровней атома водорода и соответствующих переходов показана на рис. 22.

Рис. 22. Схема энергетических уровней атома водорода
Как видно из рис. 22, условными линиями каждой серии являются линии, частоты которых могут быть рассчитаны по формуле
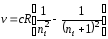 . (40)
. (40)
Если в формулах (36) или (40) положить nk = , то частота будет определяться выражением
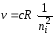 ,
,
по которому определяется граница серии.
Особый интерес представляет определение граничной линии серии Лаймана гр = сR, что следует из сериальной формулы при nk = . Зная частоту граничной линии серии Лаймана, можно определить энергию, необходимую для отрыва электрона от атома водорода, находящегося в нормальном, или основном, состоянии с ni = 1. Эта энергия называется энергией ионизации и вычисляется по формуле
Eион = hгр = hcR. (41)
Для водородоподобного атома
Eион = hcRZ2. (42)
Таким образом, зная значения констант, можно вычислить энергию ионизации водородоподобного атома по формуле (42).
Следует подчеркнуть, что экспериментально найденное значение постоянной Ридберга R отличается от теоретического значения, что видно из следующих данных:
Rтеор = 10 973 730,3 м–1,
Rэксп = 10 967 758,1 м–1.
Расхождение объясняется тем, что при выводе формулы (41) ядро водородоподобного атома считалось неподвижным. В действительности же ядро имеет конечную массу.
