
- •Содержание
- •Лабораторная работа № 1 определение отношения заряда электрона к его массе методом магнетрона
- •Краткая теория
- •Выполнение работы
- •8. При вычислениях используйте следующие данные, характеризующие установку:
- •Выполнение работы
- •1. Устройство и принцип работы модуля «Опыт Франка и Герца»
- •2. Снятие зависимости анодного тока от напряжения на сетке с использованием двухкоординатного графопостроителя н-307/1
- •Контрольные вопросы и задания
- •Рекомендуемая литература
- •Лабораторная работа № 3 изучение неон-гелиевого лазера
- •Краткая теория
- •Устройство Ne-He лазера
- •Механизм образования инверсии в Ne-He лазере
- •Спектр излучения Ne-He лазера
- •Выполнение работы
- •1. Определение длины волны излучения Ne-He лазера
- •2. Исследование распределения интенсивности в лазерном пучке
- •3. Определение расходимости лазерного пучка
- •Контрольные вопросы и задания
- •Рекомендуемая литература
- •Лабораторная работа № 4 изучение сериальных закономерностей в спектре атома водорода
- •Краткая теория
- •Краткое описание установки
- •Выполнение работы
- •Контрольные вопросы и задания
- •Рекомендуемая литература
- •Справочные материалы
- •Лабораторная работа № 5 спектр атома водорода. Атом бора
- •Краткая теория
- •Выполнение работы
- •1. Экспериментальное исследование спектра поглощения
- •1.1. Схема эксперимента
- •1.2. Метод измерения уровней энергии
- •1.3. Исследование спектра. Уровни энергии
- •1.4. Уровни энергии. Параметрическая зависимость
- •2. Обобщенная формула Бальмера. Спектральные серии
- •3. Постулаты Бора
- •4. Система атомных единиц
- •5. Атом водорода
- •5.1. Атом Бора (круговые орбиты)
- •5.2. Атом Бора – Зоммерфельда
- •Контрольные вопросы и задания
- •2. Модель атома по Эрнесту Резерфорду
- •3. Случай многократных столкновений
- •4. Случай однократных столкновений
- •Выполнение работы
- •1. Рассеяние на атоме Томсона
- •2. Рассеяние на атоме Резерфорда
- •3. Рассеяние на многоатомных мишенях
- •4. Расчёт вероятности рассеяния
- •5. Оценка времени экспозиции
- •Контрольные вопросы и задания
- •Рекомендуемая литература
- •Лабораторная работа № 7 изучение спектра атома натрия
- •Краткая теория
- •Экспериментальная установка
- •Выполнение работы
- •Справочные материалы
- •Контрольные вопросы и задания
- •Рекомендуемая литература
Лабораторная работа № 5 спектр атома водорода. Атом бора
Цель работы:
–моделирование экспериментальной обработки спектра поглощения атома водорода;
– определение уровней энергии;
– построение формулы Бальмера;
– визуализация полуклассических моделей атома водорода.
В этой программе принята следующая концепция: постулаты – положения, проверяемые исключительно экспериментом. При построении физической модели атома постулированные положения являются следствием данных эксперимента.
Приборы и принадлежности: компьютер с программой «Физика микромира».
Краткая теория
Модель атома водорода, предложенная Н. Бором, была первой моделью атома, использовавшей квантовые представления, и первой моделью, достигшей реальных успехов в объяснении спектров атомов.
После опытов Э. Резерфорда, когда стали очевидными малые размеры массивного положительного ядра, задача о движении электрона в атоме также стала очевидной – это задача И. Кеплера о движении планеты в поле тяготения Солнца. На круговой орбите энергия Е и момент импульса L электрона связаны соотношением
 . (43)
. (43)
Классический электрон, двигаясь с ускорением, излучает энергию в виде электромагнитных волн со сплошным спектром и, потеряв бесконечно большое количество энергии, должен был бы упасть на точечное ядро.
Однако атомы в природе стабильны (электроны не падают на ядро), а спектр излучения линейчатый. Длины волн излучения, соответствующего спектральным линиям атома водорода, описываются эмпирической формулой Бальмера:
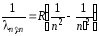 ,
,
где R = 10 973 732 м–1 – постоянная Ридберга; n = 1, 2, 3, …; п' > п. Если принять, что электромагнитное излучение частоты ω (или имеющее длину волны λ = 2c/ω) проявляет себя в виде квантов энергии Е = 2πhc/λ, то вместе с линейчатым характером спектра это однозначно приводит к первому постулату Бора:
Атом имеет дискретный набор стационарных состояний, находясь в любом из которых атом не излучает и имеет постоянную энергию. Излучение происходит лишь при переходах из одного состояния в другое. Понятия уровня энергии и перехода между ними неразрывно связаны!
Закон сохранения энергии при переходе приобретает вид второго постулата Бора, называемого также правилом частот:
– при переходе электрона между уровнями энергии (Еn' > Еn) излучается или поглощается квант энергии
∆En',n=ħn',n=En'–En , (44)
где ħn',n – частота соответствующего излучения.
Используя формулу Бальмера, записанную в виде
 , (45)
, (45)
и правило частот (44), получаем, что энергия уровня, характеризующегося числом п, равна
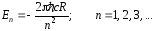 (46)
(46)
Для
круговых орбит с моментом импульса
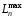 из формул (43) и (46) получаем однозначный
результат:
из формул (43) и (46) получаем однозначный
результат:
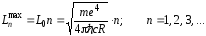
Подставив значения констант, находим
L0 = 1,0545710–34 Джс = .
Таким образом, условием, выбирающим среди непрерывного множества классических круговых орбит только те, которые соответствуют опыту, оказывается условие квантования момента импульса:
Ln = n; n = 1, 2, 3, … (47)
В атомной физике полученное соотношение (47) носит иногда название третьего постулата Бора.
Таким образом, классическое уравнение движения электрона по круговой орбите
 , (48)
, (48)
дополненное постулированным ранее правилом квантования момента импульса
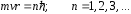 , (49)
, (49)
определяет все параметры круговых орбит электрона:
– радиус:
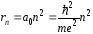 ;
;
– скорость:
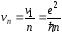 ;
;
– энергию:
 ; (50)
; (50)
– частоту и период обращения:
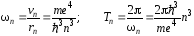 .
.
На вопрос же о величине максимального момента импульса, соответствующего движению по круговой орбите при заданной энергии, мы имеем вполне однозначный ответ:
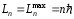 . (51)
. (51)
