
ОЯФРиД
.pdf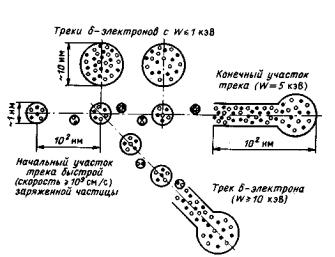
формироваться очень разные по энергозатратам объекты (это собственно трек, малые треки, шпоры и каплеобразные образования – «блобы», завершающие конец трека или существующие самостоятельно вдоль него).
Теперь можно более подробно рассмотреть структуру треков, взяв две крайние ситуации – с очень малой величиной ЛПЕ и очень большой ЛПЕ ионизирующих частиц. Схема трека ускоренного электрона представлена на рис. 2.1. Эта схема относится к системам с минимальной ЛПЭ. Образования с малым числом ионизированных и возбужденных молекул-«шпоры», вызваны т.н. «скользящими» столкновениями, и в среднем на образование одной шпоры уходит ~ 40 эВ. Заметим, что около половины энергии исходного электрона теряется порциями менее 100 эВ, а расстояния между шпорами составляют порядка нескольких сотен нм. Остальная половина энергии теряется в т.н. «лобовых» соударениях, в результате которых образуются вторичные электроны с энергией от нескольких сот эВ до ~ ½Eo, где Eo – начальная энергия быстрого электрона. В зависимости от полученной энергии вторичные электроны (их часто называют «энергетическими» или «δ-лучами») образуют либо укороченные треки, либо треки, представляющие уменьшенную копию первичного трека, а совсем «слабые» вторичные электроны (их E = 100÷500 эВ) дать трек уже не могут, но зато дают «большую шпору» и имеют свое название – «блоб». Здесь так подробно рассмотрена структура трека для того, чтобы на чисто качественном уровне стало ясно, что, если в самом начале процесса радиолиза мы имеем очень сложное распределение исходных продуктов, то и их последующая «жизнь» тоже не может быть единообразной.
Рис. 2.1. Схема трека ускоренного электрона. (Масштаб произвольный)
Кафедра радиохимии и
прикладной экологии© |
41 |
|
Вторая ситуация, связанная со структурой трека, созданного частицей с очень высоким значением ЛПЭ (например, продуктом деления ядер урана) может быть легко получена, если ранее приведенный рисунок 2.1 мы резко сожмем по оси движения частицы, причем сжатие это может быть в тысячи и десятки тысяч раз (см. отношения ЛПЭ). Очевидно, наш трек будет сильно похож на относительно короткий цилиндр, в котором плотно собрались молекулы воды, получившие энергию извне и находящиеся в возбужденном или ионизированном состоянии. На самом деле так и происходит, только образовавшийся цилиндр будет иметь вид плотного «сердечника» из прижатых друг к другу шпор и диффузной оболочки из δ-треков. Совершенно естественно, что в такой системе (с высокой ЛПЭ) радиационно-химические процессы будут развиваться по иному, нежели в треке, представленном на рис.2.1. Самое резкое отличие будет наблюдаться в характере распределения поглощенной энергии – для частиц с малой ЛПЕ большая доля (до 80%) энергии будет реализоваться за пределами трека – в боковых треках, шпорах и блобах. Для частиц с большой ЛПЕ, наоборот, большая часть энергии (свыше половины) будет реализоваться в «сжатом»треке.
Теперь, прежде, чем приступить к рассмотрению процессов, протекающих в шпорах, коротких и длинных треках и блобах, систематизируем сведения о тех продуктах, с которыми встречается исследователь процессов радиолиза.
Электроны могут характеризоваться:
1.по происхождению – первичные, вторичные (δ);
2.по энергии – возбужденные, неионизирующие (энергия ниже первого потенциала ионизации), невозбуждающие (энергия ниже первого триплетного уровня возбуждения), термализованные – энергия равна тепловой энергии атомов и молекул окружающей среды;
3.по состоянию: сухие – термализованные, но еще не прореагировавшие со средой; гидратированные – e-aq – электрон, связанный с молекулой воды, или, в общем случае, сольватированный – e-s – если в системе присутствует неводный растворитель.
Ионы. Ионами называются атомы и молекулы с избытком положительного или отрицательного заряда. (Иногда используют термин – «молекулярный ион» - если ион содержит более одного атома). Возбужденными ионами называют ионы, в которых один или более электронов находятся в возбужденном состоянии.
Радикалы. Свободными радикалами называют атомы и молекулы, имеющие неспаренный электрон и способные образовывать химические связи. Могут быть стабильными (напр. NO, NO2, ClO2) или нестабильными (H, OH, CH2). Возбужденными свободными радикалами называют радикалы, в которых один или более электронов
Кафедра радиохимии и
прикладной экологии© |
42 |
|
находится в возбужденном состоянии. Ион-радикалами называют свободные радикалы с избытком положительного или отрицательного заряда.
Молекулы. Возбужденными молекулами называются молекулы, обладающие избыточной электронной, колебательной или вращательной энергией. Если энергия возбуждения превышает первый потенциал ионизации, то молекула называется сверхвозбужденной. Эта концепция введена в 1962 году Р. Платцманом, имя которого связывают с предсказанием существования гидратированного электрона.
2.2.2.Механизм радиолиза воды
Омеханизме радиолиза целесообразно говорить, рассматривая какую-либо конкретную систему. Во многих случаях в качестве такой системы выбирают воду, как наиболее хорошо изученный объект. После такого знакомства будет легче понять радиолиз водных растворов, газов и твердых тел.
Как правило, протекание радиолиза во времени описывают в виде трех последовательных стадий. Первая, называемая обычно физической, длится в течение 10- 17÷10-14 с и представляет собой процесс подвода энергии к системе. Временной диапазон как
раз соответствует времени прохождения ионизирующих частиц и фотонов около исходной молекулы воды. Сопровождается появлением первичных продуктов радиолиза. Ими будут являться возбужденные молекулы воды (H2O*), сверхвозбужденные молекулы воды (H2O**), ионы (H2O+), возбужденные ионы (H2O+*) и вторичные электроны, как результат процессов ионизации. Схематически это можно записать в виде уравнений:
H2O → H2O* |
(1) |
H2O → H2O** |
(2) |
H2O → H2O+ + e-B |
(3) |
H2O → H2O+* + e-B |
(4) |
Таким образом, видно, что основной особенностью физической стадии является протекание чисто электронных процессов, связанных с миграцией вторичных электронов (e- B), образовавшихся ионов, появлением электронов недовозбуждения.
Вторая физико-химическая стадия занимает интервал времени от 10-14 до 10-11 (разумеется, эти интервалы надо принимать как достаточно условные, эти зоны размыты, и один этап плавно переходит в другой). Главную роль на этой стадии играют процессы, результатом которых является установление теплового равновесия в системе. Это достигается за счет диссоциации возбужденных и сверхвозбужденных молекул воды,
Кафедра радиохимии и
прикладной экологии© |
43 |
|
автоионизации сверхвозбужденных молекул и термализация электронов недовозбуждения: (реакции 5-9)
H2O* → H + OH |
(5) |
H2O+ + H2O → H3O+ + OH |
(6) |
H2O* → H2 +O |
(7) |
H2O** → H2O+* + e- |
(8) |
e-B → e-aq |
(9) |
Образовавшиеся продукты вступают в реакции:
eaq eaq H2 |
2OHaq |
(10) |
|||
- |
- |
2 2 |
|
- |
|
e-aq + OH → OH-aq |
|
|
(11) |
||
e-aq + H+aq→ H |
OHaq |
(12) |
|||
eaq H H2 |
(13) |
||||
- |
|
2 |
|
- |
|
H + H → H2 |
|
|
(14) |
||
OH + OH → H2O2 |
|
|
(15) |
||
H + OH → H2O |
|
|
(16) |
||
H+aq +H-aq→ H2O |
|
|
(17) |
||
Таким образом, к концу второй стадии в воде существует следующий набор продуктов: H, OH, H3O+ (H+aq); H2;O; e-aq ; H2O2.
Третья – химическая стадия охватывает промежуток времени 10-11 – 10-7 с. За это время в шпорах, блобах полностью заканчиваются реакции продуктов радиолиза между собой и происходит (за счет диффузии) усреднение концентрации образовавшихся продуктов по всему объему воды. Важно отметить, что к началу третьей стадии распределение продуктов радиолиза вдоль оси трека успевает стать неоднородным. Причина этого в том, что образовавшиеся вторичные электроны в процессе потери энергии и последующей термализации и гидратации могут уйти настолько далеко от «своей» материнской молекулы воды, что процесс H2O+ + e-→ H2O* становится маловероятным. Кстати, это положение вовсе не очевидно, и по проблеме топографии первичных продуктов радиолиза длительное время существовали две гипотезы. Та, которая была изложена выше, известна как гипотеза Ли-Грея-Платцмана; вторая, известная как гипотеза Самюэля-Маги, предполагала, что термализованные электроны распределены так же, как H2O+, H3O+, H и OH. Последние оценки и ряд экспериментальных фактов подтверждают правоту теории Ли-
Кафедра радиохимии и
прикладной экологии© |
44 |
|
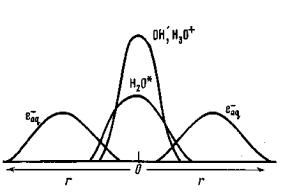
Грея-Платцмана, а отсюда следует, что еще до начала реакций в шпорах уже сложилось более диффузное распределение e-aq, чем у остальных продуктов. Это иллюстрирует рис.2.2.
Ниже дается сводка основных реакций во всем объеме, для воды, облучаемой излучением с низкой величиной ЛПЭ. Заметим, что при облучении воды излучением с высокой величиной ЛПЭ картина будет иной, т.к. иной будет стартовая топография в треках и шпорах. Здесь уместно заметить, что приводимая система стадийности радиационнохимических процессов достаточно условна, и ее надо рассматривать как сложную систему, плавно, быстро и непрерывно переходящую из одного состояния в другое, более устойчивое.
Рис. 2.2. Схема распределения продуктов радиолиза воды перед началом реакций в шпорах.
Весь набор продуктов радиолиза к моменту окончания реакций в шпорах обычно рассматривают как систему, содержащую три группы химических агентов разной химической активности:
радикалы –e-aq H, OH, O, молекулярные продукты – H2, H2O2, ионные продукты – H+aq; OH-aq.
Если в воде полностью отсутствуют растворенные вещества, то наступает заключительная часть, которую, при расширении временного диапазона, можно считать окончанием третьей (химической) стадии радиолиза, а можно и выделить в самостоятельную, т.н. гомогенную стадию. Может быть, в этом есть определенный смысл, т.к. раньше все развивалось в шпорах, а теперь реакции идут во всем объеме раствора:
e-aq + H2O2 → OH + OH- |
(18) |
|
H + H2O2 → OH + H2O |
(19) |
|
OH + H2O2 → H2O + HO2 |
(20) |
|
HO2 |
→ O-2 + H+ |
(21) |
HO2 |
+ HO-2 + H2O → H2O2 + OH- |
(22) |
Кафедра радиохимии и
прикладной экологии© |
45 |
|
HO2 |
+ HO2 → H2O2 + O2 |
(23) |
OH + H2 → H2O + H |
(24) |
|
HO2 |
+H → H2O2 |
(25) |
HO2 + e-aq + → HO-2 |
(26) |
|
HO-2 + H2O → H2O2 + OH- |
(27) |
|
HO2 |
+ OH → H2O3 → H2O + O2 |
(28) |
H + O2 → HO2 |
(29) |
|
e-aq +O2 → O-2 |
(30) |
|
Как видно, многочисленные реакции, протекающие на гомогенной стадии заканчиваются в основном образованием исходных молекул воды и продуктов, которые и считаются окончательными молекулярными продуктами радиолиза чистой воды: H2, H2O2 и
O2.
В том случае, когда вместо чистой воды имеется водный раствор, картина резко меняется, поскольку гомогенная стадия в значительной степени будет представлена уже не реакциями (18-30), а реакциями между растворенным веществом и химически-активными продуктами радиолиза; это будут в основном окислительно-восстановительные процессы.
Однако, прежде чем переходить к радиолизуводных растворов, необходимо уточнить две проблемы. Одна из них связана с классификацией радиационно-химических выходов, вторая – с возможностью их определения расчетными методами, когда прямой эксперимент по тем или иным причинам невозможен.
2.2.3. Классификация радиационно-химических выходов
Введенное на заре развития радиационной химии понятие радиационно-химического выхода (G), равное числу образованных (или исчезнувших, измененных) продуктов радиолиза на каждые 100 эВ поглощенной энергии, как оказалось, имеет весь ограниченное применение. Без каких-либо оговорок это понятие может быть использовано в единственном случае – если получаемый продукт никак не взаимодействует со средой, является устойчивым во времени и его накопление линейно связано с изменение дозы. Здесь уместно заметить, что такая ситуация (если продукт к тому же доступен для быстрого определения) идеально подходит для создания химического дозиметра, однако, наблюдается она достаточно редко. Причин тому более, чем достаточно. Вот только некоторые из них: многие продукты радиолиза настолько короткоживущи, что даже их определение не всегда оказывается возможным, многие вступают в химические реакции и там все будет определяться термодинамическими и кинетическими факторами, многие рекомбинируют с
Кафедра радиохимии и
прикладной экологии© |
46 |
|
образованием исходного продукта – другими словами, определяемое тем или иным способом содержание продуктов радиолиза часто имеет весьма сложную и не всегда очевидную связь с поглощенной энергией.
Чтобы избежать разночтений, было предложено конкретизировать понятие радиационно-химического выхода путем введения нескольких новых определений.
В радиационной химии воды и водных растворов введено понятие первичного (начального) выхода. Этот выход продуктов радиолиза до начала реакций в шпорах, треках и блобах. Эти выходы представляют в «чистом» виде итог передачи энергии ионизирующей частицы окружающей среде. Это подчеркивается надстрочным индексом «о» – (напр.
GoR ). Т.о. GoR относится только к H2O*, H2O**, H2O+, H2O+* и e-возб. (см. реакции 1÷4). Это важнейшая величина, оценка которой может быть сделана только путем достаточно сложных квантово-химических расчетов, т.к. связана с временами ~ 10-16 – 10-17 с, недоступными пока для экспериментального наблюдения.
Продукты радиолиза, избежавшие исчезновения в шпорах (~ 10-8 с) и вступившие в контакт с основной массой раствора, характеризуют т.н. трековым выходом и обозначают как GR и GRz для свободно радикальных или молекулярных продуктов радиолиза соответственно; некоторые из них уже поддаются экспериментальной оценке. И наконец, часто встречается термин – наблюдаемый (измеряемый, молекулярный) выход – он относится, как правило, к молекулярным продуктам, наблюдаемым экспериментально; его обозначение G(RZ), например,G(H2O2).
Гораздо реже встречается выражение - равновесный выход. Он в основном относится к радикалам, обозначается как G(R), например, G(H); G(OH) и т.д. и отражает ситуацию, когда скорость образования продукта близка (или равна) скорости его распада. Признаком в этом случае является независимость соответствующего G(R) от дозы излучения.
Численные значения радиационно-химических выходов могут колебаться в довольно широких пределах. По этому параметру все выходы делят (весьма условно) на три группы; к первой относят процессы, у которых G лежит в пределах от долей единицы до нескольких единиц. Это энергоемкие процессы, требующие высокой энергии активации. Процессы, характеризующиеся величинами G = 10÷20 моль/100 эВ имеют невысокие энергии активации, продукты иногда образуются в коротких цепях. К третьей группе процессов относят те, которые характеризуются аномально высокими значениями G, доходящими до 105÷106 моль/100 эВ. Поскольку на одно превращение (чисто формально) приходится всего 10-3÷10-4 эВ, то совершенно очевидно, что это могут быть только цепные реакции, в которых роль излучения заключается только в инициировании процесса. Заметим, что во
многих случаях именно такие процессы могут иметь важное прикладное значение.
Кафедра радиохимии и
прикладной экологии© |
47 |
|
2.2.4. Уравнения материального баланса радиолиза воды
Из рассмотрения предыдущих разделов достаточно ясно прослеживается мысль о том, что простая идентификация возбужденного состояния или факта появления короткоживущего радикала требует очень заметных усилий. Эта проблема многократно усложняется при попытках определения конкретных величин радиационно-химических выходов, особенно в части первичных и трековых G. Подавляющее большинство экспериментальных методов, пригодных для решения задач, относится к той части физической химии, которая занимается исследованием кинетики быстрых и сверхбыстрых процессов, протекающих в диапазоне от микросекунд до пикосекунд.
Среди методов регистрации главную роль играют такие как оптическая спектроскопия в диапазоне от УФ до ИК-области, включая методы люминесценции и светорассеивания; ЭПР-спектроскопия, кондуктометрия, полярография. Ионизирующее излучение в этом случае генерируется в установках импульсного радиолиза.
Оценивать достоверность получаемых при этом величин G или искать причины их расхождения, а также определять недоступные экспериментальным методам значения G (классический пример такой ситуации – определение G(-H2O)) получает широко практикуемый метод составления т.н. уравнения материального баланса.
Идея здесь достаточно простая. Она заключается в следующем. Если у нас имеет схема протекания того или иного радиационно-химического процесса, то мы сможем установить количественную связь между интересующими нас выходами. Такая связь и называется уравнением материального баланса радиолиза. Эти уравнения ни в коем случае нельзя путать с химическими уравнениями, они фиксируют отношения количеств (выходов), которое будет верным, если в начале была заложена верная схема протекания процесса.
Поясним это на примере составления уравнения материального баланса радиолиза воды для случая, когда вода облучается потоком с малой величиной ЛПЕ (γ-излучение, β- излучение, рентгеновское излучение, ускоренные электроны). При разрушении молекулы воды (см. трековые реакции 10÷17) ее «водородная часть» представлена молекулой водорода (H2), которая образуется (по нашей схеме реакц. 10, 13, 14) несколькими путями, но каждый из них дает одну молекулу H2 в результате «гибели» 2-х молекул исходной воды. Каждый радикал H и гидратированный электрон – свидетель гибели одной молекулы воды.
Таким образом, для «водородной»части молекулы мы можем написать:
G( H2O) G(H) G(e aq) 2G(H2 ) (2.2)
Для «гидроксильной»части молекулы воды мы видим, что каждый радикал ОН – свидетель гибели одной молекулы воды (реакции 5,6), а молекула H2O2 означает убыль 2-х
Кафедра радиохимии и
прикладной экологии© |
48 |
|
молекул воды (реакц. 15). ТогдаG( H2O) |
G(OH) G(OH) 2G(H2O2 ) . Но поскольку мы |
|||
рассматривает эволюцию одной и той же молекулы воды, то можем записать: |
|
|||
G( H2O) |
G(H) G(e aq) 2G(H2 ) |
= G(OH) 2G(H2O2 ) . |
(2.3) |
|
Это и есть основное уравнение материального баланса радиолиза воды. Как видно, с |
||||
его помощью можно |
попытаться |
определить |
G( H2O) , а путем |
сверки правой |
(гидроксильной) и левой (водородной) его частей убедиться в верности исходных теоретических посылок. Более того, если разные типы излучения имеют одинаковые (или близкие) значения ЛПЕ, они должны дать близкие или совпадающие значения трековых выходов. Подтверждением является данные табл. 2.1, полученные с использованием γ- излучения Co-60 и электронов с энергией 1МэВ и выше.
|
|
|
|
|
|
|
Таблица 2.1 |
|
|
|
|
|
|
|
|
|
|
pH |
G(e- |
G(H) |
G(OH) |
G(H2O2 ) |
G(H2 ) |
G( H2O) |
||
|
aq ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
По H-части |
|
По OH-части |
0-2 |
3,05 |
0,6 |
2,95 |
0,80 |
0,45 |
4,55 |
|
4,55 |
4-9 |
2,8-2,9 |
0,6 |
2,8-2,9 |
0,75 |
0,45 |
4,35 |
|
4,35 |
12-13 |
3,05 |
0,55 |
2,9 |
0,75 |
0,4 |
4,40 |
|
4,40 |
Эти результаты показывают, что G( H2O) воспроизводится в очень широком диапазоне
pH, т.е. что участие «посторонних» в данном случае ионов H+ и OH- заметным образом не влияют на происхождение трековых реакций, что позволяет использовать полученные данные при работе не только с водой и с разбавленными водными растворами (подробнее см. ниже). Однако, ситуация меняется резко, когда используется излучение с высокими значениями ЛПЕ, когда трековые процессы развиваются не в индивидуальных треках, разделенных между собой, а в основном треке, где вероятность взаимодействия радикалов и молекулярных продуктов выше. К тому же надо учесть, что в треках с большой ЛПЕ появляется радикал HO2, который может уменьшить выход G(H) по реакции H+O2→ HO2, а также снизить выход G(OH) по реакции H2O + OH→H2O+O2 и G(H2O2 ) по реакции H2O2 + OH2→H2O+O2+OH.
С учетом этих процессов уравнение материального баланса радиолиза воды принимает вид:
G( H2O) G(H) G(e aq) 2G(H2 ) G(HO2 ) G(OH) 2G(H2O2 ) 2G(HO2 ) . (2.4)
Кафедра радиохимии и
прикладной экологии© |
49 |
|
Из этого следует, что в данной ситуации G( H2O) будет уменьшаться (см. левую половину уравнения), а G(OH) и G(H2O2 ) также изменятся в меньшую сторону. Ведь это согласуется с тем, что чем больше прошло трековых реакций, тем меньше G( H2O) .
Теперь можно перейти к вопросу о радиолизе водных растворов. При этом надо иметь в виду, что первичные выходы, как и трековые, в разбавленных растворах сильно меняться не будут, т.к. собственная концентрация воды (55 м/л) в сотни, а может быть, и в тысячи раз превышает концентрацию примеси, которая в условиях достаточно высокой концентрации радикалов «сработать» в треке не сможет. Значит, основные химические реакции переносятся на третью стадию процесса радиолиза, когда произойдет гомогенизация всего объема и все решат законы химической кинетики реакций с участием радикалов, молекулярных продуктов радиолиза и собственно растворенного вещества. Решающую роль будут играть химические свойства первичных и трековых продуктов радиолиза.
2.2.5.Химические свойства основных продуктов радиолиза воды
Кмоменту завершения реакций в треках, шпорах и блобах в чистой воде можно обнаружить следующие продукты:
1.ионные (H+aq; OH-aq),
2.молекулярные (H2; O2; H2O2),
3.свободно-радикальлные (e-aq, H, OH; HO2).
Трековые выходы большинства продуктов лежат в области единиц штук/100эВ, за исключением G(O2 ) и G(HO2 ) , выходы которых отличаются в меньшую сторону, а G(HO2 ) в
системах с малыми значениями ЛПЕ вообще близок к нулю. G(R) и G(R) могут сильно отличаться. Основные химические характеристики перечисленных групп продуктов приводятся для широкого диапазона pH воды, т.е. по существу для водных растворов.
Ионные продукты.
Уже на начальных стадиях радиолиза возникают хорошо известные ионы H+aq и H-aq. Для ионов водорода характерны реакции протонирования, включая участие в кислотноосновных равновесиях и реакцию нейтрализации. Гидроксильные ионы участвуют в кислотно-основных равновесиях в щелочных средах. При этом с ионом водорода они образуют воду или участвуют в формировании аквогидроксокомплексов, если в воде (даже в качестве примеси) присутствуют катионы элементов, склонных к гидролизу. Возможно взаимодействие с катион-радикалами. Скорости многих реакций H+aq и H-aq близки к диффузионномупределу.
Молекулярные продукты (H2; O2; H2O2). |
||
Кафедра радиохимии и |
50 |
|
прикладной экологии© |
||
|
||
