
ОЯФРиД
.pdf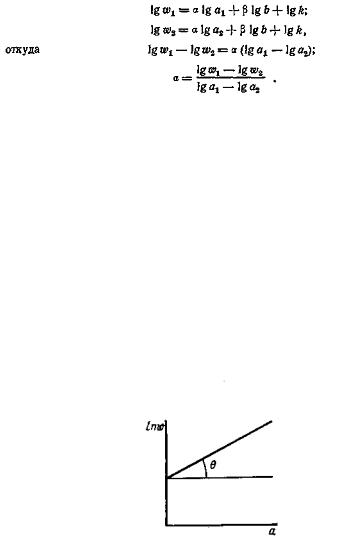
Логарифмируя эти выражения, получим
(3.61)
(3.62)
Если известны значения w, соответствующие, например, различным концентрациям а, то величину можно определить из графика зависимости lgw от lga (рис. 3.4) как tg .
Подставив в уравнение (3.54) значение w1 [формула (3.58)], находим для реакции
первого порядка (так называемой мономолекулярной реакции) |
|
k1 = 0,693 b / 1/2(а+b) |
(3.63) |
Аналогично, используя значение wll из формулы (3.59), получаем для реакции |
|
второго порядка (так называемой бимолекулярной реакции) |
|
k11= 0,693 / 1/2(а+b). |
(3.64) |
Рис. 3.4. График зависимости lg w от lga, используемый для определения порядка реакции изотопного обмена ( =tg )
Пример. Для определения константы скорости изотопного обмена была изучена кинетика изотопного обмена иода-131 между н-С3Н7J и NaJ в 90%-ном этанольном растворе при температуре 35,9° С. Концентрации н-С3Н7J и NaJ одинаковы и равны 0,05 моль/л. В начальный момент времени весь радиоактивный иод 131J содержался в NaJ. Начальная объемная активность раствора Na131J составляла 1040 имп/(мин-мл). По истечении определенного времени t с момента начала изотопного обмена н-С3Н7J отделяли экстракцией циклогексаном, доводили объем полученного раствора до объема исходного раствора и определяли его объемную активность, имп/(мин-мл).
Рассчитаем константу скорости данной реакции изотопного обмена, если известно,
что все реакции изотопного обмена между галогеналкилами и галогенид-ионами относятся к
Кафедра радиохимии и
прикладной экологии© |
91 |
|

числу бимолекулярных. Прежде всего рассчитаем объемную активность н-С3Н7I, соответствующую равнораспределению. Так как молярные концентрации NaI и н-С3Н7I одинаковы, то и их объемные активности при равнораспределении также должны быть одинаковы и составлять 1040/2=520 имп/(мин-мл).
Рис. 3.5. График |
зависимости -lg (1-F) от t, |
используемый для определения |
1/2. |
Подставляя |
в формулу (3.52) вместо |
концентраций соответствующие |
значения |
объемных активностей Iоб,t и Iоб, , находим для каждого момента времени значения степени обмена F, а также значения 1-F, lg(1-F) и -lg(l-F), (табл.3.11). Принимая во внимание уравнение (3.56), с помощью графика определяем (как показано на рис. 3.5) период полуобмена, равный 1/2= 1,5.104с. Для вычисления k11 используем формулу (3.64), которая дает:
k11= 0,693 / 1,5.104 (0,05+ 0,05) = 4,63.104 л/(моль-с).
Зависимость kl и k11 от температуры описывается уравнением Аррениуса: k=ze-E/RТ, (3.65)
где k = kl или k11; z — коэффициент, называемый предэкспоненциальным, или частотным фактором; R — газовая постоянная; Т —абсолютная температура; Е — энергия активации. Если уравнение (3.65) прологарифмировать, то полученное выражение
lgk = lgz- Е lge/RТ |
(3.66) |
дает возможность графическим путем определить Е, если известны значения |
k, |
|
соответствующие разным температурам. |
Таблица 3.11. |
|
Результаты изучения изотопного обмена иода-131 между NaJ и н-С3Н7J при 35,9°С. |
||
* Все значения Iоб,t приведены к одному времени.
Кафедра радиохимии и
прикладной экологии© |
92 |
|

Для отыскания Е по экспериментальным данным строят прямую в координатах
lgk— 1/Т. Тангенс угла наклона прямой численно |
равен |
|
tg = - Е lge/R = - 0,4343 |
Е/R. |
(3.67) |
Из соотношения (4.67) легко рассчитать энергию активации Е, Дж/моль, которая [если |
||
учесть, что R =8,3144 Дж/(моль-К)] равна |
|
|
Е = - 19,144 tg |
|
(3.68) |
Знание энергий активации реакций изотопного обмена позволяет, в частности, сделать заключение о прочности связи атомов в молекулах: чем выше энергия активации, тем связь прочнее.
Пример. Определим энергию активации реакции изотопного обмена иода-131 между NaI и н-С3Н7I, если константы скорости этого процесса, измеренные при температурах 35,9, 50,0 и 80,9°С, соответственно равны 4,63.10-4; 3,04.10-3 и 2,46.10-2 л/(моль-с).
Найдем значения 1/Т (температура в Кельвинах) и lgk (см. табл. 3.12). По данным табл. 3.12 построим прямую в координатах lg k—1/Т (рис. 3.6). С помощью графика находим, что
tg = - 1,8/0,5.10-3 = - 3,6.103.
Таким образом, согласно формуле (4.68), значение энергии активации Е равно: Е = - 19,144 (- 3,6.103) = = 68918 Дж/моль =68,9 кДж/моль.
Рис. 3.6. График зависимости lgk от lgk, используемый для определения энергии активации реакции изотопного обмена
Таблица 3.12.
Вспомогательные расчеты для определения энергии активации
Кафедра радиохимии и
прикладной экологии© |
93 |
|
3.9.4. Механизмы реакций изотопного обмена
Гомогенный изотопный обмен может осуществляться по разным механизмам, большая часть которых полностью соответствует механизмам обычных химических реакций. Реакции гомогенного изотопного обмена, как и обычные химические реакции, могут быть одно-, двух-, трех- и более стадийными. Скорость изотопного обмена в целом определяется наиболее медленной стадией.
В зависимости от механизма реакции гомогенного изотопного обмена можно разделить на две группы. К первой из них относятся реакции, осуществляемые путем перехода электронов (так называемый электронный механизм), ко второй — реакции, протекающие за счет перехода ионов, атомов, группы атомов или даже целых молекул. Во второй группе принято выделять в специальные подгруппы реакции, протекание которых связано с диссоциацией молекул или ионов (так называемый диссоциативный механизм) или, напротив, с образованием ассоциатов (ассоциативный механизм).
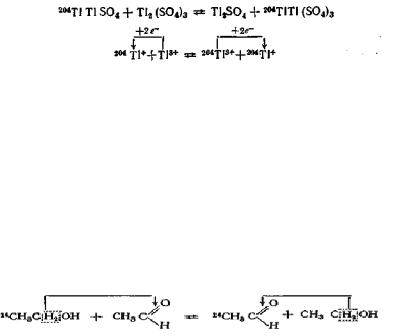
Электронный механизм изотопного обмена соответствует обычному окислительновосстановительному процессу и возможен при протекании изотопного обмена между двумя соединениями, содержащими один и тот же элемент в различных степенях окисления. Например, по этому механизму происходит изотопный обмен в водных растворах между Тl+ и Т13+ :
Изотопный обмен за счет перехода электронов осуществляется фактически без перемещения атомов и протекает с очень большой скоростью. Он часто проходит с низкой энергией активации, т. е. константа скорости изотопного обмена почти не меняется с повышением температуры.
Изотопный обмен, связанный с переходом ионов, атомов, групп атомов, радикалов и молекул, часто осуществляется за счет протекания обычных химических реакций. Например, изотопный обмен атомов 14С между спиртами и альдегидами связан со взаимным окислением и восстановлением спирта и альдегида:
Такой обмен может происходить также по диссоциативному и ассоциативному механизмам.
Диссоциативный механизм В этом случае на первой стадии изотопного обмена исходные молекулы или ионы диссоциируют на более простые молекулы, ионы, радикалы
Кафедра радиохимии и
прикладной экологии© |
94 |
|

или атомы. Общая схема диссоциативного механизма изотопного обмена следующая:
По диссоциативному механизму протекает, в частности, изотопный обмен в одном растворе 89SrCl2 и SrC2О4. Другой пример диссоциативного изотопного обмена — обмен изотопов иода между газообразным иодом и алкилиодидами, обусловленный диссоциацией иода в паровой фазе на атомарный иод:
Изотопный обмен аддендов в комплексных ионах тоже связан с частичной диссоциацией комплексного иона:
Процесс диссоциации в рассматриваемых случаях изотопного обмена является самым медленным; он и определяет скорость изотопного обмена.
Ассоциативный механизм имеет место, если процесс изотопного обмена на первой стадии связан с образованием из исходных веществ промежуточных молекул или переходных комплексов, которые далее быстро диссоциируют, давая исходные вещества с новым изотопным составом:
АХ* + ВХ = АХ* ВХ = АХ + ВХ*
Примером изотопного обмена по ассоциативному механизму может служить изотопный обмен 131I между элементарным иодом и иодид-ионами, протекающий в водном растворе:
I2 + 131I- = [131II2]- = 131II + I-
В данном случае продукт ассоциации достаточно прочен и может быть идентифицирован.
Изотопный обмен в водных и неводных растворах между галоген-алкилами и галогенид-ионами всегда протекает по ассоциативному механизму, например:
C3H7I + Na131I = Na[C3H7I131I] = NaI + C3H7131I
Реакции изотопного обмена, в основе которых лежит ассоциативный механизм, осуществляются по механизмубимолекулярной реакции.
Используя реакции изотопного обмена, можно исследовать прочность и характер химических связей в соединении, характер распределения электронных плотностей и
зависимость подвижности атомов в молекулах от строения последних.
Кафедра радиохимии и
прикладной экологии© |
95 |
|
Так, изучая изотопный обмен, удается выяснить, равноценны или нет одинаковые атомы, содержащиеся в молекуле или ионе. Примером иона с неравноценными атомами одного элемента может служить ион тиосульфата S2O32- . Для изучения вопроса о равноценности атомов серы в этом ионе поступали следующим образом. Получали меченый тиосульфат путем нагревания раствора сульфита натрия с серой, меченной серой-35. Далее действием AgNO3 готовили осадок тиосульфата серебра, который затем подвергали гидролизу при кипячении. В результате получали два серосодержащих продукта - серную кислоту и сульфид серебра, причем серная кислота не содержала атомов 35S, и вся исходная активность входила в сульфид серебра, т. е.
Ag2 S203 + Н20 =Ag235S +H2SO4
Из этих экспериментов следует, что атомы серы в ионе S2O32- неравноценны и внутримолекулярный изотопный обмен между ними отсутствует. Дальнейшие опыты показали, что сера сульфид-иона легко обменивается с одним из атомов серы иона S2O32-, а обмен с другим атомом серы этого иона идет лишь при 100° С и протекает весьма медленно. Эти опыты также подтверждают представление о неравноценности атомов серы в тиосульфат-ионе.
3.9.5. Гетерогенный изотопный обмен
Гетерогенный изотопный обмен может осуществляться между молекулами, находящимися в разных фазах: газовой и твердой; газовой и жидкой; жидкой и твердой; в двух несмешивающихся жидких фазах.
Скорость гетерогенного изотопного обмена зависит, с одной стороны, от скорости подвода и увода меченых молекул от поверхности раздела фаз, т. е. от скорости диффузии, и, с другой стороны, от скорости непосредственно изотопного обмена. Изотопный обмен может протекать или на границе раздела фаз, или в объеме одной из фаз.
Для изотопного обмена с участием твердой фазы при достаточно больших скоростях перемешивания газообразной или жидкой фазы скорость всего процесса определяется скоростью перемещения меченого атома или молекулы соединения от границы твердой фазы, т. е. скоростью диффузии радиоактивного нуклида в твердой фазе.
Примером гетерогенного изотопного обмена между газовой и твердой фазой может служить обмен углеродом-14 между диоксидом углерода и меченым карбонатом бария:
Ва14СО3 + СО2 = ВаСО3 + 14СО2 Изотопный обмен в данной системе наблюдается в присутствии следов воды.
Механизм реакции связан с частичной диссоциацией ВаСО3 при: комнатной температуре: ВаСО3 = ВаО + СО2
Кафедра радиохимии и
прикладной экологии© |
96 |
|
Скорость изотопного обмена между Ва14СО3 и СО2 определяется скоростью диффузии СО2 в твердой фазе.
Изотопный обмен иодид-ионами между хорошо перемешиваемым раствором меченого иодида натрия (или калия) и осадком иодида: свинца (см. 3.9.1., случай 2) представляет собой другой типичный пример гетерогенного изотопного обмена. В случае крупных совершенных кристаллов РbI2, не подверженных перекристаллизации, в обмене участвуют только ионы I- приповерхностного монослоя. При использовании свежеполученного осадка, содержащего несовершенные кристаллы РbI2, склонные к перекристаллизации, в изотопном обмене участвуют и ионы I-, расположенные в глубинных слоях кристаллов. Скорость изотопного обмена с участием несовершенных кристаллов значительно выше, чем с участием совершенных кристаллов. По мере старения свежеполученного осадка РbI2 скорость его перекристаллизации заметно уменьшается и параллельно падает скорость изотопного обмена. Поэтому определение скорости изотопного обмена атомов 131I может служить методом изучения скорости старения осадка РbI2.
Гетерогенный изотопный обмен молекулярным иодом между водным раствором иода в иодиде калия и раствором иода в СНС13 или СС14 в основном зависит от скорости перемешивания водной и органической фаз, причем период полуобмена резко уменьшается с увеличением интенсивности перемешивания каждой фазы.
Исследование гетерогенного изотопного обмена может быть использовано, в частности, для изучения неустойчивых соединений. Так, например, многие полигалогениды
виндивидуальном состоянии значительно менее устойчивы, чем в растворах. В то время как
врастворах существование многих полигалогенидов доказано, попытки доказать с помощью обычных методов факт их существования в твердом виде были безуспешными. Например, на диаграммах плавкости отсутствуют соответствующие эффекты. В существовании твердых полигалогенидов удалось убедиться с помощью радиоактивных индикаторов. Быстрый и
полный изотопный обмен атомами брома в системах галоген-галогенид, например PBr3+ 82BrBr, должен происходить через образование и распад полибромида по схеме
РВг3 +n82ВгВг = РВг3 (82ВгВг)n = РВг282Вг +n Вг2
Рассмотрим применение гетерогенного изотопного обмена для определения удельной поверхности дисперсных веществ. Обычные методы определения удельной поверхности основаны на измерении массы газа, жидкости или красителя, сорбированной определенной порцией исследуемого вещества. Использование радионуклидов в этих случаях позволяет относительно просто измерить массу сорбированного вещества и дает возможность расширить область исследований до малых и ультрамалых концентраций.
Кафедра радиохимии и
прикладной экологии© |
97 |
|
Следует обратить внимание на то, что при определении поверхности любыми сорбционными методами конечный результат зависит or специфических свойств молекул сорбата (их размеров, конфигурации и т. п.). Например, при адсорбции красителей определяемое значение поверхности почти всегда меньше, чем при определении по адсорбции газа, так как большие молекулы красителя не способны проникать в узкие поры. Кроме того, площадь, занимаемая одной какой-либо адсорбированной молекулой на поверхности адсорбента зависит не только от свойств самой молекулы, но и от специфических свойств поверхности адсорбента. Для одной и той же молекулы различия площади при адсорбции на разных адсорбентах могут составлять 20—30% и более. Эти обстоятельства следует учитывать при обсуждении значений поверхности, полученных адсорбционными методами.
Другой метод определения поверхности с помощью радиоактивных индикаторов связан с использованием реакций изотопного или изоморфного обмена между твердым веществом и его насыщенным раствором (или паром), содержащим радиоактивную метку. Это так называемый метод поверхностного обмена. Впервые он был использован для определения поверхности осадков В. Г. Хлопиным и М. С. Меркуловой.
Рассмотрим основные особенности данного метода. Следует отметить, что приведенные ниже рассуждения вполне справедливы как для образцов, находящихся в собственном насыщенном растворе, так и в насыщенном паре. Но для определенности будем считать, что имеется насыщенный раствор исследуемого вещества. Для определения поверхности следует использовать хорошо стабилизированные полидисперсные образцы (со средним размером частиц 10-4—10-3 см и более) или монодисперсные образцы, что позволяет пренебречь npoцессами перекристаллизации. В этих случаях можно предположить, что в изотопном (изоморфном) обмене с раствором участвует практически только один поверхностный мономолекулярный слой частиц твердой фазы. Действительно, в твердых телах диффузия протекает, как правило, крайне медленно (для ионных кристаллов при комнатной температуре коэффициент диффузии принимает значения 10-16 —10-18 см2/с и ниже) и поэтому проникновения радиоактивных атомов из поверхностного слоя в глубь твердых частиц практически не происходит. С течением времени устанавливается равновесное распределение радиоактивных атомов между поверхностным монослоем и раствором. Следует отметить, что время достижения такого равновесия обычно невелико (0,25—0,5 ч), что подтверждает правомочность пренебрежения диффузией в глубь частиц твердой фазы. Определив число радиоактивных атомов, перешедших из раствора в поверхностный слой при равновесии, оказывается возможным найти массу вещества, составляющего поверхностный слой образца.
Кафедра радиохимии и
прикладной экологии© |
98 |
|
Выведем основное уравнение, используемое при определении поверхности методом изотопного поверхностного обмена. Допустим, что имеет место равнораспределение радиоактивного изотопа между поверхностным слоем и раствором, соответствующее, уравнению (4.40). При этом радиоактивный изотоп распределяется между поверхностным слоем образца и насыщенным раствором в таком же отношении, в каком находится общее число молекул, содержащихся на поверхности образца, к числу таких же молекул в насыщенном растворе. Так как регистрируемые активности раствора Iр и твердой фазы Iт пропорциональны числу радиоактивных атомов соответственно в растворе и в твердой фазе, можно записать:
Nт/Nр=Iт/Iр или Nт= Nр(I0 - Iр)/ Iр, (3.69)
где Nт и Nр — число молекул, содержащееся соответственно в поверхностном слое вещества и в насыщенном растворе; I0 — общая регистрируемая активность в системе. Число молекул Nр можно вычислить, зная растворимость соединения при выбранной температуре опыта и объем раствора.
Уравнение (3.69) позволяет характеризовать поверхность через массу молекул, составляющих поверхностный слой 1 г образца (через так называемую относительную удельную поверхность fотн, г/г). Если растворимость исследуемого вещества составляет s г/мл, объем раствора V мл, а масса образца m г, то
fотн |
sV()I0 |
Ip |
|
|
|
(3.70) |
|
|
|
||
|
mIp |
||
Переход от fотн к значению удельной поверхности S, выраженному в см2/г, требует знания площади 2, занимаемой одной молекулой в поверхностном слое. Допустим, что молекулярная масса исследуемого вещества равна М. В таком случае
S=6,02.1023 2 (fотн/M) |
(3.71) |
Экспериментально точное значение площади 2, |
занимаемой одной молекулой на |
поверхности, определить трудно. Обычно допускают, что молекула имеет форму куба с длиной ребра . Тогда площадь грани куба равна:
|
2 |
M |
|
2/3 |
|
|
|
|
()6,02 |
23 |
|
, |
(3.72) |
где — плотность вещества.
С учетом (3.70) и (3.72) соотношение (3.71) можно преобразовать виду
S |
8,45 7 sV()I0 Ip |
. |
(3.73) |
|
2/3mIpM1/3 |
||||
|
Кафедра радиохимии и
прикладной экологии© |
99 |
|

Отметим, что истинную поверхность исследуемого образца удается найти лишь тогда, когда в изотопном обмене участвует весь поверхностный мономолекулярный слой. В тех же случаях, когда в обмене принимают участие только отдельные активные участки поверхности, с помощью формулы (3.73) получают значение так называемой активной поверхности. Вывод о том, является ли найденная поверхность истинной или активной, можно сделать из сопоставления результатов определения поверхности, полученных разными методами (визуальным, адсорбционным, поверхностным обменом и т. д.).
Формула (3.72) обеспечивает вполне удовлетворительную точность оценки площади, занимаемой молекулой в поверхностном слое, для таких молекул, не содержащих цепочек атомов, как AgCl, BaSO4, СаСО3 и т. п. Поэтому для таких соединений и значение поверхности, рассчитанное по формуле (3.73), обычно хорошо согласуется с результатами измерений той же поверхности другими методами. Для молекул, имеющих в своем составе длинные цепочки атомов (например, молекулы органических кислот жирного ряда и других аналогичные соединений), формула (3.72) неприменима.
Кратко остановимся на некоторых экспериментальных особенностях опытов по определению поверхности методом поверхностного обмена. Растворимость соединений, поверхность которых необходимо найти, обычно очень мала. Изменение же концентрации радиоактивных атомов, добавленных в насыщенный раствор, может быть связано с адсорбцией микроколичеств радионуклида на поверхности пипеток при отборе проб. Вследствие этого в каждом случае необходимо контролировать долю активности, сорбированной на стенках посуды.
I об |
а |
б |
в |
t |
Рис. 3.7. График изменения объемной активности раствора во времени при определении поверхности стабилизированного (а) и нестабилизированных (б и в) осадков
Кафедра радиохимии и
прикладной экологии© |
100 |
|
