
ОЯФРиД
.pdf
3.8. Химические изменения при --распаде
Химические изменения при -распаде могут быть результатом действия кинетической энергии отдачи, изменения заряда ядра атома при испускании -частиц и изменения заряда атома вследствие срыва его внешних электронов ядерными электронами или -квантами, а также, вследствие внезапного изменения заряда ядра атома — эффекта «встряски».
Разрушение молекул, в состав которых входит -излучающий атом, за счет энергии отдачи возможно только для легких атомов с высокой энергией -частиц. Для тяжелых атомов с низкой энергией -частиц энергия отдачи не достаточна для разрыва химических связей, так как составляет доли электронвольта, например энергия отдачи при -распаде RaD равна всего 0,04 эВ. Ионизация атомов отдачи при -распаде в результате действия кинетической энергии отдачи не происходит вследствие ее небольших значений для подавляющего большинства атомов. Маловероятна ионизация и при прямом взаимодействии ядерных электронов и -квантов с внешними электронами атома.
Возвращение ядра после -распада в нормальное энергетическое состояние сопровождается для легких ядер испусканием -квантов, а для тяжелых — электронов конверсии. Внутренняя конверсия сопровождается эффектом Оже, который приводит к многократной ионизации атомов, что видно из табл. 3.8.
Вследствие многократной ионизации конверсия электронов вызывает распад молекул, в состав которых, входил -излучающий атом. Например, диссоциация молекул фенилпроизводных свинца после -распада изотопов свинца приводит к образованию изотопов висмута в ионном состоянии в соответствии с коэффициентом конверсии, что видно из табл. 3.9.
|
|
|
|
Таблица 3.8. |
|
|
Заряд атомов, получающихся после -распада |
|
|
||
|
|
|
|
|
|
Заряд |
Доля атомов отдачи с данным зарядом (в %) для процесса |
||||
|
6He 6Li+ |
39Ar 39K+ |
85Kr 85Rb+ |
133Xe |
|
|
|
|
|
133Cs+ |
|
1 |
89,0 |
85,3 |
79 |
80 |
|
2 |
10,6 |
10,9 |
10,9 |
9,4 |
|
3 |
0,4 |
2,6 |
3,91 |
4 |
|
4 |
|
0,9 |
3,12 |
3 |
|
5 |
|
0,3 |
1,51 |
3,4 |
|
6 |
|
0,005 |
0,56 |
3,4 |
|
Таким образом, для тяжелых атомов только два процесса будут предопределять
дальнейшее поведение молекулы, в которой произошел -распад — внезапное изменение |
||
Кафедра радиохимии и |
81 |
|
прикладной экологии© |
||
|
||

заряда ядра атома, при котором получается возбужденное ядро (эффект «встряски»), и конверсия электронов.
Таблица 3.9. Доля висмута, получающегося в виде Bi3+ после -распада изотопов свинца,
находящегося в составе фенилпроизводных
|
|
|
|
|
Изотоп |
Получающийся |
Доля Bi3+(в %) после -распада |
Коэффициент |
|
свинца в |
изотоп висмута |
изотопа свинца в соединении |
конверсии |
|
составе |
|
PbPh3Cl |
PbPh4 |
изотопа |
соединения |
|
|
|
свинца |
RaD |
RaE |
47 |
45 |
60 |
ThB |
ThC |
24 |
25 |
30 |
RaB |
RaC |
11 |
10 |
15 |
Врезультате эффекта встряски 80—90% молекул получается с зарядом +1, а 10—20% атомов теряют еще один или более электронов внешней оболочки
Втабл. 3.10 приведены первичные молекулярные ионы, получающиеся в результате
-распада.
Таблица 3.10. Первичные молекулярные ионы, получающиеся в результате -распада.
Соединение, в |
Образую- |
Выход |
Соединение, в |
Образующий- |
Выход |
|
котором |
щийся |
котором |
ся |
|||
молекуляр- |
молекулярно- |
|||||
происходит - |
молеку- |
происходит - |
молекулярны |
|||
распад |
лярный ион |
ного иона, % |
распад |
й ион |
гоиона, % |
|
|
|
|||||
С2Н4Вг82Вг |
С2Н4Вг+ |
70 |
С2Н53Н |
С2Н5+ |
78 |
|
СС1382Вг |
СС13+ |
64 |
С6Н53Н |
С6Н5+ |
72 |
|
СН33Н |
СН3+ |
83 |
СН314СН3 |
CH3NH3+ |
47 |
Молекулярные ионы, получающиеся в результате -распада, могут быть устойчивыми и неустойчивыми. Так, при -распаде I25Sb в соединении 125SbR3Cl2 образуется 125mTeR3Cl2, который не характерен для элементорганических соединений теллура и, естественно, подвергается распаду. При этом энергетически наиболее выгодным является распад с отщеплением заряженного радикала R+.
-Распад, таким образом, приводит, с одной стороны, к образованию дочернего элемента в отличных от материнского химических соединениях, что дает возможность отделить его от материнского соединения и, с другой стороны, синтезировать ряд химических соединений дочернего элемента непосредственно в процессе -распада. В изучение процессов образования молекулярных ионов и их превращений после -распада большой вклад сделан Нефедовым с сотрудниками.
Кафедра радиохимии и
прикладной экологии© |
82 |
|
3.9. Изотопный обмен
3.9.1. Общие положения
Типичные случаи изотопного обмена. Существование у элементов различных изотопов (как стабильных, так и радиоактивных) приводит к протеканию в системах, где такие изотопы присутствуют совместно, так называемых реакций изотопного обмена.
Изотопным обменом называют самопроизвольный процесс перераспределения изотопов одного элемента между разными фазами, молекулами (химически различными или тождественными) или внутри молекул. В отличие от химических реакций реакции изотопного обмена не приводят к обычным химическим или физико-химическим эффектам, а вызывают только выравнивание изотопного состава элементов, составляющих химические формы или фазы системы.
Специалистам, применяющим радиоактивные индикаторы в химических исследованиях, приходится сталкиваться с изотопным обменом в самых различных случаях. Во-первых, изучение скорости протекания реакций изотопного обмена позволяет исследовать строение молекул. Во-вторых, реакции изотопного обмена можно использовать для синтеза меченых соединений. В-третьих, изотопный обмен может явиться причиной удержания горячего атома в составе исходной молекулы при разделении изотопов. И, наконец, в-четвертых, изотопный обмен может явиться помехой при проведении работ методом меченых атомов.
Протекание реакций изотопного обмена можно обнаружить и проконтролировать только с помощью меченых атомов. Вообще говоря, для этих целей в равной мере пригодны и стабильные, и радиоактивные изотопы. Но так как данный курс посвящен радиоактивным индикаторам и к тому же для большинства элементов сведения об изотопном обмене получены именно с помощью радиоактивных меток, в дальнейшем будет рассматриваться только изотопный обмен с участием радиоактивных изотопов. Будем считать, что из двух обменивающихся изотопов какого-либо элемента один радиоактивный, а другой — стабильный.
Изотопный обмен называют гомогенным, когда обменивающиеся изотопы находятся в одной фазе, и гетерогенным, если речь идет о перераспределении изотопов между разными фазами.
Рассмотрим некоторые типичные случаи, поясняющие приведенные определения.
1. Гетерогенный обмен с участием одинаковых по химической природе молекул. Пусть не радиоактивный твердый иод находится при определенной температуре в
равновесии со своим насыщенным паром. Сохраняя температуру постоянной, часть
Кафедра радиохимии и
прикладной экологии© |
83 |
|
насыщенных паров заменим парами иода такой же плотности, но содержащими радионуклид 131J. Если через некоторое время отделить пары иода от кристаллов, масса которых за все время опыта оставалась неизменной, то в твердой фазе можно обнаружить атомы 131J, что объясняется изотопным обменом между парами и кристаллами. Реакция изотопного обмена в данном случае связана с динамическим характером равновесия между фазами. Схематически процесс можно представить уравнением
131I (пар) + I2 (кристаллы) = I2 (пар) + 131I (кристаллы)
2. Гетерогенный изотопный обмен с участием различных молекул. Добавим к нерадиоактивному раствору NaI, содержащему суспензию свежеприготовленного осадка РbI2, порцию раствора NaI такой же концентрации, но содержащего радиоактивные атомы 131I. Будем некоторое время при постоянной температуре перемешивать смесь, а затем отделим осадок от раствора. Последующие измерения покажут, что осадок РbI2 содержит 131I , который оказался в нем в результате изотопного обмена иода между осадком и раствором.
Протекание изотопного обмена обусловлено, |
в частности, |
процессами |
спонтанной |
|
перекристаллизации |
свежеприготовленной полидисперсной твердой фазы. |
Уравнение |
||
изотопного обмена следующее: |
|
|
|
|
131I (раствор) + РbI2 (осадок) = РbI131I (осадок) + I- (раствор) |
|
|||
3. Гомогенный |
изотопный обмен в |
водном растворе. Внесем в водный раствор |
||
SrCl2, меченного 89Sr, небольшую порцию нерадиоактивных кристаллов оксалата стронция SrC2О4•Н2О. Раствор далее нагреем до полного растворения кристаллов, а затем охладим и отделим выпавший осадок. Полученные кристалль SrC2О4•Н2О содержат 89Sr, что объясняется электролитической диссоциацией соединений стронция в водном растворе. Соответствующее уравнение изотопного обмена имеет вид
SrCl2+SrC2О4=89SrC204 +SrCI2
4. Изотопный обмен между молекулами с различным изотопным составом. При смешивании тритиевой воды (Т2О) и воды, состоящей только из протия и кислорода (Н2О), процесс изотопного обмена, связанный с диссоциацией воды на положительно заряженный ион водорода и отрицательно заряженный ион гидроксила, приводит к образованию молекул составе НТО:
Н2О + Т2О = 2НТО Реакции изотопного обмена, протекающие между тождественными по химическому
составу и строению молекулами, получили название гомомолекулярных.
5. Внутримолекулярный изотопный обмен. Если приготовить раствор 2,4- дибромтолуола, меченного 82Вг только в положении 2, то через некоторое время в растворе можно обнаружить наличие молекул 2,4-дибоомтолуола, содержащих 82Вг в положении 4:
Кафедра радиохимии и
прикладной экологии© |
84 |
|

Следует подчеркнуть, что во всех рассмотренных случаях реакции изотопного обмена обратимы. Например, если в случае 2 первоначально использовать осадок РbJ2, меченный 131J, и нерадиоактивный раствор NaJ, то в результате изотопного обмена часть 131J перейдет из осадка в водную фазу.
Константа равновесия и тепловой эффект реакций изотопного обмена.
Рассмотрим некоторые особенности реакций изотопного обмена. Обозначим две формы, между которыми протекает изотопный обмен, соответственно через А и В. Можно записать, что
где k1 и k2 — константы скоростей соответствующих реакции, а звездочкой отмечены формы, первоначально содержащие радиоактивный изотоп. Если пренебречь относительными различиями в массах изотопов, участвующих в обмене (которые у большинства элементов, кроме легких, весьма малы), то оказывается, что при процессах изотопного обмена
(3.29)
Из равенства (3.29) вытекает, что для константы равновесия реакции изотопного обмена К всегда справедливо:
(3.30)
Еще одна важная особенность реакций изотопного обмена состоит в следующем. Протекание этих реакций практически никогда (за исключением реакций с участием изотопов легких элементов, например изотопов водорода) не сопровождается выделением или поглощением теплоты, т. е. их тепловой эффект
(3.31)
Тепловой эффект Q обратимой реакции равен разности энергий активации прямой и обратной реакции:
(3.32)
С учетом (4.31) можно сделать вывод, что для реакции изотопного обмена
(3.33)
Кафедра радиохимии и
прикладной экологии© |
85 |
|
3.9.2. Причины протекания изотопного обмена. Равнораспределение изотопов
Как следует из предыдущего параграфа, реакции изотопного обмена не сопровождаются изменением объема и давления системы и протекают с нулевым тепловым эффектом. Для обсуждения причин протекания реакций изотопного обмена можно использовать свободную энергию (изохорно-изотермический потенциал) Гельмгольца,
которая определяется соотношением |
|
F =U — TS. |
(3.34) |
где U — внутренняя энергия; S — энтропия системы; Т — абсолютная температура, К. Процессу, самопроизвольно протекающему при постоянных объеме и температуре, должно отвечать уменьшение F, причем равновесному состоянию соответствует минимум свободной энергии системы. Рассмотрим, с чем связано самопроизвольное протекание
реакции изотопного обмена.
Пусть исходное состояние системы до начала обмена характеризуется
соотношением: F1 = U1—TS1, а конечное, |
соответствующее равновесию, F2 = U2—TS2. |
|
Изменение свободной энергии в результате изотопного обмена равно |
||
F = F2-F1=( U2—TS2)-( U1—TS1), |
(3.35) |
|
причем F < 0, так как процесс идет самопроизвольно. |
||
Практически для всех систем внутренняя энергия U не зависит от распределения |
||
изотопов, вследствие чего |
|
|
U2 = U1 |
(3.36) |
|
Учитывая (3.36), уравнение (3.35) перепишем в виде |
|
|
F = -( TS2-TS1)= T S . |
(3.37) |
|
Так как F < 0, то |
|
|
S =S2-S1>0, |
|
(3.38) |
что соответствует изменению энтропии в ходе процесса. Следовательно, реакции изотопного обмена осуществляются вследствие увеличения энтропии.
Число микросостояний W, посредством которых осуществляется данное макросостояние, связано с энтропией соотношением Больцмана
S =kBlnW, |
(3.39) |
где kB — постоянная Больцмана.
Так как энтропия равновесного состояния выше, чем неравновесного, то, следовательно, при равновесном распределении изотопов в системе размещение изотопов возможно большим числом вариантов (т, е. число микросостояний W больше), чем в
отсутствие равновесия. Можно показать, что равновесному состоянию при реакциях |
||
Кафедра радиохимии и |
86 |
|
прикладной экологии© |
||
|
||
изотопного обмена отвечает так называемое равнораспределение изотопов, т. е. такое состояние, при котором все фазы и все химические формы имеют одинаковый изотопный состав.
Если обозначить через m и n количество атомов, входящих соответственно в состав форм А и В и участвующих в данном обмене, а через m* и n* — количество радиоактивных атомов в этих же формах при равновесии, то для равнораспределения можно записать:
m/ n = m */n* или m* / m = n */ n . (3.40)
Из последнего соотношения следует, что массовые удельные активности участвующих в обмене форм при равнораспределении равны.
3.9.3. Кинетика гомогенного изотопного обмена
Как следует из вышесказанного, любая система, в которой происходит изотопный обмен, в конце концов, должна прийти в состояние равновесия, характеризующееся равнораспределением изотопов. Однако скорость достижения этого состояния различна для разных систем. Рассмотрим основные кинетические особенности реакций изотопного обмена.
Кинетические уравнения, описывающие протекание изотопного обмена, существенно различаются в зависимости от того, идет ли речь о гомогенном или гетерогенном обмене. Ниже приведен вывод кинетического уравнения только для простейшего случая — для так называемого идеального гомогенного изотопного обмена между двумя газообразными соединениями АХ и ВХ. Идеальным изотопный обмен в данном случае называют потому, что считают химические и физические свойства обоих участвующих в обмене изотопов совершенно одинаковыми. Полученные кинетические соотношения можно распространить на случай изотопного обмена двух соединений, находящихся в растворе.
Пусть между соединениями АХ и ВХ, молярные концентрации которых равны а и b соответственно, протекает обмен изотопами элемента X. Для того чтобы проконтролировать кинетику обмена, используем радиоактивный индикатор. Обозначим радиоактивный изотоп элемента X через X*, а стабильный — просто через X.
Для простоты предположим, что убылью X за счет радиоактивного распада в ходе изотопного обмена можно пренебречь, считая число атомов X в системе постоянным, и что первоначально все атомы X входят в состав молекул ВХ. В таком случае схема обмена следующая:
АХ + ВХ* = АХ* + ВХ
Примем, что молярная концентрация (АХ) + (АХ*) равна а, (ВХ) + (ВХ*) равна b, (АХ)
— х и (ВХ) — у. Величины а и b в ходе изотопного обмена остаются постоянными, а х и у
Кафедра радиохимии и
прикладной экологии© |
87 |
|
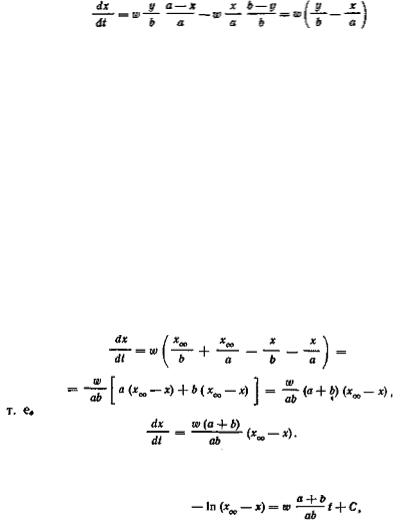
изменяются во времени. Допустим, что в начальный момент времени t = 0 значение х равно 0, т. е. х0 = 0. Скорость реакции изотопного обмена между молекулами АХ и ВХ обозначим через w, моль/л.с. Величина w зависит только от концентраций а и b и постоянна в любой момент времени, а также одинакова для прямой и обратной реакции. На нее не влияет концентрация атомов X в системе (наличие радиоактивных атомов X в случае идеального изотопного обмена вообще не сказывается на скорости реакции).
Составим дифференциальное уравнение, описывающее скорость увеличения (dx/dt) концентрации АХ* в системе. На величину dx/dt влияют два фактора: скорость образования АХ* за счет протекания прямой реакции и скорость разложения АХ* за счет обратной реакции. Скорость образования АХ* равна w(y/b)[(a—х)/а], где у/b — доля реакций с участием активных молекул ВХ* и (а—х)/а — доля реакций с участием неактивных молекул АХ. Аналогично можно записать, что скорость разложения АХ равна w(x/a)[(b—y)/b]. Таким образом, искомое дифференциальное уравнение, связывающее w, х и у, имеет вид
|
(3.41) |
|
Реакция перераспределения изотопов завершается |
при t = , |
когда dx/dt |
становится равным нулю. Концентрации АХ и ВХ при равновесии обозначим соответственно через х и у . Учитывая, что убыли радиоактивных атомов в ходе эксперимента не происходит, можно записать, что
х + у = х + у |
(3.42) |
|
При (dx/dt) = 0 (t = ), получаем из уравнения (3.41) |
. |
|
х /a = у / b |
(3.43) |
|
Из уравнений (3.41) и (3.43) находим |
|
|
у = х |
+ х . b/a - х |
(3.44) |
Подставляя это значение у в уравнение (4.41), получим
(3.45)
После разделения переменных интегрирование уравнения (3.45) дает
|
(3.46) |
|
где С — константа интегрирования. Ее значение найдем, используя начальное |
||
условие: х0 = 0 при t =0. Следовательно, |
|
|
Кафедра радиохимии и |
88 |
|
прикладной экологии© |
||
|
||

С = -ln х |
(3.47) |
Подставляя это значение С в (3.46), находим
(3.48)
(3.49)
Для того чтобы показать, насколько далеко распределение изотопов в системе от равновесного, вводят понятие степени обмена F. Если в общем случае начальная
концентрация АХ х0 не = О и начальная концентрация ВХ у0 |
не = 0, то степень обмена равна |
F = (х - х0)/( х - х0) = (у- у0) (у - у0). |
(3.50) |
В рассматриваемом нами частном, но довольно распространенном случае |
|
первоначально нерадиоактивного соединения АХ (х0 = 0) можно записать, что |
|
F = х / х , |
(3.51) |
т. е. степень обмена равна отношению имеющейся в данный момент времени t концентрации молекул АХ, содержащих радиоактивные атомы X, к концентрации таких же молекул при равнораспределении. Легко видеть, что при t = F = 1.
Концентрацию молекул АХ при равнораспределении можно найти, зная молярную концентрацию соединения ВХ в начальный момент времени (у0). Решая (3.44) относительно
х и учитывая, что х + у = у0, получим |
|
х =а у0/а+b |
(3.52) |
Рис. 3.3 График зависимости -ln(1-F) от t при идеальном гомогенном изотопном обмене
Уравнение (3.49) с учетом (3.51) можно переписать в виде
(3.53)
Уравнение (3.53) показывает, что величина -ln(l-F) линейно зависит от времени обмена t (рис. 3.3). Такой характер зависимости -ln(l-F) от t наблюдается, если в обмене участвуют молекулы, содержащие или по одному обменивающемуся атому, или по
Кафедра радиохимии и
прикладной экологии© |
89 |
|
несколько таких атомов, занимающих в каждой молекуле совершенно эквивалентное положение.
Важной характеристикой кинетики изотопного обмена наряду с w служит период полуобмена t1/2. Периодом полуобмена называют промежуток времени, в течение которого
степень обмена достигает значения 0,5. Значение t 1/2 |
можно найти из уравнения (3.53), |
подставив в него t =t ½ и F = 0,5: |
|
t ½ = (ln2/ w)(a.b/ a +b). |
(3.54) |
Используя уравнение (3.53), уравнение (3.53) можно привести к виду |
|
- ln (1- F)= (ln2/t ½). t. |
(3.55) |
Переходя к десятичным логарифмам, получаем уравнение |
|
- ln (1- F)= (lg2/ t ½). t, |
(3.56) |
которое позволяет графическим путем найти t ½, если по экспериментальным данным построена прямая, отвечающая зависимости -lg(l-F) от t. Отметим, что значения t ½ и w изменяются при изменениях концентраций а и b, т. е. t ½ и w не являются константами. Найденное графическим или расчетным путем значение w (или t ½ используют для определения константы скорости k реакции изотопного обмена. Скорость изотопного обмена w связана с k уравнением
w =k a b , |
(3.57) |
где а и b — молярные концентрации обоих участвующих в обмене соединений; и
— порядки реакции в отношении к каждому из этих соединений. Общий порядок реакции равен сумме показателей степеней + .
Реакциям изотопного обмена соответствует или первый (т. е. либо = 1, = 0, либо = 0, = 1), или, чаще, второй порядок (т. е. = =1). В первом случае скорость изотопного обмена w зависит только от концентрации одного из компонентов смеси (когда концентрация второго компонента столь велика, что ее можно считать неизменной в ходе изотопного
обмена), и выражение (3.57) переходит (при = 0) в |
|
|||
|
|
w1 =k1a, |
(3.58) |
|
где w1 — скорость; k1 — константа скорости реакции первого порядка. Во втором |
||||
случае можно записать |
|
|
|
|
|
wll =kllab, |
(3.59) |
||
где wll — скорость; k11 — константа скорости реакции второго порядка. |
||||
Для определения значений |
|
и изучают изменение w в зависимости от |
||
концентрации одного из компонентов, |
поддерживая концентрацию второго компонента |
|||
(например,b) постоянной. При этом оказывается, что |
|
|||
Кафедра радиохимии и |
w1 =k a1 b |
и |
w2 =k a2 b . |
(3.60) |
прикладной экологии© |
|
|
90 |
|
|
|
|
|
|
