
ОЯФРиД
.pdfМолекулярный водород в большинстве случаев не взаимодействует с растворенными веществами, однако, может прореагировать с радикалов OH: H2 +OH → H +H2O. Эта реакция имеет достаточно высокое значение константы скорости (4,92·107 дм3/моль·с) и играет важную роль в радиолизе чистой воды. O2 – в продуктах радиолиза появляется не сразу – в первичных и трековых продуктах его не находят. Появление O2 в продуктах радиолиза связывают с появлением гидроперекисного радикала HO2, который образуется в системах, имеющих высокие значения ЛПЕ. Это следующие реакции:
2 2 2 2 2 ,
HO2 O-2 H2O H2O2 O2 OH-aq и частично
2 2 2 .
Образовавшийся кислород начинает заметно влиять на общую кинетику процесса, участвуя в реакциях:
O2 eaq O2 ;O2 H HO2 ;O2 O O3
Перекись водорода (H2O2) в первичных продуктах не встречается, она появляется в начале трековой (или второй, или физико-химической) стадии – во всяком случае наиболее вероятной реакцией ее появления в системе считается реакция (15): OH + OH → H2O2, а затем уже идут:
2 |
2 2 |
eaq |
|
|
- |
2 2 22 2 2 2 2
Перекись водорода может проявлять (в зависимости от pH и растворенного вещества)
как восстановительные, так и окислительные свойства. |
|
|
|
|
|
|||
|
В щелочной среде перекись водорода легко образует гидропероксид-ион: |
|
||||||
H2O2 |
HO2 Haq- , а дальше HO2 HO2 eaq- |
и общий процесс выглядит так: |
|
|||||
|
Mn H2O2 M(n 1) Haq- HO2 , |
а |
освободившийся радикал |
HO2 |
||||
восстанавливает еще один ионMn : Mn HO2 |
M(n 1) |
Haq- O2 . Известно, что в |
||||||
сильнощелочной |
среде перекись водорода диссоциирует |
до |
образования иона |
O22- : |
||||
H2O2 |
2OH2 |
2H2O22 , а образовавшийся |
пероксид |
ион |
восстанавливает два |
иона |
||
Mn : |
|
|
|
|
|
|
|
|
|
|
2Mn O22- 2M(n 1) |
O2 . |
|
|
|||
Кафедра радиохимии и
прикладной экологии© |
51 |
|
В кислой среде перекись выступает как окислитель, а процесс идет через образование радикала OH:
Mn H2O2 M(n 1) H-aq OH.
Перекись водорода быстро реагирует с радиальными продуктами радиолиза. В связи с этим интересно отметить, что экспериментально обнаруженная разница в три порядка для констант скорости взаимодействия перекиси с радикалом H и с радикалом e-aq явилось веским подтверждением существования e-aq.
Свободные радикалы.
Это – самая активная в химическом отношении группа продуктов радиолиза воды и
зачастую именно она определяет итоги всего процесса. |
|
||
Радикал |
H. |
Легко отдает электрон, проявляя свойства |
восстановления: |
H H eaq- |
- это |
свойство является доминирующим, усиливаясь с ростом pH. Однако в |
|
кислой среде этот процесс (образование H+) интенсивно не пойдет, зато легко образуется |
|||
молекулярный |
ион: |
H H H2 , который затем действует |
как окислитель: |
H2 e- H2 .
Радикал OH. В подавляющем большинстве случаев радикал OH проявляет свойства сильного окислителя (единственное исключение – ион n 4 , с которым радикал OH взаимодействует как окислитель). Основная реакция: e- + OH→OH-. Она может реализоваться как простое окисление или отщепление H от кислых анионов и водородсодержащих веществ. Например: Fe2+ + OH → Fe3+ + OH- или NH3 + OH → NH2 +
H2O. В щелочной среде радикал OH может дать ион радикал O- меньше, чем |
у OH, кроме |
|||||||
двух исключений: образование озонид-иона |
|
2 |
|
и реакция |
с перекисью |
|||
|
3 |
|||||||
водорода; точнее, с гидроперекисным ион-радикалом: |
|
|
|
|
|
|
||
|
2 |
|
2 . |
|||||
Гидроперекисный радикал HO2.
Этот радикал, образующийся главным образом в системах с высокими значениями ЛПЕ, как и его щелочная форма – ион-радикал O-2 играют важную роль в радиолизе воды и водных растворах, особенно содержащих кислород, где они возникают по реакциям:
eaq- 2 2 и 2 2 . |
Для HO2 характерны реакции: HO2 H -2 и |
HO2 H H2O2 . |
|
Кафедра радиохимии и
прикладной экологии© |
52 |
|
HO2 |
проявляет |
как |
окислительные, |
так и восстановительные свойства, однако, |
|||
окислительная |
способность |
у |
него |
ярче, а для O-2 более |
характерны |
||
восстановительные свойства.
Гидратированный электрон – e-aq.
Это – один из самых важных и интересных продуктов радиолиза. Он настолько необычен, что в классификации продуктов радиолиза ему иногда отводится специальная рубрика. Действительно, все продукты радиолиза укладываются в причинные и известные структуры: атомы, молекулы, ионы, радикалы и ион-радикалы. А здесь «нечто» другое. Это «нечто» вело себя как хорошо известный радикал H, но отличалось от него более ярко выраженными восстановительными свойствами. Было даже введено представление о неких двух «разновидностях» радикала H, но оказалось, что все проще и сложнее.
Проще потому, что был точно определен источник этого необычного восстановительного эффекта – им оказался термализованный электрон – из вторичных δ- электронов, который после практических полной потери энергии (что собственно и означает термин «термализация») продолжает свое существование в форме своеобразного акваиона, являясь центром поляризации нескольких (чаще всего – четырех) молекул воды, Близкая к такой структуре давно известна физике твердого тела под названием полярона. Сложность же состоит в том, что далеко не все закономерности, связанные с образованием и «жизнью» поляронов можно перенести на ситуацию в растворах.
Во всяком случае, достоверно установлено, что для гидратированного электрона характерно присоединение к ионам (простое восстановление), присоединение к нейтральным молекулам и диссоциативное присоединение.
Для водных растворов все это выглядит достаточно просто. В сильнокислой и кислой средах интенсивно и с большой скоростью идет реакция образования радикала H:
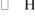 (равновесие, естественно, в кислой среде сдвинуто вправо). Образовавшийся радикал H (хотя в данном случае его происхождение радиационно-химическое только отчасти) действует так же, как об этом сказано в разделе, посвященном радикалу H.
(равновесие, естественно, в кислой среде сдвинуто вправо). Образовавшийся радикал H (хотя в данном случае его происхождение радиационно-химическое только отчасти) действует так же, как об этом сказано в разделе, посвященном радикалу H.
С ростом pH образование H-радикала идет менее интенсивно; при переходе к щелочной среде атом H может «вернуть» гидратированный электрон:
|
eaq |
2 |
|
Гидратированный электрон может взаимодействовать с водой (медленно): |
|
eaq |
2 H - ; с перекисью водорода: eaq |
2 2 H - ; с радикалом |
Кафедра радиохимии и
прикладной экологии© |
53 |
|
OH: e-aq H- . В то же время e-aq практически не взаимодействует с катионами
щелочных металлов, слабо – с катионами щелочноземельных металлов, с многозарядными катионами взаимодействие выражено ярче.
2.3. Радиолиз разбавленных водных растворов
Качественно эволюцию водного раствора под действием ионизирующего излучения с учетом всего вышеизложенного можно представить как систему, подвергающуюся внешнему (или внутреннему – при авторадиолизе) воздействию. Характер воздействия известен, если известна природа ионизирующего излучения и его мощность дозы – это определяет количественные параметры (сколько и чего поступает в систему в единицу времени). Результат тоже известен в части образовавшихся агентов, т.к. излучение при малой концентрации растворенного вещества будет взаимодействовать только с водой, а продукты ее радиолиза – между собой (как уже было изложено), так и с растворенным веществом (или веществами – если солевой состав сложный). Значит резко изменится третья стадия радиолиза – ее гомогенная часть будет включать большее (чем в воде) число конкурирующих реакций, что приведет к новому конечному результату. Этот результат может быть описан в рамках химической кинетики весьма сложных систем, в которых одновременно идут конкурирующие параллельные реакции, чаще всего второго порядка, иногда перемежающиеся последовательными мономолекулярными реакциями, возникают и развиваются новые взаимодействия между первичными продуктами и промежуточными продуктами (форма разветвляющихся реакций). Для описания таких систем надо иметь хорошее представление о возможных механизмах процессов в растворе и достоверные данные о константах скоростей соответствующих реакций. (Кстати, таких констант накоплено уже многие тысячи, и это далеко не конец, а только начало работы).
Все сказанное можно формализовать в виде нескольких обязательных положений:
1.Радиолитические превращения растворенных веществ происходят исключительно в результате взаимодействия их с продуктами радиолиза воды (имеет место т.н. косвенный эффект).
2.Скорость образования продуктов радиолиза может быть выражена через их первичные выходы.
3.Растворенные вещества, способные реагировать с радикалом (или вообще с продуктов радиолиза) конкурируют друг с другом.
Кафедра радиохимии и
прикладной экологии© |
54 |
|
4. Выход молекулярных продуктов радиолиза воды G(H2O2); G(H2); G(O2) в присутствии веществ, способных к окислению или восстановлению (акцепторов) падает с
|
|
|
|
|
|
|
|
|
|
|
1 |
|
ростом |
концентрации |
|
акцептора – |
CS, т.к. падает GR: GR |
GoR ACS3 , где |
А – |
||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
вероятностный фактор, CS3 – «линейная концентрация»акцептора. |
|
|
||||||||||
5. Различные растворенные вещества уменьшают выход (при равных концентрациях) |
||||||||||||
в соответствии |
с |
|
константами |
скорости процесса |
RS |
т.е. |
||||||
|
R S RS, |
|||||||||||
|
Go |
|
Go |
|
|
KRS |
|
|
|
|||
( |
R |
) |
:( |
R |
) |
|
1 |
. |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
GR |
S 1 |
GR |
S2 |
|
KRS2 |
|
|
|
|||
6. С ростом концентрации растворенного вещества выходы молекулярных продуктов
1
радиолиза воды могут упасть до нуля при GoR ACS3 , т.к. уж если здесь GR → 0, то G(R2) и подавно.
Чтобы у этих достаточно важных, но общих рассуждений лучше понять сущность процесса, обычно рассматривают какую-либо из простых, но хорошо изученных систем. К числу таких систем относится радиолиз ферросульфатного раствора, который очень широко используется для целей химической дозиметрии. По имени своего создателя ферросульфатный дозиметр называется дозиметром Фрикке. Исходная система: раствор ~ 10- 3М FeSO4; 0,4M H2SO4, насыщенный кислородом. Для этой системы известно, что под действие излучения с невысокой величиной ЛПЕ идет окисление железа: Fe2+→ Fе3+. Известно также, что основными продуктами радиолиза являются e-aq; H; OH; H2; H2O2, для
которых трековые выходы составляют: G(eaq- ) |
3,2; G(OH) = |
2,9; G(H) = 0,5; |
G(H2 ) |
0,4; |
|||||
G(H2O2 ) |
0,8. Проверка |
этих |
данных |
балансом |
радиолиза |
воды |
дает: |
||
G(-H2O) |
3,2 0,5 2 0,4 2,9 2 0,8 4,5. Попытаемся теперь определить G(Fe3+), |
||||||||
исходя из основных реакций, связанных с окислением железа: |
|
|
|
||||||
В кислой среде интенсивно идет реакция: |
|
|
|
||||||
|
e-aq +H3O+ → H +H2O |
(1) |
|
|
|
|
|
||
Образовавшийся радикал H взаимодействует с растворенным в воде кислородом с |
|||||||||
образованием гидроперекисного радикала: |
|
|
|
|
|||||
H +O2 → HO2 |
(2) |
и сразу |
|
|
|
||||
|
Fe2 |
HO2 |
Fe3 |
HO-2 |
(3). |
|
|
|
|
Далее |
HO-2 |
H H2O2 |
(4). |
|
|
|
|
||
Кафедра радиохимии и
прикладной экологии© |
55 |
|
Снова окисление: Fe2+ +H2O2→ Fe3+ +OH +OH- (5).
Далее идет никому не мешающая реакция OH- + H+ → H2O, а радикал OH дополнительно окисляет Fe2+: OH + Fe2+→ Fe3 +OH- через реакцию (3), а второй и третий раз
– через реакции (4), (5) и (6) – все это за счет исходных e-aq и H. Кроме того, первично образованная H2O2 по реакциям (5) и (6) добавляет свой выход. Окончательно получаем:
G(Fe3 ) 3G(e-aq ) 3G(H) 2GH2O2 G(OH) 3 3,2 3 0,5 2 0,8 2,9 15,6
окисленных ионов Fe2+ на 100 эВ поглощенной энергии.
Заметим, что, если в систему не вводить кислород, не будет образования радикала HO2, не будет за этот счет дополнительного окисления, и G(Fe3+) упадет до 8,2. G(Fe3+) не зависит от энергии рентгеновского, γ-излучения и быстрых электронов в диапазоне от 0,66 до 16 МэВ, что объясняется близостью значений ЛПЕ.
В целом зависимость CFe3 от дозы (D) выражается прямой до величин D ~ 10
кГр (рис. 2.3), далее начинает сказываться процесс восстановления Fe3+ по реакции H + Fe3 → H+ + Fe2+, которая становится заметной по потере ~ 40% от исходной концентрации Fe2+. Начало кривой зависит от чувствительности метода определения Fe3+ (может быть, до
0,05 Гр).
CFe |
|
|
|
с О2 |
|
|
без О2 |
|
~0,05Гр |
~ кГр |
D |
|
Рис. 2.3. Зависимость CFe3 |
от D (Гр) |
Если в дозиметре Фрикке используется инициирование процесса окисления (Fe2+ → |
||
Fe3+), то в цериевой дозиметрической системе реализуется процесс восстановления Ce4+ до |
||
Ce3+. В качестве исходного брали сернокислый (0,4 М) водный раствор Ce4+ (10-4÷10-2 М), |
||
насыщенный воздухом. В таком растворе под действием ионизирующих излучений Ce4+ |
||
восстанавливается до Ce3+. Действие излучения будет косвенным, радиационно-химические |
||
Кафедра радиохимии и
прикладной экологии© |
56 |
|
выходы для воды серьезных изменений не должны претерпевать. Если это так, то, принимая во внимание процессы восстановления Ce4+, можно написать следующие реакции:
Ce4+ + H → Ce3+ + H+ |
|
|
|
|
|
|
|
|
|
|
||
Ce4+ |
+ e-aq→ Ce3+ |
|
|
|
|
|
|
|
|
|
|
|
Ce4+ |
+ H2O2 → Ce3+ + H+ + HO2, |
|
|
азатем |
|
|
|
|
||||
Ce4+ |
|
+HO2 →Ce3+ +H+ +O2 |
|
|
|
|
|
|
|
|
|
|
Имеющиеся радикалы OH будут окислять Ce3+: |
Ce3 |
Ce4 . |
||||||||||
Тогда |
G(Ce3 ) G |
(H) |
G |
- |
2G |
(H2O2 ) |
G |
(OH) |
. |
|
||
|
|
|
|
|
(eaq ) |
|
|
|
|
|||
Если принять G(H) 0,5; G(eaq- ) |
3,2; G(H2O2 ) |
0,8 и |
|
G(OH) 2,9, |
||||||||
G(Ce3+) = 0,5 + 3,2 + 2·0,8 – 2,9 = 2,4 иона Ce3+/100 эВ
Эта же величина получается в прямых экспериментах: она лежит в пределах 2,3÷2,5 ионов/100 эв. Из этих данных следует несколько важных выводов:
1.Сравнительно простой химизм предполагаемого процесса дает близкие к экспериментуданные.
2.«Работа» радикала OH резко снижает выход G(Ce3+) (по сравнению с дозиметром Фрикке, близким по исходному солесодержанию).
3.Роль радикала HO2 здесь важна, но это «свой» радикал (из H2O2), но раз есть воздух, то будет обязательно образовываться и «дополнительный» HO2, хотя в балансе OH не учитывается и, похоже, не очень значительно влияет на выход Ce3+.
4.При малых дозах G(Ce3+) может быть выше указанного, потому что малость концентрации Ce3+ в начале процесса не дает возможности радикалу OH реализовать свой высокий выход.
5.Сравнительно низкая величина G(Ce3+) позволяет предположить, что такой дозиметр сможет работать в диапазоне больших доз, чем дозиметр Фрикке. Это предположение подтвердилось – дозиметр в некоторых случаях может измерять дозы до 106 Гр. Нижний предел применения цериевой системы целиком зависит от совершенствования определения малых количеств Ce3+ в смеси со значительными количествами Ce4+.
Кафедра радиохимии и
прикладной экологии© |
57 |
|
2.4. Кинетика радиационно-химических реакций
Кинетика радиационно-химических реакций, на наш взгляд, достаточно сложна и во многих случаях не имеет прямых аналогий среди обычных химических реакций. Во-первых, инициирующие продукты – это результат трековых реакций, которые непрерывно генерируют эти продукты. Изменение мощности дозы не будет линейно связано с реальной концентрацией трековых продуктов в растворе. Дело в том, что с увеличением мощности дозы, особенно для излучений с высокой величиной ЛПЕ будет меняться характер взаимодействия первичных частиц, и частиц, реагирующих в треках. Все это приведет к тому, что с ростом мощности дозы уменьшится (относительно) доля радикалов и увеличится доля молекулярных продуктов, поступающих в раствор. Уже одно это обстоятельство может серьезно изменить ход всего процесса радиолиза. В значительной мере именно поэтому очень большое число экспериментальных работ в этой области посвящено нахождению зависимости констант скорости процесса от мощности дозы. Величина дозы тоже не означает просто интегральное воздействие, результат которого очевиден, если известна мощность дозы и время облучения. С ростом дозы (при постоянной мощности) постоянной остается только скорость поставки первичных продуктов (R1 и R2). Все остальные параметры меняются. Среди них будет концентрация реагирующего материала (только падает), концентрации акцепторов (могут меняться в обе стороны), появляется возможность усиления обратных реакций. Учитывая, что в составе продуктов радиолиза уже в самом начале имеются сильные восстановители и окислители, это гарантирует снижение радиационнохимических выходов (по-разному на разных участках дозы). Поскольку доля реакционноспособных частиц, реагирующая с данным реагентом, равна произведению константы скорости данной реакции на концентрацию реагента, деленному на сумму и произведений констант скоростей и концентраций реагентов для всех других реакций, в которые вступает частица (а многие из этих параметров, как мы говорили, меняются во времени). Все это приводит к весьма сложным моделям и не менее сложным расчетам, не всегда дающим должное совпадение с экспериментальными данными. Иногда встречаются системы, точное количественное описание которых до сих пор не удается сделать. Это замечание относится к описанию эволюции ядерного топлива в процессе его работы в активной зоне гетерогенного реактора и в начале его химической переработки.
Кинетика накопления продуктов деления (ПД) в работающем ядерном реакторе и их распада при последующей выдержке (охлаждении) ядерного топлива представляет собой описание весьма сложной системы из ~ 500 радионуклидов, объединенных в ~ 100
Кафедра радиохимии и
прикладной экологии© |
58 |
|
линейных цепочек β-активных ПД, связанных между собой поперечными связями из реакций радиационного захвата (n, γ) и процессов испускания запаздывающих нейтронов.
Такое описание имеет в своей основе хорошо известную кинетику последовательных реакций первого порядка, осложненных указанными выше поперечными связями как с более «легкими», так и с более «тяжелыми» цепочками. Хотя число констант, которые управляют этой системой, составляет несколько сотен (это константы радиоактивного распада (λ, с-1), независимые и кумулятивные выходы продуктов деления, сечения захвата тепловых нейтронов, сечения деления для тяжелых продуктов, образующихся в активной зоне, коэффициенты ветвления) – все они практически не зависят ни от мощности реактора, ни от времени его работы, поэтому результаты легко табулируются.
Гораздо сложнее радиационная оценка состояния активной зоны. Здесь мы имеем очень сложную композицию из внутреннего и внешнего облучения, представленную огромным числом источников с участием практически всех типов излучения. Если учесть, что фактор времени здесь так же важен, как и при описании кинетики, да еще сюда добавятся факторы, связанные с геометрией установки, станет ясно, что надежная оценка хотя бы таких показателей, как мощность дозы в наиболее важных узлах установки и плотность потока нейтронов – это уже достаточно для оценки ситуации в целом. (Подробнее об этом см. раздел радиационной химии твердого тела).
Охлаждение (выдержка) ТВЭЛов – относительно спокойный этап, который можно контролировать, т.к. здесь расчетам поддаются многие параметры, управляющие ходом спада активности.
И, наконец, самое, пожалуй, сложное и труднодоступное для количественного описания состояния системы с точки зрения развития радиационно-химических процессов начинается с момента растворения ТВЭЛов, (если дело не ограничивается простым хранением отработанного ядерного топлива – ОЯТ).
Здесь мы сталкиваемся с авторадиолизом сложного высоко солевого раствора в очень кислой среде (HNO3). Источник излучения – смешанный, с непрерывно меняющимся изотопным составом, высокой удельной активностью α и β-излучателей с сопутствующим γ- излучением, а также тормозным и характеристическим.
ЛПЕ для такой системы будет охватывать широкий диапазон величин, а высокая мощность дозы обеспечит междутрековое взаимодействие в сочетании теперь уже не только с косвенным, но и прямым действием излучения. Естественно, что за системами такой сложности проще наблюдать и давать прогнозные оценки на основе ранее наблюдаемых на опыте фактов, чем давать теоретическую оценку.
Кафедра радиохимии и
прикладной экологии© |
59 |
|

В тех случаях, когда имеют дело с простыми системами, кинетика позволяет надежно прогнозировать конечные результаты. Вот несколько простых примеров такого рода:
1.Объект A подвергается действию излучения с образованием продукта X. Продукт X
вдостаточно широком диапазоне доз не взаимодействует с компонентами раствора. Схема
такого процесса |
, , |
Если нас |
интересует изменение |
||
предельно проста: . |
|||||
концентрации Cx |
как функция времени, то, очевидно |
dCx |
aJ, |
где J – мощность дозы, |
|
dt |
|||||
|
|
|
|
||
aGo(x) и тогда Cx =aJt =aD, где D – доза.
Вкоординатах Cx – t(D) это будет прямая, идущая из начала координат. Естественно, рост D здесь не бесконечен. Рано или поздно нагнутся либо обратимые реакции, либо убыль X в результате какого-нибудь химического процесса. Тем не менее системы такого рода используются в качестве химических дозиметров, например, в случае разобранных выше дозиметров Фрикке иди цериевого дозиметра (рис.2.4.).
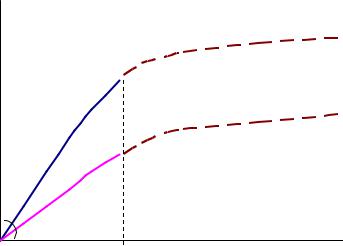
2. Исходный материал A в результате действия излучения дает продукт B, который в результате химической реакции дает интересующий нас продукт X. Схема:, , VX 1C . В этом случае, если продукт X, как и первом случае, только накапливается, общий итог будет таким же, как и в случае 1, с той разницей, что накопление X с постоянной скоростью начнется только тогда, когда сравняются скорости образования и расходования B, т.е. VB =VX. Эта ситуация дается на рис. 2.5.
Cx |
Fe3+ |
Ce3+ |
t(D) |
Рис. 2.4. Кинетические кривые процесса В качестве дозиметра эту систему можно использовать на линейном участке
зависимости (либо отсекая начальный участок, либо вводя для малых доз нелинейную шкалу показаний дозиметра). Естественно, остаются в силе ограничения для больших величин
дозы.
Кафедра радиохимии и
прикладной экологии© |
60 |
|
