
2_1-2_136
.doc
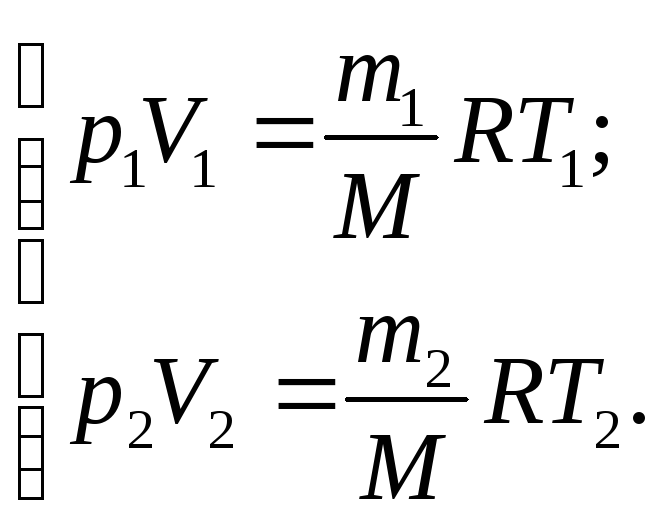 (3)
(3)
Використаємо умову задачі (![]() )
тоді система (1) прийме вигляд з якого
можна визначити
)
тоді система (1) прийме вигляд з якого
можна визначити
![]()

 (4)
(4)
Підставляємо отримані відношення з (4) у рівняння системи (2)
 (5)
(5)
Отримані парціальні тиски з системи (5) в формулу (1) і отримаємо вираз для розрахунку:
![]() = (6)
= (6)
Підставляємо дані умови в рівняння (6) і отримаємо відповідь:
![]() =
=
-
Обчислити густину азоту, що знаходиться в балоні під тиском
 =
2 МПа і що має температуру Т
= 400 К.
=
2 МПа і що має температуру Т
= 400 К.
2.11.
Дано
Т
= 400 К
![]() =
2 МПа
=
2 МПа![]() = 28 г/моль
= 28 г/моль
![]() = ?
= ?
Для розв’язку згадаємо рівняння Клапейрона, в якому В - це газова стала, що має різні значення для різних газів.
![]() = const.
(1)
= const.
(1)
Це ж рівняння для одного молю газу має вигляд:
![]() ;
(2)
;
(2)
Об’єм довільної маси газу дорівнює:
![]() .
(3)
.
(3)
Рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона) записують так
![]() , (4)
, (4)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала.
= 8,31 Дж/(моль•К) — універсальна газова
стала.
Поділимо
рівняння на об’єм газу, отримаємо справа
густину газу
![]() і розв’яжемо це рівняння відносно
шуканої величини:
і розв’яжемо це рівняння відносно
шуканої величини:
![]() = (5)
= (5)
Підставляємо дані умови в рівняння (5) і отримаємо відповідь:
![]() =
=
-
Визначити молярну масу газу, якщо при температурі Т = 154 К і тиску
 =
2,8 МПа він має густину
=
2,8 МПа він має густину
 = 6,1 кг/м3.
= 6,1 кг/м3.
2.12.
Дано
Т
= 154 К
![]() =
2,8 МПа
=
2,8 МПа
![]() = ?
= ?
Для розв’язку згадаємо рівняння Клапейрона, в якому В - це газова стала, що має різні значення для різних газів.
![]() = const.
(1)
= const.
(1)
Це ж рівняння для одного молю газу має вигляд:
![]() ;
(2)
;
(2)
Об’єм довільної маси газу дорівнює:
![]() .
(3)
.
(3)
Рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона) записують так
![]() , (4)
, (4)
де
![]() = 8,31 Дж/(моль∙К) — універсальна газова
стала.
= 8,31 Дж/(моль∙К) — універсальна газова
стала.
Розв’яжемо це рівняння відносно шуканої величини:
![]() = (5)
= (5)
Підставляємо дані умови в рівняння (5) і отримаємо відповідь:
![]() =
=
-
Знайти густину азоту при температурі Т = 400 К і тиску
 =
2 МПа.
=
2 МПа.
2.13.
Дано
Т
= 400 К
![]() =
2 МПа
=
2 МПа![]() = 28 г/моль
= 28 г/моль
![]() = ?
= ?
Для розв’язку згадаємо рівняння Клапейрона, в якому В - це газова стала, що має різні значення для різних газів.
![]() = const.
(1)
= const.
(1)
Це ж рівняння для одного молю газу має вигляд:
![]() ;
(2)
;
(2)
Об’єм довільної маси газу дорівнює:
![]() .
(3)
.
(3)
Рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона) записують так
![]() , (4)
, (4)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала.
= 8,31 Дж/(моль•К) — універсальна газова
стала.
Поділимо
рівняння на об’єм газу, отримаємо справа
густину газу
![]() і розв’яжемо це рівняння відносно
шуканої величини:
і розв’яжемо це рівняння відносно
шуканої величини:
![]() = (5)
= (5)
Підставляємо дані умови в рівняння (5) і отримаємо відповідь:
![]() =
=
-
У посудині місткістю V = 40 л знаходиться кисень при температурі Т = 300 К. Коли частину газу ізотермічно витратили, тиск в балоні знизився на
 =100 кПа. Визначити масу витраченого
кисню.
=100 кПа. Визначити масу витраченого
кисню.
2.14.
Дано
![]() = 40
л
= 40
л![]() =100
кПа
=100
кПа![]() =
300 К
=
300 К![]() = 32 г/моль
= 32 г/моль
![]() = ?
= ?
Запишемо рівняння Менделєєва-Клапейрона для двох станів газу:
 (1)
(1)
Використаємо умову задачі тоді система (1) прийме вигляд
 (2)
(2)
Віднімаємо від першого рівняння системи (2) друге і отримаємо:
![]() . (3)
. (3)
З рівняння (3) визначаємо масу витраченого кисню:
![]() . (4)
. (4)
Підставляємо дані умови в рівняння (4) і отримаємо відповідь:
![]() =
=
-
Визначити густину водяної пари, що знаходиться під тиском
 =
2,5 кПа
і
має температуру Т
= 250 К.
=
2,5 кПа
і
має температуру Т
= 250 К.
2.15.
Дано
Т
= 250 К
![]() =
2,5 кПа
=
2,5 кПа![]() = 18 г/моль
= 18 г/моль
![]() = ?
= ?
Для розв’язку згадаємо рівняння Клапейрона, в якому В - це газова стала, що має різні значення для різних газів.
![]() = const.
(1)
= const.
(1)
Це ж рівняння для одного молю газу має вигляд:
![]() ;
(2)
;
(2)
Об’єм довільної маси газу дорівнює:
![]() .
(3)
.
(3)
Рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона) записують так
![]() , (4)
, (4)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала.
= 8,31 Дж/(моль•К) — універсальна газова
стала.
Поділимо
рівняння на об’єм газу, отримаємо справа
густину газу
![]() і розв’яжемо це рівняння відносно
шуканої величини:
і розв’яжемо це рівняння відносно
шуканої величини:
![]() = (5)
= (5)
Підставляємо дані умови в рівняння (5) і отримаємо відповідь:
![]() =
=
-
Визначити внутрішню енергію U водню, а також середню кінетичну енергію молекули цього газу при температурі Т = 300 К, якщо кількість речовини цього газу дорівнює
 = 0,5
моль.
= 0,5
моль.
2.16.
Дано
Т
= 300 К
![]() = 0,5 моль
= 0,5 моль![]() = 2 г/моль
= 2 г/моль![]() = 5
= 5
![]() = ?
= ?
![]() = ?
= ?
Енергія
теплового руху молекул (внутрішня
енергія деякої системи, що складається
з
![]() молекул ідеального газу (
молекул ідеального газу (![]() = 6,02∙1023 моль-1 – число
Авогадро)), тобто
одного молю газу, з урахуванням виразу
для середньої кінетичної енергія
молекули:
= 6,02∙1023 моль-1 – число
Авогадро)), тобто
одного молю газу, з урахуванням виразу
для середньої кінетичної енергія
молекули:
![]() ,
(1)
,
(1)
де і
- сумарна кількість ступенів свободи
молекули;
![]() = 1,38∙10-23 Дж/К - стала Больцмана;
буде дорівнювати:
= 1,38∙10-23 Дж/К - стала Больцмана;
буде дорівнювати:
![]() ,
(2)
,
(2)
де
![]() = 8,31 Дж/(моль∙К) – універсальна газова
стала.
= 8,31 Дж/(моль∙К) – універсальна газова
стала.
Для загальної кількості молекул N термодинамічної системи через сталу Авогадро та кількість молів цього газу N = NA, вираз (2) записується у наступному вигляді:
![]() .
(3)
.
(3)
Підставляємо дані умови в рівняння (3) та (1) і отримаємо відповідь:
![]() =
=
![]() =
=
-
Визначити сумарну кінетичну енергію Ек поступального руху всіх молекул газу, що знаходяться в посудині місткістю V = 3 л під тиском
 =
540 кПа.
=
540 кПа.
2.17.
Дано
V
= 3 л
![]() =
540 кПа
=
540 кПа![]() = 3
= 3
![]() = ?
= ?
Сумарна
кінетична енергія поступального руху
молекул, що складається з
![]() молекул ідеального газу (
молекул ідеального газу (![]() = 6,02∙1023 моль-1 – число
Авогадро)), тобто
одного молю газу, з урахуванням виразу
для середньої кінетичної енергія
молекули:
= 6,02∙1023 моль-1 – число
Авогадро)), тобто
одного молю газу, з урахуванням виразу
для середньої кінетичної енергія
молекули:
![]() ,
(1)
,
(1)
де і
- сумарна кількість ступенів свободи
поступального руху молекули;
![]() = 1,38∙10-23 Дж/К - стала Больцмана;
буде дорівнювати:
= 1,38∙10-23 Дж/К - стала Больцмана;
буде дорівнювати:
![]() ,
(2)
,
(2)
де
![]() = 8,31 Дж/(моль∙К) – універсальна газова
стала.
= 8,31 Дж/(моль∙К) – універсальна газова
стала.
Для загальної кількості молекул N термодинамічної системи через сталу Авогадро та кількість молів цього газу N = NA, і з урахуванням рівняння Менделєєва - Клапейрона, вираз (2) записується у наступному вигляді:
![]() .
(3)
.
(3)
Підставляємо дані умови в рівняння (3) і отримаємо відповідь:
![]() =
=
-
Кількість речовини гелію = 1,5 моль, температура Т = 120 К. Визначити сумарну кінетичну енергію
 поступального руху всіх молекул цього
газу.
поступального руху всіх молекул цього
газу.
2.18.
Дано
Т
= 120 К
![]() = 1,5 моль
= 1,5 моль![]() = 3
= 3
![]() = ?
= ?
Сумарна
кінетична енергія поступального руху
молекул, що складається з
![]() молекул ідеального газу (
молекул ідеального газу (![]() = 6,02∙1023 моль-1 – число
Авогадро)), тобто
одного молю газу, з урахуванням виразу
для середньої кінетичної енергія
молекули:
= 6,02∙1023 моль-1 – число
Авогадро)), тобто
одного молю газу, з урахуванням виразу
для середньої кінетичної енергія
молекули:
![]() ,
(1)
,
(1)
де і
- сумарна кількість ступенів свободи
поступального
руху молекули;
![]() = 1,38∙10-23 Дж/К - стала Больцмана;
буде дорівнювати:
= 1,38∙10-23 Дж/К - стала Больцмана;
буде дорівнювати:
![]() ,
(2)
,
(2)
де
![]() = 8,31 Дж/(моль∙К) – універсальна газова
стала.
= 8,31 Дж/(моль∙К) – універсальна газова
стала.
Для загальної кількості молекул N термодинамічної системи через сталу Авогадро та кількість молів цього газу N = NA, і з урахуванням рівняння Менделєєва - Клапейрона, вираз (2) записується у наступному вигляді:
![]() .
(3)
.
(3)
Підставляємо дані умови в рівняння (3) і отримаємо відповідь:
![]() =
=
-
Молярна внутрішня енергія Um деякого двоатомного газу дорівнює 6,02 кДж/моль. Визначити середню кінетичну енергію обертального руху однієї молекули цього газу. Газ вважати ідеальним.
2.19.
Дано
Um
= 6,02
кДж/моль
![]() = 5
= 5![]() = 2
= 2
![]() = ?
= ?
Енергія
теплового руху молекул (внутрішня
енергія деякої системи, що складається
з
![]() молекул ідеального газу (
молекул ідеального газу (![]() = 6,02∙1023 моль-1 – число
Авогадро)), тобто
одного молю газу, з урахуванням виразу
для середньої кінетичної енергія
молекули:
= 6,02∙1023 моль-1 – число
Авогадро)), тобто
одного молю газу, з урахуванням виразу
для середньої кінетичної енергія
молекули:
![]() ,
(1)
,
(1)
де і
- сумарна кількість ступенів свободи
молекули;
![]() = 1,38∙10-23 Дж/К - стала Больцмана;
буде дорівнювати:
= 1,38∙10-23 Дж/К - стала Больцмана;
буде дорівнювати:
![]() ,
(2)
,
(2)
Середньої кінетичної енергія обертального руху однієї молекули дорівнює
![]() ,
(3)
,
(3)
З рівнянь (2) і (3) отримаємо вираз для розрахунку шуканої величини:
![]() ,
(4)
,
(4)
Підставляємо дані умови в рівняння (4) і отримаємо відповідь:
![]() =
=
-
Визначити середню квадратичну швидкість
 молекули газу,
взятого в посудину
місткістю V
= 2 л під тиском
молекули газу,
взятого в посудину
місткістю V
= 2 л під тиском
 =
200 кПа. Маса газу m
= 0,3 г.
=
200 кПа. Маса газу m
= 0,3 г.
2.20.
Дано
V
= 2 л m
= 0,3 г
![]() =
200 кПа
=
200 кПа
![]() = ?
= ?
Середня квадратична швидкості молекул дорівнює
![]() .
(1)
.
(1)
Використовуємо
рівняння стану ідеального газу (рівняння
Менделєєва — Клапейрона) для визначення
добутку
![]() :
:
![]() , (2)
, (2)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала.
= 8,31 Дж/(моль•К) — універсальна газова
стала.
Зробимо заміну в формулі (1) на отриманий добуток з (2) і отримаємо вираз для розрахунку:
![]() = (3)
= (3)
Підставляємо дані умови в рівняння (3) і отримаємо відповідь:
![]() =
=
-
Пів моля водню знаходиться при температурі Т = 300 К. Знайти середню кінетичну енергію обертального руху однієї молекули, а також сумарну кінетичну енергію Ек усіх молекул цього газу.
2.21.
Дано
Т
= 300 К
![]() = 0,5 моль
= 0,5 моль![]() = 2 г/моль
= 2 г/моль![]() = 5
= 5![]() = 2
= 2
![]() = ?
= ?
![]() = ?
= ?
Енергія
теплового руху молекул (кінетична
енергія деякої системи, що складається
з
![]() молекул ідеального газу (
молекул ідеального газу (![]() = 6,02∙1023 моль-1 – число
Авогадро), тобто
одного молю газу, з урахуванням виразу
для середньої кінетичної енергія
молекули:
= 6,02∙1023 моль-1 – число
Авогадро), тобто
одного молю газу, з урахуванням виразу
для середньої кінетичної енергія
молекули:
![]() ,
(1)
,
(1)
де
![]() = 2 - сумарна
кількість ступенів свободи обертального
руху однієї
молекули;
= 2 - сумарна
кількість ступенів свободи обертального
руху однієї
молекули;
![]() = 1,38∙10-23 Дж/К - стала Больцмана;
буде дорівнювати:
= 1,38∙10-23 Дж/К - стала Больцмана;
буде дорівнювати:
![]() ,
(2)
,
(2)
де
![]() = 5 - сумарна
кількість ступенів свободи руху
молекули;
= 5 - сумарна
кількість ступенів свободи руху
молекули;
![]() = 8,31 Дж/(моль∙К) – універсальна газова
стала.
= 8,31 Дж/(моль∙К) – універсальна газова
стала.
Для загальної кількості молекул N термодинамічної системи через сталу Авогадро та кількість молів цього газу N = NA, вираз (2) записується у наступному вигляді:
![]() .
(3)
.
(3)
Підставляємо дані умови в рівняння (1) та (3) і отримаємо відповідь:
![]() =
=
![]() =
=
-
При якій температурі середня кінетична енергія поступального руху молекули газу дорівнює
 = 4,14
10-21
Дж?
= 4,14
10-21
Дж?
2.22.
Дано
![]() = 4,14
10-21
Дж
= 4,14
10-21
Дж
![]() = ?
= ?
Середньої кінетичної енергія молекули:
![]() ,
(1)
,
(1)
де
![]() = 3 - сумарна
кількість ступенів свободи поступального
руху
однієї
молекули;
= 3 - сумарна
кількість ступенів свободи поступального
руху
однієї
молекули;
![]() = 1,38∙10-23 Дж/К - стала Больцмана.
= 1,38∙10-23 Дж/К - стала Больцмана.
Розв’язуємо рівняння (1) відносно температури і отримаємо відповідь:
![]() =
=
2.23.
Визначити молярну масу двоатомного
газу і його питому теплоємність, якщо
відомо, що різниця
![]() питомих теплоємкостей цього газу
дорівнює 260 Дж/кг
К.
питомих теплоємкостей цього газу
дорівнює 260 Дж/кг
К.
2.23.
Дано
![]() = 5
= 5![]() = 260 Дж/(кг∙К)
= 260 Дж/(кг∙К)
![]() = ?
= ?
![]() = ?
= ?
![]() = ?
= ?
Між питомою і молярною теплоємністю існує співвідношення:
![]() (1)
(1)
де
![]() - молярна маса речовини, моль/кг.
- молярна маса речовини, моль/кг.
Молярні теплоємкості газу при ізобарному і ізохорному процесі пов’язані рівнянням Майора:
![]() , (2)
, (2)
де
![]() = 8,31 Дж/(моль∙К) – універсальна газова
стала.
= 8,31 Дж/(моль∙К) – універсальна газова
стала.
Тоді питомі теплоємності пов’язані таким чином:
![]() . (3)
. (3)
З рівняння (3) визначаємо молярну масу:
![]() = (4)
= (4)
Питома теплоємність газу для випадку його участі в ізохорному процесі дорівнює
![]() , (5)
, (5)
![]() - кількість ступенів
вільності молекул газу.
- кількість ступенів
вільності молекул газу.
Питома теплоємність газу при ізобарному процесі дорівнює:
![]() . (6)
. (6)
Підставляємо дані умови в рівняння (4) та визначене значення молярної маси в рівняння (5) та (6) і отримаємо відповідь:
![]() =
=
![]() =
=
![]() =
=
-
Визначити показник адіабати ідеального газу, який при температурі Т = 350 К і тиску
 =
0,4 МПа займає
об'єм
V
= 300 л і має теплоємність
=
0,4 МПа займає
об'єм
V
= 300 л і має теплоємність
 = 857 Дж/К.
= 857 Дж/К.
2.24.
Дано
Т
= 350 К V
= 300 л
![]() =
0,4 МПа
=
0,4 МПа![]() =
857 Дж/К
=
857 Дж/К
![]() = ?
= ?
Показник
адіабати
ідеального газу
це відношення молярних теплоємкостей
![]() до
до
![]() :
:
![]() . (1)
. (1)
Теплоємність речовини - це відношення кількості теплоти dQ, що поглинається нею у термодинамічному процесі, до зміни температури dT, що сталася за рахунок надання речовині цієї кількості теплоти:
![]() .
(2)
.
(2)
Питомою теплоємністю.
![]() ,
(3)
,
(3)
Молярною теплоємністю
![]() називають кількість теплоти, яка потрібна
для підвищення температури одного моля
речовини на 1 К.
називають кількість теплоти, яка потрібна
для підвищення температури одного моля
речовини на 1 К.
