
- •Комплексные соединения
- •Глава 1. Основные понятия координационной теории
- •1.1. Комплексообразователь
- •1.3. Дентатность лиганда
- •1.4. Координационное число
- •1.5. Внутренняя и внешняя сфера комплексного соединения
- •1.6. Многоядерные комплексы
- •Глава 2. Номенклатура комплексных соединений
- •2.1. Названия лигандов
- •2.2. Порядок перечисления лигандов
- •2.3. Нейтральные комплексы
- •2.4. Комплексные катионы
- •2.5. Комплексные анионы
- •2.6. Мостиковые группы и многоядерные комплексы
- •Глава 3. Строение комплексных соединений
- •3.1. Координационное число 2
- •3.2. Координационное число 3
- •3.3. Координационное число 4
- •3.4. Координационное число 5
- •3.5. Координационное число 6 и выше
- •Глава 4. Изомерия комплексных соединений
- •4.1. Изомерия лигандов
- •4.2. Геометрическая изомерия
- •4.3. Оптическая изомерия
- •4.4. Сольватная (гидратная) изомерия
- •4.5. Ионная изомерия
- •Глава 5. Устойчивость кс в растворе
- •5.1. Комплексные соединения без внешней сферы
- •5.2. Отщепление ионов внешней сферы
- •5.3. Обратимая диссоциация комплексов
- •5.4. Ступенчатая и полная константы образования
- •5.5. Константы образования и прочность комплексов
- •5.6. Константы нестойкости
- •5.7. Примеры образования и разрушения комплексов
- •Глава 6. Квантовомеханические теории строения комплексных соединений
- •6.1. Теория валентных связей
- •6.2. Гибридизация орбиталей и структура комплексов
- •6.4. Цветность комплексных соединений
- •Глава 7. Типы комплексных соединений
- •7.1. Аквакомплексы
- •7.2. Гидроксокомплексы
- •7.3. Аммиакаты
- •7.4. Ацидокомплексы
- •7.5. Анионгалогенаты
- •7.6. Катионгалогены
- •7.7. Гидридные комплексы
- •7.10. Хелаты
- •Глава 8. Элементы Периодической системы д.И. Менделеева: способность к образованию комплексов
- •8.1. Элементы s-секции
- •8.2. Элементы p-секции
- •8.3. Элементы d-секции
- •8.4. Лантаноиды и актиноиды
1.5. Внутренняя и внешняя сфера комплексного соединения
С 5. Лиганды, непосредственно связанные с комплексообразователем, образуют вместе с ним внутреннюю (координационную) сферу комплекса. Так, в комплексном катионе [Cu(NH3)4]2+ внутренняя сфера образована атомом комплексообразователя – меди(II) и молекулами аммиака, непосредственно с ним связанными. Обозначается внутренняя сфера квадратными скобками: [Fe(CN)6]3, [HgI4]2, [SnCl6]2. В зависимости от соотношения суммарного заряда лигандов и комплексообразователя внутренняя сфера может иметь положительный заряд, например,[Al(H2O)6]3+, либо отрицательный, например, [Ag(SO3S)2]3, или нулевой заряд, например, как для [Cr(NH3)3(NCS)3]0.
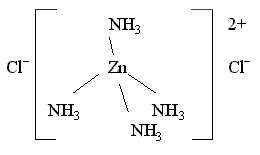
Ионы, нейтрализующие заряд внутренней сферы, но не связанные с комплексообразователем ковалентно, образуют внешнюю сферу комплексного соединения. Например, в комплексном соединении [Zn(NH3)4]Cl2 два иона Cl находятся во внешней сфере:
 Внешнесферные
ионы Cl находятся на
более значительном удалении от
комплексообразователя, чем молекулы
NH3,
иначе говоря, расстояние Zn – Cl больше,
чем длина химической связи Zn – N. Более
того, химическая связь комплексного
катиона [Zn(NH3)4]2+ и
хлорид-ионов Cl имеет
ионный характер, в то время как молекулы
аммиака NH3,
входящие во внутреннюю сферу, образуют
с комплексообразователем Zn(II) ковалентные
связи по донорно-акцепторному механизму
(донором неподеленных пар электронов
являются атомы азота в NH3).
Таким образом, различие между лигандами
внутренней сферы и ионами
внешней сферы очень
существенно.
Внешнесферные
ионы Cl находятся на
более значительном удалении от
комплексообразователя, чем молекулы
NH3,
иначе говоря, расстояние Zn – Cl больше,
чем длина химической связи Zn – N. Более
того, химическая связь комплексного
катиона [Zn(NH3)4]2+ и
хлорид-ионов Cl имеет
ионный характер, в то время как молекулы
аммиака NH3,
входящие во внутреннюю сферу, образуют
с комплексообразователем Zn(II) ковалентные
связи по донорно-акцепторному механизму
(донором неподеленных пар электронов
являются атомы азота в NH3).
Таким образом, различие между лигандами
внутренней сферы и ионами
внешней сферы очень
существенно.
В [Cu(NH3)4](OH)2 и K2[HgI4] внешнесферными ионами являются соответственно ионы OH и K+. Вполне понятно, что в нейтральных комплексах [Cr(NH3)3(NCS)3]0 и [Pd(NH3)2Cl2]0 внешняя сфера отсутствует.
С 5. Обычно внешнюю сферу составляют простые одноатомные или многоатомные ионы. Однако возможны случаи, когда КС состоит из двух и более внутренних сфер, выполняющих функции катионной и анионной части соединения. Здесь каждая из внутренних сфер является внешней по отношению к другой. Например, в соединениях [Cu(NH3)4][PtCl6] и [Ni(NH3)6]2[Fe(CN)6] формально функции внешнесферных ионов могут выполнять:
комплексные катионы [Cu(NH3)4]2+ и [Ni(NH3)6]2+,
комплексные анионы [PtCl6]2 и [Fe(CN)6]4
1.6. Многоядерные комплексы
С 8. Если в комплексном ионе или нейтральном комплексе содержатся два и более комплексообразователей, то этот комплекс называется многоядерным. Среди многоядерных комплексов выделяют мостиковые, кластерные и многоядерные комплексы смешанного типа.
Атомы
комплексообразователя могут быть
связаны между собой с помощью мостиковых
лигандов,
функции которых выполняют ионы OH,
Cl,
NH2,
O22,
SO42и
некоторые другие.
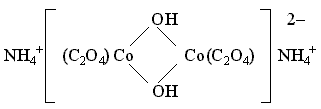
Так, в комплексном
соединении
(NH4)2[Co2(C2O4)2(OH)2] мостиковыми служат бидентатные
( 2 связи) гидроксидные лиганды:
Когда атомы комплексообразователя связаны между собой непосредственно, многоядерный комплекс относят к кластерному типу. Так, кластером является комплексный анион [Re2Cl8]2
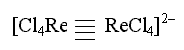
в котором реализуется четверная связь Re – Re: одна σ-связь, две π- связи и одна δ-связь. Особенно большое число кластерных комплексов насчитывается среди производных d-элементов.
Многоядерные
комплексы смешанного
типа содержат
как связь комплексообразователь–комплексообразователь,
так и мостиковые лиганды.
Примером
комплекса смешанного типа может служить
карбонильный комплекс кобальта состава
[Co2(CO)8],
имеющий следующее строение:
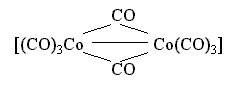
Здесь имеется одинарная связь Co – Co и два бидентатных карбонильных лиганда CO, осуществляющих мостиковое соединение атомов-комплексообразователей.
