
- •Комплексные соединения
- •Глава 1. Основные понятия координационной теории
- •1.1. Комплексообразователь
- •1.3. Дентатность лиганда
- •1.4. Координационное число
- •1.5. Внутренняя и внешняя сфера комплексного соединения
- •1.6. Многоядерные комплексы
- •Глава 2. Номенклатура комплексных соединений
- •2.1. Названия лигандов
- •2.2. Порядок перечисления лигандов
- •2.3. Нейтральные комплексы
- •2.4. Комплексные катионы
- •2.5. Комплексные анионы
- •2.6. Мостиковые группы и многоядерные комплексы
- •Глава 3. Строение комплексных соединений
- •3.1. Координационное число 2
- •3.2. Координационное число 3
- •3.3. Координационное число 4
- •3.4. Координационное число 5
- •3.5. Координационное число 6 и выше
- •Глава 4. Изомерия комплексных соединений
- •4.1. Изомерия лигандов
- •4.2. Геометрическая изомерия
- •4.3. Оптическая изомерия
- •4.4. Сольватная (гидратная) изомерия
- •4.5. Ионная изомерия
- •Глава 5. Устойчивость кс в растворе
- •5.1. Комплексные соединения без внешней сферы
- •5.2. Отщепление ионов внешней сферы
- •5.3. Обратимая диссоциация комплексов
- •5.4. Ступенчатая и полная константы образования
- •5.5. Константы образования и прочность комплексов
- •5.6. Константы нестойкости
- •5.7. Примеры образования и разрушения комплексов
- •Глава 6. Квантовомеханические теории строения комплексных соединений
- •6.1. Теория валентных связей
- •6.2. Гибридизация орбиталей и структура комплексов
- •6.4. Цветность комплексных соединений
- •Глава 7. Типы комплексных соединений
- •7.1. Аквакомплексы
- •7.2. Гидроксокомплексы
- •7.3. Аммиакаты
- •7.4. Ацидокомплексы
- •7.5. Анионгалогенаты
- •7.6. Катионгалогены
- •7.7. Гидридные комплексы
- •7.10. Хелаты
- •Глава 8. Элементы Периодической системы д.И. Менделеева: способность к образованию комплексов
- •8.1. Элементы s-секции
- •8.2. Элементы p-секции
- •8.3. Элементы d-секции
- •8.4. Лантаноиды и актиноиды
Глава 7. Типы комплексных соединений
С 47. Наиболее распространенной в настоящее время является классификация комплексных соединений по характеру координируемых лигандов. Эта классификация применима только для тех КС, внутренняя сфера которых состоит из одинаковых лигандов.
7.1. Аквакомплексы
С 47. Аквакомплексы представляют собой ионы или молекулы, в которых лигандами служат молекулы воды. В водных растворах солей почти все ионы существуют в виде акваионов, например, [Be(H2O)4]2+, [Al(H2O)6]3+, [Cr(H2O)6]3+ и т.д. При кристаллизации таких солей из водных растворов вода остается связанной с комплексообразователем: [Be(H2O)4]SO4, [K(H2O)6][Al(H2O)6](SO4)2, [Cr(H2O)6]Cl3.
С 49. К аквакомплексам относятся многие кристаллогидраты, например, [Al(H2O)6]Cl3 (иначе – AlCl3 . 6 H2O), [Cr(H2O)6](NO3)3 (иначе – Cr(NO3)3. 6 H2O).
С 48. У некоторых кристаллогидратов часть молекул воды входит во внутреннюю, а остальные находятся во внешней сфере и связываются с внешнесферными ионами. Например, пентагидрат сульфата меди(II) и гептагидрат сульфата никеля(II) содержат аквакомплексы – катион тетрааквамеди(II) и катион гексаакваникеля(II) и слабо связанную внешнесферную молекулу воды, которая объединяет катионы и анионы посредством водородных связей:
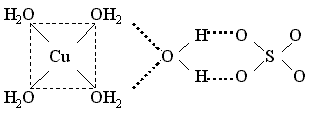 [Cu(H2O)4]SO4 . H2O
[Cu(H2O)4]SO4 . H2O
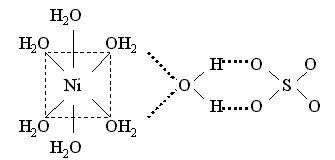
[Ni(H2O)6]SO4 . H2O
[Ni(H2O)6]SO4 . H2O
Координационные формулы указанных соединений, учитывающие состав внутренней и внешней сферы.
Все аквакатионы, за исключением тех, которые образованы щелочными и щелочноземельными элементами, а также таллием(I), серебром(I) и т.п., являются катионными кислотами, в водном растворе подвергаются протолизу и создают кислотную среду (рН 7):
[Zn(H2O)4]2+ +
H2O ![]() [Zn(H2O)3(OH)]+ +
H3O+
[Zn(H2O)3(OH)]+ +
H3O+
Кислотные свойства аквакомплексов выражены тем сильнее, чем выше степень окисления атома-комплексообразователя. Н.: значения констант кислотности для производных железа(II) и железа(III) составляют 1,8 . 10 7 и 6,8 . 103. Следовательно, равновесие протолиза в случае аквакомплекса железа(III) в большей степени смещено вправо, чем для железа(II).
7.2. Гидроксокомплексы
С 50. Гидроксокомплексы – комплексные соединения, содержащие в качестве лигандов гидроксид-ионы OH. Гидроксокомплексы образуются в реакциях протолиза из аквакомплексов:
[Al(H2O)6]3+ +
H2O ![]() [Al(H2O)5(OH)]2+ +
H3O+
[Al(H2O)5(OH)]2+ +
H3O+
либо при растворении амфотерных гидроксидов в водных растворах гидроксидов щелочных металлов:
Zn(OH)2 + 2 OH = [Zn(OH)4]2
Водные растворы гидроксокомплексов имеют щелочную реакцию. Появление гидроксид-ионов в растворе вызвано замещением во внутренней сфере комплексов гидроксидных лигандов на молекулы воды:
[Zn(OH)4]2 +
H2O ![]() [Zn(H2O)(OH)3] +
OH
[Zn(H2O)(OH)3] +
OH
Гидроксокомплексы устойчивы только в сильнощелочных растворах. В нейтральной, а тем более в кислой среде, а также при нагревании растворов они разрушаются:
[Al(OH)4] + CO2 = Al(OH)3 + HCO3
[Be(OH)4]2 + 2NH4+ = Be(OH)2 + 2NH3 . H2O
[Zn(OH)4]2 + 4 H3O+ = [Zn(H2O)4]2+ + 4 H2O
Na[Al(OH)4] = NaAlO2 + 2 H2O (при нагревании)
Некоторые гидроксокомплексы можно использовать в качестве реагентов для идентификации отдельных ионов в растворе. Например, определение присутствия катиона Na+ иногда ведут, выделяя малорастворимый гексагидроксостибат(V) натрия Na[Sb(OH)6] в виде мелкокристаллического белого осадка по реакции:
Na+ + [Sb(OH)6] = Na[Sb(OH)6]
