
- •Бабенко м. О.
- •Тема 4. Механіка твердого тіла.
- •Тема 5. Закони збереження.
- •Тема 6. Механічні коливання.
- •Тема 7. Механічні хвилі.
- •Тема 8. Спеціальна теорія відносності.
- •Тема 1. Вступ до молекулярної фізики і термодинаміки.
- •Тема 7. Властивості реальних газів, рідин, твердих тіл.
- •Тема 8. Фазові переходи.
- •Задачі для самостійного розв’язування
- •Кінематика обертального руху.
- •Використання законів динаміки для знаходження прискорення точки
- •Теоретичні відомості
- •Задачі для самостійного розв’язування
- •Тема 3 Динаміка руху точки по колу. Рух тіла зі змінною масою Теоретичні відомості
- •Задачі для самостійного розв’язування
- •Закон збереження механічної енергії.
- •Консервативні і неконсервативні сили
- •Теоретичні відомості
- •Задачі для самостійного розв’язування
- •Тема 5 Закон збереження імпульсу. Теорія пружних і непружних зіткнень Теоретичні відомості
- •Задачі для самостійного розв’язування
- •Тема 6 Динаміка обертального руху тіла. Умови рівноваги тіла Теоретичні відомості
- •Задачі для самостійного розв’язування
- •Механічні властивості твердих тіл. Закон Гука.
- •Елементи гідродинаміки. Закон Бернуллі
- •Теоретичні відомості
- •Задачі для самостійного розв’язування
- •Тема 8 Перший закон термодинаміки. Внутрішня енергія і засоби її зміни. Теоретичні відомості
- •Задачі для самостійного розв’язування
- •Тема 9 Теплові двигуни та холодильні машини Теоретичні відомості
- •Задачі для самостійного розв’язування
- •Тема 10 Основне рівняння мкт. Явища переносу Теоретичні відомості
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач
- •Питання до заліку
- •Правила оформлення контрольної роботи
- •Завдання до контрольної роботи
- •Список рекомендованої літератури
Задачі для самостійного розв’язування
Верхній кінець свинцевого дроту діаметром d = 2 см і довжиною 60 м закріплений нерухомо. До нижнього кінця підвішений вантаж масою 100 кг. Знайти механічну напругу матеріалу: 1) у нижнього кінця; 2) на середині довжини; 3) у верхнього кінця дроту.
Який найбільший вантаж може витримати сталевий дріт діаметром d = 1 мм, не виходячи за межу пружності 294 МПа? Яку частку первісної довжини складає подовження дроту при цьому вантажі?
Свинцевий дріт підвішений у вертикальному положенні за верхній кінець. Яку найбільшу довжину може мати дріт, не обриваючись під дією сили ваги? Межа міцності свинцю дорівнює 12,3 МПа.
Гиря масою 10 кг, що прив'язана до дроту, обертається з частотою 2 с–1 навколо вертикальної осі, що проходить через кінець дроту, сковзаючи при цьому без тертя по горизонтальній поверхні. Довжина дроту дорівнює 1,2 м, площа S її поперечного перерізу дорівнює 2 мм2. Знайти механічну напругу металу дроту. Масою її знехтувати.
Однорідний стрижень довжиною 1,2 м, площею поперечного перерізу S = 2 см2 і масою 10 кг, обертається з частотою 2 с–1 навколо вертикальної осі, що проходить через кінець стрижня, сковзаючи при цьому без тертя по горизонтальній поверхні. Знайти найбільшу механічну напругу матеріалу стрижня при даній частоті обертання.
До вертикального дроту довжиною 5 м і площею поперечного перерізу 2 мм2 підвішений вантаж масою 5,1 кг. У результаті дріт подовжився на 0,6 мм. Знайти модуль Юнга матеріалу дроту.
До сталевого стрижня довжиною 3 м і діаметром d = 2 см підвішений вантаж масою 2,5*103 кг. Визначити механічну напругу у стрижні, відносне й абсолютне подовження стрижня.
Дріт довжиною 2 м і діаметром d = 1 мм натягнутий практично горизонтально. Коли до середини дроту підвісили вантаж масою m = 1 кг, дріт розтягнувся настільки, що точка підвісу опустився на 4 см. Визначити модуль Юнга Е матеріалу дроту.
Яку роботу А необхідно виконати, щоб розтягти на 1 мм сталевий стрижень довжиною 1 м і площею S поперечного перерізу 1 см2?
Тема 8 Перший закон термодинаміки. Внутрішня енергія і засоби її зміни. Теоретичні відомості
Макросистемою називається система, що складається з великої кількості частинок. Термодинаміка – це розділ фізики, у якому розглядається поведінка макросистем з використанням понять і параметрів, що характеризують систему в цілому. Молекулярна або статистична фізика розглядає стан макросистеми на основі уявлень про молекулярну будівлю речовини. Стан макросистеми характеризують величинами, що називаються термодинамічними параметрами (тиск р, об’єм V, температура Т і інші). Стан системи є рівноважним, якщо всі параметри її мають визначені і сталі значення при незмінних зовнішніх умовах. Будь який реальний процес проходить через послідовність нерівноважних станів. Але якщо такий вплив здійснюється досить повільно, то можна сказати, що процес проходить через послідовність рівноважних станів. Такий процес називають квазістатичним.
Температура – це фізична величина, що характеризує стан термодинамічної рівноваги макросистеми. Якщо при встановленні теплового контакту між тілами одне з тіл передає енергію іншому за допомогою теплопередачі, то вважають, що перше тіло має більшу температуру, ніж друге. Будь який метод виміру температури вимагає встановлення температурної шкали. Для цього використовують деякі особливі точки. За міжнародною угодою температурну шкалу будують по тройній точці води (Ттр). У термодинамічній шкалі температур (шкалі Кельвіна) приймається по визначенню, що Ттр = 273,15 К. При такому значенні Ттр інтервал між точками плавлення льоду і кипіння води практично дорівнює 100 кельвін, і температури цих точок дорівнюють приблизно 273,15 і 373,15 К. При цьому варто враховувати, що 1К=1°С. Температура t по шкалі Цельсія зв'язана з температурою по шкалі Кельвіна співвідношенням:
t = Т – 273,15.
Температуру Т = 0 називають абсолютним нулем, йому відповідає t=–273,15 °С.
Внутрішня енергія – це енергія частинок, з яких складається речовина. Вона містить у собі:
сумарну кінетичну енергію хаотичного руху молекул у Ц–системі;
власну потенціальну енергію взаємодії всіх молекул;
внутрішню енергію молекул, атомів і ядер.
Внутрішня енергія є функцією стану. При зміні стану збільшення внутрішньої енергії визначається тільки кінцевим і початковим станами і не залежить від процесу, при якому система переводиться з одного стану в інший. Способи зміни внутрішньої енергії:
виконати над системою роботу;
передати системі кількість теплоти Q.
Кількістю теплоти називається міра зміни внутрішньої енергії при теплопередачі.
Теплопередачею називається сукупність мікроскопічних процесів, що приводять до передачі енергії від одного тіла до іншого.
Закон збереження енергії з урахуванням теплових процесів називається першим початком термодинаміки.
Якщо
над системою виконали роботу
![]() і передали їй кількість теплоти Q, то,
відповідно до закону збереження енергії,
збільшення внутрішньої енергії буде
дорівнює алгебраїчній сумі роботи
зовнішніх сил над системою і переданого
їй кількості теплоти:
і передали їй кількість теплоти Q, то,
відповідно до закону збереження енергії,
збільшення внутрішньої енергії буде
дорівнює алгебраїчній сумі роботи
зовнішніх сил над системою і переданого
їй кількості теплоти:
![]() .
.
Якщо
система виконує роботу А проти зовнішніх
сил, то з урахуванням третього закону
Ньютона можна записати:
![]() .
Тоді останню формулу можна переписати
у вигляді:
.
Тоді останню формулу можна переписати
у вигляді:
![]() .
.
Отримане вираження є математичним записом першого початку термодинаміки: Кількість теплоти, що передана макросистемі, йде на збільшення її внутрішньої енергії і на здійснення системою роботи над зовнішніми тілами. У диференціальній формі перший закон термодинаміки має вигляд:
![]() .
.
О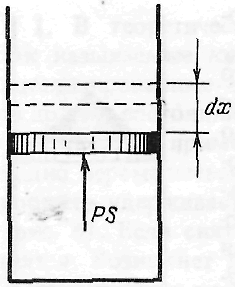 бчислимо
елементарну роботу газу
бчислимо
елементарну роботу газу
![]() при нескінченно малому квазістатичному
розширенні, у якому його об’єм збільшується
на dV.
Нехай газ знаходиться в циліндрі під
поршнем. Сила тиску газу на поршень
дорівнює
при нескінченно малому квазістатичному
розширенні, у якому його об’єм збільшується
на dV.
Нехай газ знаходиться в циліндрі під
поршнем. Сила тиску газу на поршень
дорівнює
![]() ,
,
де S – площа поршня.
Якщо поршень переміститься на відстань dx, то газ виконає роботу:
![]()
або
враховуючи, що
![]() ,
одержуємо:
,
одержуємо:
![]() .
.
Повна робота при переході системи зі стану 1 у стан 2 визначається з вираження:
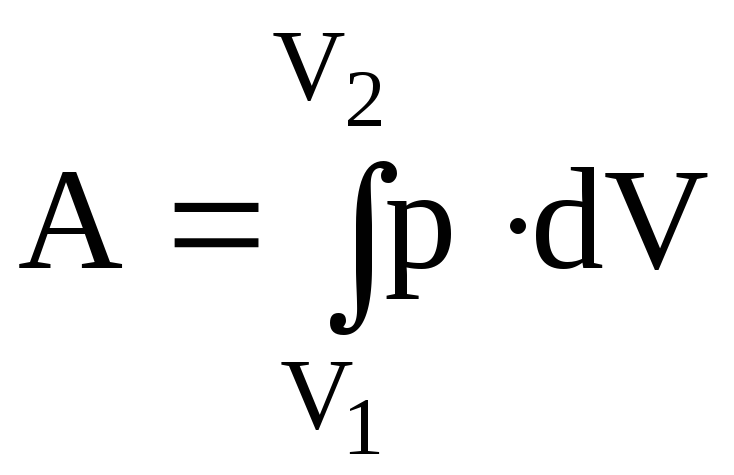
 .
.
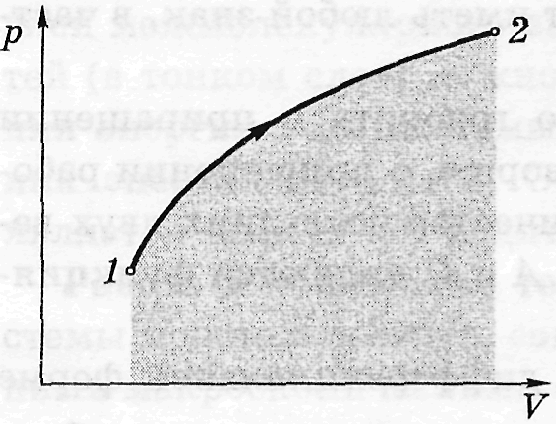
Г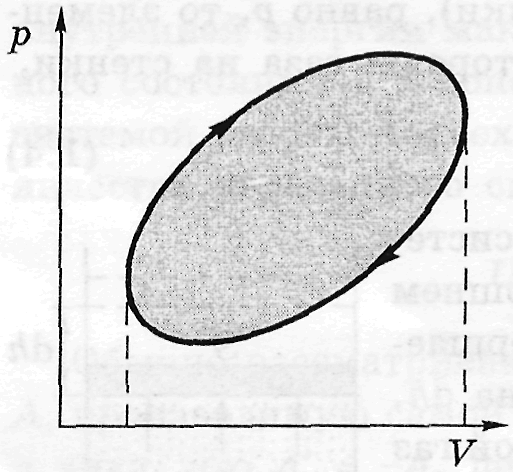 еометрично
роботу можна визначити як площу фігури
під графіком у системі pV.
З графіка видно, що робота істотно
залежить від процесу, при якому система
переводиться зі стану 1 у 2, оскільки
площа під кривою 1–2 залежить від вигляду
кривої, тобто від процесу. Якщо в
результаті змін макросистема повертається
у вихідний стан, то кажуть, що вона
зробила круговий процес або цикл. На
діаграмі pV такий процес має вигляд
замкнутої кривої. Робота, чинена системою
за цикл, чисельно дорівнює площі
замкненого циклу. При цьому, якщо точка,
що зображує стан системи, описує цикл
за годинною стрілкою, то робота системи
А > 0. Якщо ж проти руху стрілки, то А <
0.
еометрично
роботу можна визначити як площу фігури
під графіком у системі pV.
З графіка видно, що робота істотно
залежить від процесу, при якому система
переводиться зі стану 1 у 2, оскільки
площа під кривою 1–2 залежить від вигляду
кривої, тобто від процесу. Якщо в
результаті змін макросистема повертається
у вихідний стан, то кажуть, що вона
зробила круговий процес або цикл. На
діаграмі pV такий процес має вигляд
замкнутої кривої. Робота, чинена системою
за цикл, чисельно дорівнює площі
замкненого циклу. При цьому, якщо точка,
що зображує стан системи, описує цикл
за годинною стрілкою, то робота системи
А > 0. Якщо ж проти руху стрілки, то А <
0.
Рівняння стану ідеального газу. Теплоємність ідеального газу.
Стан
заданої маси визначається значеннями
трьох макропараметрів: тиску р, об’єму
V і температури Т. Зазначений зв'язок
може бути заданий аналітично у вигляді
функції
![]() .
Співвідношення, що визначає зв'язок між
параметрами p, V і Т, називається рівнянням
стану.
Найпростішими властивостями володіє
газ, взаємодією між молекулами в якому
зневажають. Такий газ називають ідеальним.
Рівняння стану ідеального газу має
вигляд:
.
Співвідношення, що визначає зв'язок між
параметрами p, V і Т, називається рівнянням
стану.
Найпростішими властивостями володіє
газ, взаємодією між молекулами в якому
зневажають. Такий газ називають ідеальним.
Рівняння стану ідеального газу має
вигляд:
![]() .
.
Це рівняння називають рівнянням Менделєєва–Клапейрона. – кількість речовини, що вимірюється в молях. Моль – міра виміру речовини кількістю частинок. В одному молі будь–якої речовини вміщується стільки ж частинок, скільки їх знаходиться у вуглеці масою 0,012 кг. Це число називають числом Авогадро:
![]() .
.
R – універсальна газова стала:
![]() .
.
Маса одного моля речовини називається молярною масою:
![]() .
.
Теплоємністю тіла називають фізичну величину, яка дорівнює кількості теплоти, яка необхідна тілу для нагрівання на 1 К:
![]() ,
,
![]() .
.
Теплоємність одного моля речовини називається молярною теплоємністю:
![]() ,
,
![]() .
.
Теплоємність одиниці маси речовини називають питомою теплоємністю:
![]() ,
,
![]() .
.
Між
молярною і питомою теплоємністями існує
зв'язок:
![]() .
.
Теплоємність є функцією процесу, оскільки вона залежить від вигляду процесу, при якому систему переводять з одного стану в інший.
Ізопроцесом
називають процес переходу газу з одного
стану в інший при одному фіксованому
макропараметрі. Процес, при якому об’єм
газу залишається сталим, називається
ізохоричним. З рівняння Менделєєва–Клапейрона
випливає, що при незмінній кількості
речовини
![]() – закон Шарля: При постійному об’ємі
відношення тиску до абсолютної температури
є величиною сталою. Робота газу при
ізохоричному процесі дорівнює нулю,
оскільки dV
= 0. Тоді математичне вираження першого
закону термодинаміки приймає вигляд:
– закон Шарля: При постійному об’ємі
відношення тиску до абсолютної температури
є величиною сталою. Робота газу при
ізохоричному процесі дорівнює нулю,
оскільки dV
= 0. Тоді математичне вираження першого
закону термодинаміки приймає вигляд:
![]() .
.
Для одного моля газу
![]() ,
,
де
![]() – молярна теплоємність газу при
постійному об’ємі.
– молярна теплоємність газу при
постійному об’ємі.
Після відповідної підстановки вираження для зміни внутрішньої енергії приймає вигляд:
![]()
і
![]() ,
,
відкіля одержуємо формулу внутрішньої енергії, як функцію температури:
![]() .
.
Для довільної маси газу остання формула приймає вигляд:
![]() .
.
Процес переходу газу з одного стану в інший при постійному тиску називається ізобаричним. З рівняння стану ідеального газу випливає:
![]() –закон
Гей–Люссака: при постійному тиску
відношення об’єму до абсолютної
температури є величиною постійною.
–закон
Гей–Люссака: при постійному тиску
відношення об’єму до абсолютної
температури є величиною постійною.
Математичне вираження першого закону термодинаміки для ізобаричного процесу має вигляд:
![]() .
.
Розділивши ліву і праву частини останньої рівності на dТ одержимо:
![]()
або
![]() ,
,
де
![]() – молярна теплоємність газу при
постійному тиску.
– молярна теплоємність газу при
постійному тиску.
Рівняння стану одного моля ідеального газу має вигляд:
![]() .
.
Продифференціював останнє рівняння з урахуванням сталості тиску, отримуємо:
![]()
або
![]() .
.
З останнього вираження випливає, що робота одного моля ідеального газу при ізобаричному нагріванні його на 1 К дорівнює універсальної газової сталої. Після відповідної підстановки формула молярної теплоємності при постійному тиску здобуває вигляд:
![]() .
.
Отримане рівняння називається рівнянням Майєра.
Важливою
характеристикою газів є відношення
![]() ,
що позначається буквою
і називається постійною адіабати. З
урахуванням рівняння Майєра можна
записати:
,
що позначається буквою
і називається постійною адіабати. З
урахуванням рівняння Майєра можна
записати:
![]() ,
,
відкіля одержуємо формулу для молярної теплоємності при постійному об’ємі:
![]() .
.
Підставивши отриману формулу у вираження для внутрішньої енергії, одержуємо:
![]() .
.
Ізотермічним
називають процес переходу газу з одного
стану в інше при сталій температурі. З
рівняння Менделєєва–Клапейрона випливає
закон Бойля-Маріотта:
![]() – при незмінній температурі добуток
тиску на об’єм є величиною сталою.
Оскільки Т = const, то внутрішня енергія
системи не змінюється (dU
= 0), і математичний вираз першого закону
термодинаміки приймає вигляд:
– при незмінній температурі добуток
тиску на об’єм є величиною сталою.
Оскільки Т = const, то внутрішня енергія
системи не змінюється (dU
= 0), і математичний вираз першого закону
термодинаміки приймає вигляд:
![]()
і
![]() .
.
Визначимо роботу газу при ізотермічному розширенні:
 .
.
Таким чином, для збільшення об’єму газу від V1 до V2 при сталій температурі необхідно системі передати кількість теплоти:
Адіабатичним
називається процес, що протікає без
теплообміну з навколишнім середовищем.
Оскільки
![]() ,
то перший закон термодинаміки для
адіабатичного процесу буде мати вигляд:
,
то перший закон термодинаміки для
адіабатичного процесу буде мати вигляд:
![]() .
.
Але
![]() ,
а
,
а
![]() .
Після підстановки одержуємо:
.
Після підстановки одержуємо:
![]() .
.
Оскільки
![]() ,
то
,
то
![]() або
або
![]() .
.
Останнє вираження являє собою диференціал суми логарифмів:
![]() ,
,
відкіля
випливає що
![]() .
.
Враховуючи,
що
![]() ,
то
,
то
![]() .
Використовуючи властивості логарифмів
(
.
Використовуючи властивості логарифмів
(![]() ),
одержуємо:
),
одержуємо:
![]() .
.
В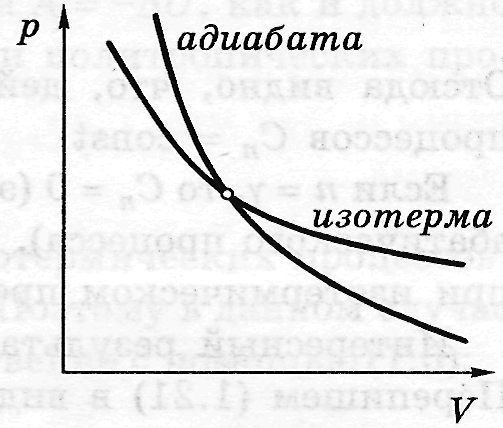 иразимо
температуру з рівняння Менделєєва–Клапейрона
і підставимо в останню формулу:
иразимо
температуру з рівняння Менделєєва–Клапейрона
і підставимо в останню формулу:
![]() ,
,
![]() .
.
Але,
оскільки
![]() ,
то в остаточному підсумку одержуємо:
,
то в остаточному підсумку одержуємо:
![]()
або
![]() .
.
Отримане
рівняння називається рівнянням
Пуассона.
Слід зазначити, що в природі в реальних
умовах не існує ідеально ізольованих
систем. Однак кількість теплоти, яким
обмінюється система з навколишнім
середовищем буде тим менше, чим менше
часу триває процес. Тому близькими до
адіабатичного є тільки процеси, які
протікають дуже швидко. Графік
адіабатичного процесу – адіабата.
Зіставлення рівняння ізотерми
![]() з рівнянням адіабати
з рівнянням адіабати
![]() з урахуванням того, що
>1, дозволяє зробити висновок, що
адіабата йде крутіше, ніж ізотерма,
тобто адіабатне розширення газу
супроводжується його охолодженням.
з урахуванням того, що
>1, дозволяє зробити висновок, що
адіабата йде крутіше, ніж ізотерма,
тобто адіабатне розширення газу
супроводжується його охолодженням.
Політропічним називається процес переходу газу з одного стану в інше, при якому теплоємність залишається сталою (Сn = const). Рівняння залежності тиску від об’єму при політропічному процесі має вигляд:
![]() ,
,
де n – довільне число.
Оскільки
![]() ,
то після підстановки одержуємо:
,
то після підстановки одержуємо:
![]() або
або
![]() .
.
Отримане рівняння є рівнянням політропи в системі TV. Покажемо, що при політропічному процесі теплоємність газу залишається сталою. Математичний запис першого початку термодинаміки має вигляд:
![]() .
.
Розділимо ліву і праву частину на dТ:
![]() .
.
З
огляду на те, що
![]() і
і
![]() ,
одержуємо:
,
одержуємо:
![]() .
.
Оскільки
![]() ,
то похідна від лівої частини дорівнює
нулю:
,
то похідна від лівої частини дорівнює
нулю:
![]() ,
і
,
і
![]() ,
,
відкіля випливає:
![]()
або
![]() .
.
Для
одного моля газу
![]() .
Після підстановки одержуємо:
.
Після підстановки одержуємо:
![]() .
.
Підставимо останнє вираження у формулу теплоємності:
![]() .
.
З
огляду на те, що
![]() ,
остаточно одержуємо:
,
остаточно одержуємо:
![]() ,
,
відкіля випливає, що теплоємність речовини при політропічному процесі є величиною сталою.
Якщо
![]() ,
то
,
то![]() і
і
![]() ,
тобто одержуємо адіабатичний процес.
При
,
тобто одержуємо адіабатичний процес.
При
![]() одержуємо
одержуємо
![]() і
Т = const,
тобто ізотермічний процес.
і
Т = const,
тобто ізотермічний процес.
Визначимо роботу газу при політропічному процесі. З першого початку термодинаміки випливає:
![]() .
.
Для молів газу
![]() .
.
Тому вираження для роботи можна переписати у вигляді:
![]() .
.
Повна робота дорівнює:
![]() .
.
