
02_Молекулярная_физика
.pdf
31
Адиабатический процесс
Пусть выполняется условие:
n = γ = Cp , CV
(p, V),
|
|
|
|
|
Cp |
CV −Cp |
|
|
|
|
|
||
|
nCV −Cp |
|
|
|
|
|
0 |
|
|
||||
C = |
= |
|
CV |
|
= |
|
= 0, |
||||||
n |
−1 |
|
|
|
Cp |
−1 |
Cp |
|
|||||
|
|
|
|
|
|
−1 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
CV |
|
CV |
||||
|
|
|
|
|
|
|
|
|
|
|
|||
dQ = νCdT = 0 .
Равновесный процесс, при котором система не получает и не отдает теплоту называется адиабатическим (адиабатным) процессом.
Уравнение адиабатического процесса имеет вид
pVγ = const .
γ= Cp - показатель адиабаты.
CV
Условие, необходимое и достаточное для того, чтобы процесс был адиабатическим, имеет вид:
dQ = 0 .
В действительности исключить процесс обмена теплотой полностью нельзя. В то же время, процессы теплообмена протекают достаточно медленно и если ими можно пренебречь, то в этих условиях можно рассматривать изменение состояния системы как адиабатический процесс.
32
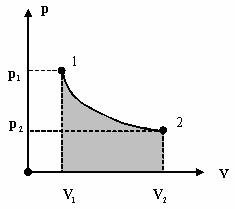
Вычислим работу, совершаемую газом в адиабатическом процессе. Запишем
Q = (U2 − U1 )+ Α12 ,
Q = ∫2 dQ , dQ = 0 , Q = 0 ,
1
Α12 = U1 − U2 .
Работа идеального газа в адиабатическом процессе равна убыли внутренней энергии идеального газа в этом процессе.
U= νСV T ,
Α12 = νCV (T1 −T2 ),
A12 > 0 , T1 −T2 > 0, T1 > T2 ,
A12 < 0 , T1 −T2 < 0 , T1 < T2 .
Если газ совершает положительную работу (расширяется), то его внутренняя энергия температура уменьшаются. При сжатии газа, им совершается отрицательная работа, в результате чего температура газа возрастает.
Очевидно, что отрицательная работа газа означает, что внешние силы, действующие на газ, совершают равную по величине положительную работу. Получим еще одно уравнение адиабатического процесса.
|
pVγ |
= const , |
|
|
|
||
|
pV = νRT , p = |
νRT |
, |
|
|||
νRT |
V |
|
|||||
|
|
|
const |
|
|||
Vγ = const , TVγ−1 = |
, |
||||||
|
νR |
||||||
V |
= const . |
|
|
||||
|
TV γ−1 |
|
|
|
|||

33
ГЛАВА 3. РЕАЛЬНЫЕ ГАЗЫ И ЖИДКОСТИ
При |
увеличении давления, |
температуры поведения таких газов, как |
H2,O2 , He |
и других отличается |
от поведения идеального газа, которое |
описывается уравнением газового состояния. Это обусловлено следующими признаками:
1.Молекулы газа имеют конечные размеры и занимают собой определенный объем.
2.Силы взаимодействия между молекулами оказывают существенное влияние, которое нужно учитывать.
Уравнение Ван-дер-Ваальса
Запишем из уравнения состояния для идеального газа
p = νRTV . ( )
Обозначим
b0 - объем одной молекулы N - число молекул
Поскольку в ( ) величина V имеет смысл объема пространства, в котором движутся молекулы, то вычтем из V объем, занимаемый N молекулами.
p = Vν−RTNb0 .
Опыт дает, что если молекулы не находятся на очень близких расстояниях, то между ними действуют силы притяжения. Следовательно, на молекулу, подлетающую к стенке сосуда, со стороны остальных молекул действуют силы, которые уменьшают скорость молекулы в момент столкновения со стенкой.

34
Указанное взаимодействие приводит к уменьшению давления на некоторую величину, которую обозначим ∆p .
p = |
νRT |
−∆p . |
|
V − b0 N |
|||
|
|
Можно предположить, что
|
|
|
2 |
N 2 |
N2 |
, |
||
∆p |
|
n |
|
= a0 |
|
= a0 |
|
|
|
|
V |
V2 |
|||||
где а0 некоторая постоянная
p = |
νRT |
− |
N2 |
a0 . |
|
V2 |
|||
|
V − Nb0 |
|
||
Отсюда
(p + N2 a0 ) (V − N b0 )=νRT .
V2
Обозначим:
a = N A2 a0 ; b = N Ab0
Тогда:
(p + |
ν 2 |
a ) (V −ν b )=νRT |
|
V2 |
|
Это уравнение Ван-дер-Ваальса. Газ, поведение которого описывается данным уравнением, называется газом Ван-дер-Ваальса или Вандерваальсовым газом.
Величины а,в- постоянные Ван-дер-Ваальса.
Уравнение Ван-дер-Ваальса правильно описывает свойства реальных газов в достаточно большом интервале температур и давлений.
Изотермы Ван-дер-Ваальса
Уравнение Ван–дер–Ваальса можно преобразовать к виду
V3 − в+ RTP V2 + аp V − авp = 0 .

35
Это уравнение третьей степени относительно V . Семейство теоретических изотерм имеет следующий вид.
Вотличие от изотерм идеального газа, которые являются гиперболами, изотермы газа Ван-дер-Ваальса изображаются сложными кривыми.
Вобласти малых давлений и больших объемом изотермы реального газа совпадают с изотермами идеального газа.
Характерной особенностью изотерм реального газа являются наличие критической изотермы при температуре Tk . Этой температуре соответствует Vk
иpk .
При T < Tk все изотермы идут немонотонно, а при T > Tk изотермы имеют монотонный характер.
На рисунке приведена экспериментально полученная изотерма при температуре меньшей Tk .

36
В действительности на участке 1-5 наблюдается горизонтальный участок. При V > V1 в объеме находится газ.
При V < V5 газ конденсируется в жидкость.
При V5 < V < V1 в объеме находится газ и жидкость, возникающая при
частичной конденсации газ.
Состояние 1-2-3-4-5 является неустойчивым и не наблюдается.
Внутренняя энергия реального газа
Внутренней энергией газа Ван-дер-Ваальса называется величина, равная суммарной энергии взаимодействия молекул.
υ = Wк + Wвз .
Рассмотрим адиабатный процесс, считая газ идеальным. dQ = dυ+ pdV , dQ = 0 ,
dυ = −pdV ,( )
dυ = dWk , dWk = −pdV . ( )
Теперь учтем «реальность» газа
υ = Wк + Wвз ,
dυ = dWк +dWвз .
В ( ) нужно заменить давление идеального газа на давление реального
газа
|
|
ν |
2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
2 |
|
|
|
|
|||
dυ = − p − |
V |
|
|
а dV , |
|
||||||
|
|
|
|
|
|
|
|
||||
|
|
|
ν |
2 |
|
|
( ) |
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
2 |
|||||
dWk +dWвз = − p − |
|
V |
а dV . |
||||||||
|
|
|
|
|
|
|
|
||||
Из ( ) вычислим ( )
dWвз = −pdV + ν2 аdV + pdV , V2
dWвз = ν2а dVV2 ,
Интегрируем:
Wвз = − ν2а +const . V

37
Пусть V → ∞, при этом мы переходим к модели идеального газа, в котором отсутствует взаимодействие между молекулами и
Wвз = 0 , V → ∞.
Отсюда const = 0 Следовательно,
Wвз = − ν2 а .
V
Запишем
υ = Wк + Wвз = νCМT − ν2 а ,
V
υ = νCVT − ν2 а ,
V
υ= ν СVT − Vν а .
Вотличие от идеального газа температура реального газа может изменяться даже в том случае, если υ = const за счет изменения объема.
Фазовые переходы
Экспериментально изучая изотермы реального газа можно установить, что вещество при одинаковых условиях может находиться в различном состоянии: жидком и газообразном. При этом говорят, что вещество находится в различных фазах.
Фазой называется часть системы, ограниченная поверхностью раздела с одинаковыми физическими свойствами во всех своих точках.
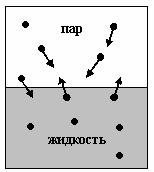
Газообразная фаза возникает за счет того, что молекулы жидкости покидают жидкую фазу вещества.
Возникающий при этом газ называется паром.
Если две или несколько фаз вещества существуют одновременно и при этом масса одной фазы не увеличивается за счет массы другой фазы, то вещество находится в фазовом равновесии.

38
Переход вещества из одной фазы в другую называется фазовым переходом или фазовым превращением.
Если при фазовом переходе система получает или отдает некоторое количество энергии, то имеет место фазовый переход первого рода. При этом физические характеристики системы изменяются скачкообразно.
В случае фазовых переходов второго рода происходит непрерывное изменение физических параметров системы при отсутствии теплоты перехода.
Теплота, связанная с фазовым переходом первого рода, называется теплотой перехода Qпер .
Испарение, плавление
Процесс перехода жидкости в пар называется испарением и характеризуется теплотой парообразования.
Опыт дает, что испарение со свободной поверхности жидкости или твердого тела происходит при любой температуре.
Частным случаем испарения является кипение, которое происходит при постоянной температуре кипения Tк .
Теплота парообразования при кипении определяется законом
Qпар = λm .
m - масса испарившейся жидкости, кг
λ - удельная теплота парообразования, Джкг
Переход из газообразного состояния в жидкое называется конденсацией и определяется законом:
Qконд = −λm .
Переход вещества из твердого состояния в жидкое называется плавлением и характеризуется теплотой плавления Qпл
Qпл = гm .
m -масса твердого вещества, перешедшего в жидкую фазу. г - удельная теплота плавления.
Плавление характеризуется также постоянной температурой плавления
Tпл .
Переход вещества из жидкого состояния в твердое называется кристаллизацией.
Qкрист = −гm .
39
Равновесие жидкости и пара
Пусть в некотором замкнутом объеме одновременно находятся две фазы вещества: жидкость и ее пар. Молекулы непрерывно переходят из жидкости в пар и обратно.
При таких условиях система может находиться в равновесии, если отдельные части ее обмениваются частицами?
Запишем уравнение первого начала термодинамики в виде. dυ = dQ −pdV .
Если число частиц системы N изменяется, то для dυ можно записать dυ = dQ −pdV +µdN ,
где dN - приращение частиц системы, µ - химический потенциал системы.
Величина µ имеет смысл энергии, которую «приносит» («уносит») с собой одна частица.
Условие равновесия двух фаз имеет вид:
T1 = T2 , p1 = p2 , µ1 = µ2 .
Геометрическое место точек на диаграмме (p,T), для которых выполняется условие µ1 = µ2 , называется кривой фазового равновесия.

40
Для системы жидкость – пар кривая фазового равновесия имеет следующий вид.
Параметры состояния p,T связаны формулой Клапейрона Клаузиуса:
dp |
= |
λм |
|
, |
dT |
(V −V |
)T |
||
|
|
п ж |
|
|
где p - давление пара, находящегося в равновесии с жидкостью (насыщенный пар).
λм - молярная теплота парообразования (конденсации), мольДж
Vп,Vж - молярные объемы пара и жидкости.
При не очень высоких температурах плотность насыщенного пара такова, что свойства газа приближаются к свойствам идеального газа
pVп = RT,Vп = RTp ,
Vп >> Vж ,
dp = λм = λмp , dT VпT RT2
dp |
= |
λмp |
, |
dp |
= |
λм |
|
dT |
, |
dT |
|
RT2 |
|
p |
|
R T2 |
|
||
