
02_Молекулярная_физика
.pdf
11
nkT = Σk ni kT ,
i=1
n = Σk ni .
i=1
Аналогично
νRT = k ν RT V Σi=1 iV ,
ν = Σk νi .
i=1
12
ГЛАВА 2. КЛАССИЧЕСКИЙ ИДЕАЛЬНЫЙ ГАЗ
Классический идеальный газ (идеальный газ) – система, состоящая из очень большого числа невзаимодействующих между собой на расстоянии частиц – молекул. Молекулы идеального газа находятся в непрерывном хаотичном движении, сталкиваясь между собой. При столкновении скорость молекул изменяет свою величину и направление случайным образом. В промежутках между столкновениями молекулы движутся прямолинейно и равномерно.
Идеальный газ представляет собой одну из основных моделей, с помощью которых изучаются свойства макросистем. Понятие «идеальный газ» применяется не только для изучения газов, но в более широком смысле для других макросистем. Например, поведение электронов в некоторых случаях хорошо описывается в модели идеального газа, и тогда говорят об идеальном газе электронов.
Число степеней свободы объекта
Наименьшее число независимых координат, однозначно определяющих положение объекта в пространстве называется числом степеней свободы i.
Положение простейшего объекта механики – материальный точки можно определить, указав три его координаты в пространстве. В этом случае материальная точка имеет три степени свободы, которые называют поступательными.
13
Положение твердого тела можно задать, если известны три координаты (x, y,z) центра масс тела и три угла (α,β, γ), которые оси тела образуют с осями системы координат. В этом случае объект имеет 3 поступательные степени свободы (iп = 3) и 3 вращательные степени свободы (iв = 3) .
Число степеней объекта равно
i = iп +iв .
Число степеней свободы молекул идеального газа.
п.1 Одноатомная молекула
Одноатомные молекулы имеют инертные газы, например: He,Ne,Ar и т.д. Одноатомная молекула идеального газа – это материальная точка, которая может совершать только поступательное движение, представляющее сумму независимых движений вдоль осей x,y, z декартовой системы координат. Итак, одноатомная молекула имеет три степени свободы, которые являются поступательными степенями свободы
iп = 3, iв = 0,
i = iп +iв = 3 , i = 3.
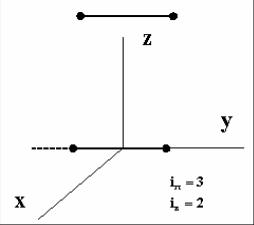
п.2 Двухатомная молекула с жесткой связью |
|
||
Двухатомными молекулами |
являются |
молекулы таких газов, |
как |
N2 ,O2 ,H2 . Если расстояние между |
атомами |
остается неизменным, то |
связь |
между атомами называется жесткой. Сами атомы рассматриваются как материальные точки. Такая молекула совершает поступательное движение и, следовательно, имеет поступательные степени свободы
iп = 3.
14
Кроме того, молекула может участвовать и во вращательном движении, следовательно, у нее есть и вращательные степени свободы. Сколько их? Очевидно, что возможно вращение вокруг оси 2 и оси x . А вращение вокруг оси y не имеет смысла, ведь атомы – материальные точки и такое вращение не приводит к изменению состояния молекулы. Итак, двухатомная молекула с жесткой связью имеет две вращательные степени свободы
iв = 2 .
Всего, число степеней свободы равно
iп = 3, iв = 2 ,
i = iп +iв = 5, i = 5 .
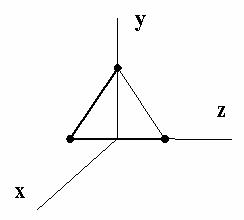
п.3 Многоатомная молекула с жесткими связями
К многоатомным молекулам относят молекулы, содержащие 3 и более атомов: CO2 , H2O, NH3 . Очевидно, что для таких молекул
iп = 3, iв =3, i = iп +iв , i = 6.
15
В заключение отметим, что любая молекула всегда имеет три степени свободы, связанные с поступательным движением.
Распределение энергии молекул по степеням свободы
С каждой степенью свободы молекулы связано движение, которое может совершать молекула. Например, молекула может двигаться поступательно, при этом изменяются ее координаты (x, y,z) и молекула может совершать
вращательное движение, так что координаты (α,β, γ) изменяются со временем. С каждым видом движения связана кинетическая энергия. Пусть молекула, имеющая i степеней свободы, участвует в i независимых движениях, так что
ε = ε1 + ε2 +... + εi ,
где ε- кинетическая энергия молекулы
ε1,ε2 ,...εi - кинетическая энергия молекулы в 1, 2, i -ом движении.
Очевидно, что величины ε1,ε2 ,...εi будут различными для разных молекул
системы. Обозначим
(N1 )1 - число молекул, для которых кинетическая энергия 1-го движения равна (ε1 )1 .
(N1 )2 - число молекул, для которых кинетическая энергия 1-го движения равна (ε1 )2 .
(N1 )k - число молекул, для которых кинетическая энергия 1-го движения
равна (ε1 )k .
(N1 )n - число молекул, для которых кинетическая энергия 1-го движения равна (ε1 )n .
Найдем среднее значение кинетической энергии 1-го движения

16
ε1 = |
(ε1 )1 (N1 )1 |
+ (ε1 )2 (N1 )2 |
+... + (ε1 )k (N1 )k +... + (ε1 )n (N1 )n |
= |
1 |
Σn (ε1 )k (N1 )n . |
|
(N1 )1 + (N1 )2 |
+... + (N1 )k +... + (N1 )n |
|
|||
|
|
|
N k=1 |
|||
Аналогично можно найти среднее значение кинетической энергии 2, 3, i - го движения. Оказывается, что
ε1 = ε2 = εi = 12 kT .
В равновесной макроскопической системе на каждую степень свободы каждой молекулы приходится одна и та же средняя кинетическая энергия, равная
ε1 = kT2 ,
где k - постоянная Больцмана, T - температура системы
Средняя энергия молекулы
Пусть молекула имеет i степеней свободы. Кинетическая энергия молекулы равна
ε = ε1 + ε2 +... +εi ,
где ε - средняя кинетическая энергия молекулы
ε1 , ε2 ,... εi - средняя кинетическая энергия 1,2,…i -го движения
Очевидно, что
ε = ε1 i = 12 kT ,
ε = 2i kT .
Средняя кинетическая энергия поступательного и вращательного движения равна
εn |
= |
in |
kT , |
|
|||
|
2 |
|
|
|
in = 3, |
||
εп = |
|
3 |
kT , ( ) |
|||
2 |
||||||
|
|
|
||||
εв = |
iв |
|
kT . |
|||
|
||||||
|
|
2 |
|
|
||
17
Из ( ) следует, что температура T есть величина, пропорциональная средней кинетической энергии поступательного движения молекул.
Внутренняя энергия идеального газа
Внутренняя энергия идеального газа есть величина, равная сумме кинетических энергий молекул идеального газа.
|
|
N |
|
|
|
|
|
i |
|
|
|
|||||||
U = |
Σεj |
= N ε = N |
|
|
|
|
|
kT , |
||||||||||
2 |
|
|||||||||||||||||
|
j=1 |
|
|
|
i |
|
|
|
|
|
|
|||||||
|
|
|
|
U = N |
kT , |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|||
U = |
|
|
N |
|
i |
kNA T = ν |
i |
|
RT , |
|||||||||
|
NA |
|
|
|
|
|||||||||||||
|
|
2 |
|
|
|
|
2 |
|
|
|
||||||||
U = ν |
i |
RT , U = |
m |
|
i |
|
RT . |
|||||||||||
|
M |
|
|
|||||||||||||||
|
2 |
|
|
|
|
|
|
2 |
|
|||||||||
Внутренняя энергия идеального газа определяется его температурой и является функцией состояния.
Для смеси газов, очевидно
U = Σk υi ,
i=1
где U - внутренняя энергия смеси газов;
Ui - внутренняя энергия i -го компонента смеси
Количество теплоты
Совокупность тел, рассматриваемая при некоторых условиях, называется системой тел или системой. Если между системой и телами не входящими в систему отсутствует обмен энергией, то система называется изолированной.
Рассмотрим изолированную систему из двух сосудов 1 и 2 с идеальными газами при температурах T1 и T2 . Пусть T1 < T2
Uн = ν |
|
i1 |
RT , Uн = ν |
|
i2 |
RT . |
|
|
2 |
|
2 |
||||
1 |
1 |
1 |
2 |
2 |
2 |
||

18
Приведем сосуды в контакт. Опыт дает, что через некоторое время газ в обоих сосудах будет иметь одинаковую температуру T , причем
T2 < T < T1 .
Запишем
U1k = ν1 i21 RT , Uk2 = ν2 i22 RT ,
∆U1 = U1к − U1н = ν1 i21 R(T −T1 )< 0 , ∆U2 = Uк2 − Uн2 = ν2 i22 R(T2 − T)> 0 .
Внутренняя энергия газа в 1 сосуде уменьшилась, а в сосуде 2 увеличилась, по сравнению с первоначальными значениями.
Обозначим U - внутренняя энергия системы
U = U1 + U2 .
Поскольку система изолирована, то
U = const , U1 + U2 = const ,
∆U1 + ∆U2 = 0,
∆U2 = −∆U1 .

19
Внутренняя энергия газа в одном сосуде увеличилась за счет убыли внутренней энергии газа в другом сосуде, т.е. происходит обмен внутренней энергией между газами.
Процесс обмена внутренней энергией называется теплообменом (теплопередачей). Энергия, которой обмениваются тела при теплообмене называется количеством теплоты или теплотой, Q, Дж
Если тело получает теплоту, то Q > 0, если отдает, то Q < 0.
Теплоемкость
Пусть система получает элементарное количество теплоты dQ , при этом ее температура получает приращение dΤ.
Опыт дает, что dQ и dΤсвязаны законом
dQ = CсистdT ,
где коэффициент пропорциональности Cсист называется теплоемкостью системы
Cсист = dQdT , ДжК .
Проинтегрируем
T2
Q = ∫ CсистdT , Дж.
T1
Если Cсист = const
T2
Q = Cсист ∫ dT = Cсист (T2 −T1 ),
T1
Q = Cсист (T2 −T1 ).
Здесь Q – количество теплоты, полученное системой, в результате чего температура системы увеличилась от начального значения T1 до некоторого значения T2 . Разделим обе части ( ) на массу системы m .
Cmсист = mdTdQ .
Величина в левой части имеет смысл теплоемкости единицы массы системы и называется удельной теплоемкостью Су .

20
Су = Сmсист , кгДжК ,
dQ = CуmdT , Q = Cуm(T2 −T1 ).
Разделим на количество вещества ν
Cνсист = νdQdT .
Полученная величина есть теплоемкость одного моля вещества или молярная теплоемкость С.
C = |
Cсист |
, |
Дж |
, |
|
ν |
моль К |
||||
|
|
|
dQ = νCdT , Q = νC(T2 −T1 ).
Запишем:
Cсист = Cуm ,
Cсист = Cν = C Mm .
Откуда
Cуm = СMm , Cу = MC .
Теплоемкость смеси газов
Пусть система, состоящая из смеси газов получает элементарное количество теплоты dQ, в результате чего ее температура получает приращение
dT .
Пусть C1, C2 ,...Ck - молярные теплоемкости 1-го, 2-го… k - го компонента смеси. Обозначим dQ1, dQ2 ,...dQk - количество теплоты, полученное 1-м, 2-м… k - м компонентами. Очевидно, что можно записать
dQ = dQ1 + dQ2 +... +dQk ,
dQ1 = ν1C1dT ,
