
02_Молекулярная_физика
.pdf
21
dQ2 = ν2 C2 dT ,
…
dQk = νk Ck dT , dQ = νсмCсмdT ,
где νсм - количество вещества смеси
Ссм - молярная теплоемкость смеси
νсмСсмdT = ν1C1dT + ν2 C2 dT +... + νk Ck dT ,
Cсм |
= |
|
ν1С1 + ν2 |
С2 |
+... + νk Ck |
, |
|
|
|
|
|
|
|||
|
|
|
|
νсм |
|||
|
νсм = ν1 + ν2 +... + νk , |
||||||
Cсм |
= |
|
ν1С1 + ν2 |
С2 |
+... + νk Ck |
. |
|
|
ν1 + ν2 |
|
|||||
|
|
|
+...νk |
||||
Равновесный процесс
Переход системы из одного состояния в другое называется процессом. Пусть идеальный газ находится в цилиндрическом сосуде с подвижным поршнем.
Газ находится в равновесном состоянии и характеризуется функциями состояния p,V,T . Предположим, что поршень быстро вдвигают. При этом газ будет сжиматься и вблизи поршня давление повысится и станет равным p′, в то время как в удаленных от поршня точках останется равным p .
В таком случае функции состояния уже не имеют определенного значения, и состояние системы оказывается неравновесным. Предположим, что поршень вдвигают медленно, то давление в разных точках будет мало
22
отличаться и, пренебрегая этим различием, можно считать состояние системы равновесным.
В пределе, при бесконечно медленном сжатии функции состояние идеального газа в каждый момент времени имеют определенное значение, соответствующие некоторому равновесному состоянию. Такой процесс можно рассматривать как последовательность равновесных состояний.
Бесконечно медленный процесс, состоящий из последовательности равновесных состояний системы, называется равновесным или квазистатическим процессом.
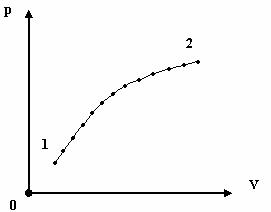
Возьмем две взаимноперпендикулярные оси, по которым откладываются давление и объем. Пусть в некотором состоянии 1 идеальный газ имеет давление p1 и объем V1 . Нанесем на плоскости pV точку с координатами (p1, V1 ).
Эта точка однозначно определяет состояние системы, т.к. температуру T , можно определить из уравнения состояния
F(p1 , V1 ,T1 )= 0.
Очевидно, что так можно задать состояние системы только в том случае, если p,V,T имеют определенное значение, т.е. система находится в равновесном
состоянии. Предположим, что система участвует в равновесном процессе. Рассматривая его как последовательность равновесных состояний,
нанесем на pV - плоскость соответствующие точки, расположенные бесконечно близко друг к другу.
При этом получим кривую 12, которая называется графиком или диаграммой равновесного процесса, при котором система переходит из равновесного состояния 1 в равновесное состояние 2.
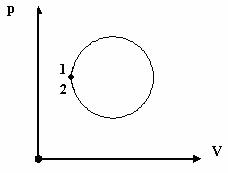
Процесс, при котором система после ряда изменений возвращается в исходное состояние, называется круговым процессом или циклом.
23
Графиком цикла является замкнутая кривая.
Процесс, при котором изменение функций состояния можно считать бесконечно малым или элементарным, называется элементарным процессом. При этом всякий процесс можно рассматривать как последовательность элементарных процессов.
Работа при изменении объема идеального газа
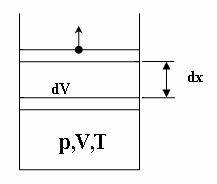
Рассмотрим газ в цилиндрическом сосуде с подвижным поршнем площадью S . Газ характеризуется величинами p,V,T . На поршень со стороны газа действует сила
F = pS.
Освободим поршень. Под действием силы F поршень совершает элементарное перемещение dx . При этом объем, заполненный газом, получил приращение
dV = S dx .
Пусть перемещение происходит очень медленно и при этом выполняется условие
dV << V .
В этом случае сила F , действующая на поршень, остается практически неизменной и при перемещении поршня оно совершает элементарную работу
dA = F dx = p S dx = p dV .
24
Элементарная работа, совершаемая идеальным газом при расширении (сжатии) равна
dA = p dV , Дж.
При расширении: dV > 0,dA > 0 .
При сжатии: dV < 0,dA < 0 .
Работа, совершаемая газом при конечном перемещении поршня, очевидно, равна
A12 = ∫2 pdV .
1
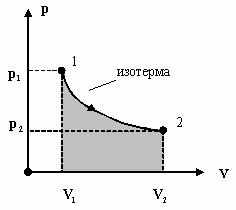
Рассмотрим равновесный процесс 12 по пути a , или 1a2 . Очевидно, что величина pdV имеет смысл площади бесконечно узкой полоски шириной dV и высотой p , а интеграл численно равен площади фигуры на графике
A1a2 = S(V1 −1−a − 2 −V2 ).
Из соотношения 1 в состояние 2 система может перейти другим способом
–путем, например 1в2.
Вэтом случае работа, совершаемая газом, равна
A1вв = S(V1 −1−в−2 − V2 ).
Очевидно, что площади фигур не равны и
A1a2 ≠ A1в2 .
Работа, совершаемая идеальным газом, зависит от способа или пути, которым газ переходит из начального состояния в конечное состояние и является функцией процесса.

25
Работа идеального газа в изопроцессах
Процесс, при котором один параметр системы остается постоянным, называется изопроцессом.
1. Изохорический (изохорный) процесс: V = const .
A12 = ∫2 pdV ,
1
V = const , dV = 0, A12 = 0 .
2. Изобарический (изобарный) процесс: p = const .
A12 = ∫2 pdV = p∫2 dV = p(V2 −V1 ),
1 |
1 |
|
A12 = p(V2 −V1 ). |
26
3. Изотермический процесс: T = const .
|
|
|
|
A12 = ∫2 |
pdV , |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
1 |
|
|
|
|
|
νRT |
|
|
|
|
|
||||||
|
|
pV = νRT , |
p = |
, |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
νRT |
|
|
|
|
V2 dV |
V |
|
|
|
|
|
||||||||||
2 |
dV |
|
|
|
= νRTlnV |
|
V |
, |
||||||||||||||
|
|
|
|
|||||||||||||||||||
A12 = ∫1 V |
= νRTV∫1 V |
|
|
V1 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
A12 |
= νRTln |
V2 |
, |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
p1V1 |
|
p2 V2 |
|
|
|
|
|
V1 |
|
|
|
|
|
|||||||
|
|
= |
|
, |
V2 |
|
= |
p1 |
, |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
T |
|
|
T |
|
V |
|
|
|
p |
2 |
|
|
|
|
||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
A12 |
= νRTln |
p1 |
. |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
p2 |
|
|
|
|
|
||||||
Первое начало термодинамики
Пусть система получает количество теплоты dQ . При этом изменяется
температура системы и, следовательно, внутренняя энергия dU . Кроме того, при расширении или сжатии совершается работа dA .
Опыт дает, что:
Количество теплоты dQ , получаемое системой, расходуется на
приращение внутренней энергии системы dU и на работу, совершаемую системой dA
dQ = dU +dA , dQ = dU + pdV .
Это утверждение называется первым началом термодинамики.

27
Просуммировав, получим
∫2 dQ = ∫2 dU + ∫2 dA ,
1 |
1 |
1 |
где 1 – обозначает начальное состояние системы 2 – обозначает конечное состояние системы
Интегрирование дает:
Q12 =(U2 − U1 )+ A12 .
Q12 - количество теплоты, полученное системой в процессе.
(U2 − U1 ) - приращение внутренней энергии системы в процессе. A 12 - работа, совершаемая системой в процессе.
Молярные теплоемкости идеального газа
Рассмотрим процесс, при котором объем остается неизменным
V = const , dV = 0, dQ = dU + pdV = dU .
Обозначим теплоемкость (молярную) -Cv
dQv = νCv dT , dU = ν2i RdT ,
νCvdT = ν2i RdT , Cv = 2i R .
Рассмотрим теперь процесс, при котором p = const и обозначим молярную теплоемкость Сp .
dQ = dU + pdV ,
dQp = νCp dT , dU = ν2i RdT , pV = νRT , pdV = νRdT ,
νCp dT = ν 2i RdT + νRdT ,

28
Cp = 2i +1 R .
Очевидно, что
Cp = Cv + R .
Здесь
Cv - молярная теплоемкость идеального газа при постоянном объеме. Сp - молярная теплоемкость идеального газа при постоянном давлении.
Запишем:
Сp = γ.
Сv
Величина γ называется отношением молярных теплоемкостей
идеального газа при постоянном давлении и постоянном объеме, а также показателем адиабаты идеального газа.
Величина γ позволяет |
получить |
|
информацию о строении молекулы |
|||||||||||||||||
идеального газа |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
Сp |
|
|
|
|
+ |
1 R |
|
|
i + 2 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
γ = |
= |
2 |
|
|
|
|
|
= |
|
, |
|||||||
|
|
|
СV |
|
|
|
|
|
i |
|
|
|
|
i |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
γ = |
i + 2 |
, |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
||||
|
|
|
|
|
|
i =3,γ = |
5 =1,67 , |
|||||||||||||
|
|
|
|
, |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
, |
i =5,γ = |
7 =1,4, |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
, |
|
i = 6,γ = 8 |
=1,33, |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
Зная значениеγ , можно определить число степеней свободы молекулы i . Если i не равно ни одному из значений, то газ представляет смесь одно-, двух- и многоатомных молекул.

29
Запишем еще одно очевидное соотношение для внутренней энергии идеального газа
U = ν2i RT , dU = νCv dT ,
U = νСV RT , dU = νCV dT .
Политропический процесс
Процесс, при котором теплоемкость остается постоянной, называется политропическим.
Запишем:
dQ = dU + pdV , dQ = νCdT , dU = νCv dT , νCdT = νCV dT + pdV ,
где C – молярная теплоемкость в данном процессе, и С = const
|
C = C |
|
+ |
pdV |
, |
|
|
|
|
|||||
|
V |
|
|
|
|
|
||||||||
|
|
|
|
|
|
νdT |
|
|
||||||
|
pV = νRT , T = |
pV |
, |
|
|
|
||||||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
νR |
|
|
|||
|
pdV + Vdp |
|
|
pdV + Vdp |
||||||||||
dT = |
|
|
|
|
|
= |
|
|
, |
|||||
|
νR |
|
|
ν(Cp −Cv ) |
||||||||||
C = Cv |
+ |
pdVν(Cp −CV ) |
, |
|
||||||||||
ν(pdV + Vdp) |
|
|
||||||||||||
CpdV + CVdp = CV pdV +CVVdp + Cp pdV −CV pdV ,
(CpdV −Cp pdV)+(CVdp −CV Vdp)= 0 ,
(C −Cp )pdV + (C −CV )Vdp = 0.
Разделим обе части на (C −CV )pV :
|
C −Cp dV |
|
dp |
|
||
|
|
|
|
+ |
|
= 0 . |
|
|
|
||||
|
|
|
V |
p |
||
C −CV |
|
|
||||
Обозначим:
n = C −Cp , C −CV
n dVV + dpp = 0 ,
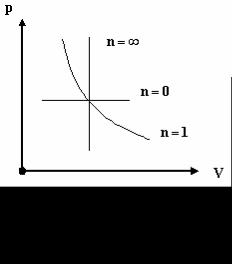
30
d(lnVn + ln p)= 0 , d(ln pVn )= 0,
pVn = const .
Полученное уравнение называется уравнением политропического процесса или уравнением политропы, n - показатель политропы.
Запишем:
n = C −Cp , C −CV
nC − nCV C −Cp , nC −C = nCV −Cp .
Рассмотрим несколько случаев.
1. n = 0, pVn |
|
= const, p = const , |
|
|||||||||||||||||
C = |
0 CV −Cp |
|
= Cp , C = Cp . |
|
|
|||||||||||||||
0 −1 |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2. n =1, |
pV = const , |
pV |
= const , |
T = const , |
||||||||||||||||
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
C = |
1 CV −Cp |
= |
CV −Cp |
|
|
= ∞, C = ∞. |
||||||||||||||
1−1 |
|
0 |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
3. n = ∞, |
pVn |
|
= const , |
T = const , |
|
|||||||||||||||
1 |
V = const , |
|
p0 V = const , |
V = const , |
||||||||||||||||
p |
∞ |
|
||||||||||||||||||
|
|
|
nCV |
−Cp |
|
|
|
CV − |
Cp |
|
|
|
|
CV |
|
|
||||
С = |
= |
|
|
= |
= CV |
,C = CV . |
||||||||||||||
|
|
|
|
n |
||||||||||||||||
n −1 |
|
1 |
|
|
1 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
1− |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|||||
