
glava5
.pdf
ном объеме; r – плотность газа;  v
v – средняя арифметическая скорость молекул,
– средняя арифметическая скорость молекул,
 l
l – средняя длина свободного пробега молекул. Эти величины определяются по
– средняя длина свободного пробега молекул. Эти величины определяются по
следующим формулам
cV |
= |
i |
|
R |
, |
r = |
pM |
, |
v = |
8RT |
и l = |
|
1 |
, |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
2pd2n |
||||||||||
|
|
2 M |
|
RT |
|
pM |
|
||||||||
где n – концентрация молекул, которую можно выразит из равенства p = nkT .
Тогда выражение для  l
l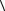 будет иметь вид
будет иметь вид
|
l = |
|
|
|
|
|
kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
2pd2p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Подставим все выражения в формулу для теплопроводности, получим |
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
l = |
1 |
|
i |
|
R |
|
pM |
|
|
8RT |
|
|
|
kT |
|
= |
i |
|
k |
|
|
RT |
, |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
3 2 M RT pM 2pd2p 3 d2 p3M |
|
|
|
|
||||||||||||||||||||||||||||||
где k = 1,38×10−23 Дж/К – |
постоянная Больцмана. Подсчитаем результат |
|||||||||||||||||||||||||||||||||||
|
5 ×1,38×10−23 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
l = |
Дж/К |
|
× |
|
8,31 Дж/(моль× К) × 273 К |
= 0,013 |
Вт/(м× К) = 13 |
мВт/(м× К) . |
||||||||||||||||||||||||||||
3×(3 |
×10−10 |
|
м)2 |
|
3,143 × |
0,029 кг/моль |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
Задача 3. Найдите коэффициент диффузии гелия при давлении 0,1 МПа и температуре 20° С. Диаметр молекул гелия 0,2 нм. Молярная масса гелия 4 г/моль.
Дано: |
|
|
|
СИ |
|
|
|
|
|
|
|
Решение |
||
p = 0,1 МПа |
|
105 Па |
|
|
|
Запишем формулу для коэффициента диф- |
||||||||
t = 20°C |
|
T = 293 К |
|
|
фузии газа |
|
|
|
|
|||||
d = 0,20 нм |
|
2×10–10 м |
|
|
|
D = |
1 |
|
< v >< l |
> , где v – средняя арифме- |
||||
M = 4 г/моль |
|
0,004 кг/моль |
|
3 |
||||||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
тическая скорость и |
l – средняя длина пробега |
||||
D = ? |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
молекул газа, выражения для которых имеют вид |
|||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
v = |
8RT |
|
и l = |
|
|
1 |
. |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||||||
|
|
pM |
2pd2n |
|
|
|
|
|||||||
Концентрацию молекул n выпазим из равенства p = nkT . Все подставим в фор-
мулу для коэффициента диффузии, получим

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT3 |
|
|
|
|
|
|
|
|
|
|
|
|
D = |
1 |
|
8RT kT |
|
|
= |
2k |
|
, |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
3 |
pM |
2 |
pd2p 3pd2 |
|
p3M |
|
|
|
|
|
|
|
|
|
|||||||||||||
где k = 1,38×10−23 Дж/К – |
|
постоянная Больцмана, R = 8,31 Дж/(моль× К) – |
универ- |
|||||||||||||||||||||||||||||
сальная газовая постоянная. Подставим числовые значения |
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
2 ×1,38×10−23 Дж/К |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
8,31 Дж/(моль×К) ×(293 К)3 |
−5 |
2 |
|
2 |
|
|||||||||||||||||||||
D = |
|
|
|
|
|
|
|
|
|
|
|
|
× |
|
|
|
|
|
|
|
|
|
= 9,4 ×10 |
|
м |
/с = 94 мм |
/с. |
|||||
|
×10 |
5 |
Па×(2 ×10 |
−10 |
м) |
2 |
3,14 |
3 |
×0,004 |
|
|
|||||||||||||||||||||
3 |
|
|
|
|
|
|
|
|
кг/моль |
|
|
|
|
|
||||||||||||||||||
Задача 4. Коэффициент вязкости кислорода при нормальных условиях ра-
вен 1,0×10–5 кг/(м×с). Чему равен при этих условиях коэффициент диффузии? Мо-
лярная масса кислорода равна 0,032 кг/моль.
Дано: |
|
|
Решение |
|
T = 273 К |
Запишем формулу, связывающую коэффициент вяз- |
|||
p = 105 Па |
кости и коэффициент диффузии газа |
|||
M = 0,032 кг/моль |
η = ρD , |
|||
h = 1,0 ×10−5 кг/(м×с) |
где r – плотность газа, которую выразим из уравнения Кла- |
|||
|
пейрона-Менделеева |
|||
D = ? |
||||
|
|
|
||
|
r = |
pM |
. |
|
|
||||
|
|
|||
|
|
RT |
||
Из первой формулы выразим коэффициент диффузии с учетом выражения для плотности газа
= η = ηRT D r pM .
В полученное равенство подставим числовые значения
D = 10−5 кг/(м×с) ×8,31 Дж/(моль× К) × 273 К = 7,1×10−6 м2 /с = 7,1 мм2 /c 105 Па ×0,032 кг/моль
Задача 5. Коэффициент теплопроводности кислорода при температуре 50° С
равен 3,0×10–2 Вт/(м×К). Вычислите коэффициент вязкости кислорода при этой
температуре. Молярная масса кислорода равна 0,032 кг/моль.

Дано:
t = 50°C
i = 5
l = 3,0 ×10−2 Вт/(м× К)
M = 0,032 кг/моль
η = ?
Решение
Запишем формулу, связывающую коэффициент теп-
лопроводности и коэффициент вязкости газа
λ = ηcV ,
ивыразим из нее коэффициент вязкости η = λ cV ,
cV ,
где cV – удельная теплоемкость газа при постоянном объ-
еме определяется выражением
cV = i R . 2 M
Подставим это равенство в формулу для вязкости
h = 2λM . iR
Подставим числовые значения
h = 2 ×3,0 ×10−2 Вт/(м× К) ×0,032 кг/моль = 4,6 ×10−5 Па ×с . 5 ×8,31 Дж/(моль× К)
Задача 6. Коэффициент теплопроводности трехатомного газа 1,5×10–2
Вт/м×К, а коэффициент диффузии при тех же условиях 1,2×10–5 м2/с. Определите концентрацию молекул газа при этих условиях.
Дано: |
|
|
|
|
|
|
Решение |
i = 6 |
|
|
Запишем формулу для коэффициента тепло- |
||||
l = 1,5 ×10 − 2 Вт/(м × К) |
проводности |
|
|
||||
D =1,2 ×10−5 м2 /с |
|
|
l = |
1 |
c |
|
r < v >< l > |
|
|
|
V |
||||
|
|
|
3 |
|
|||
n = ? |
и коэффициента диффузии газа |
||||||
|
|||||||
|
D = |
1 |
< v >< l > . |
||||
|
|||||||
|
|
||||||
|
3 |
|
|
|
|
|
|
Разделим первое равенство на второе

λ = cVr ,
D
где cV – |
удельная теплоемкость газа при постоянном объеме, r – плотность газа. |
||||||||||||||||||
Эти величины определяются следующими формулами |
|||||||||||||||||||
cV |
= |
|
i |
|
|
R |
и r = n |
M |
. |
|
|
||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
2 M |
|
|
NA |
|
|
|||||||||
Подставим эти два выражения в предыдущую формулу |
|||||||||||||||||||
|
λ |
= |
i |
|
R |
n |
M |
= |
iR |
n = |
ik |
n, |
|||||||
|
|
|
|
|
|
|
|||||||||||||
|
D |
|
2 M NA |
|
2NA |
2 |
|
||||||||||||
где k = 1,38×10−23 Дж/К – постоянная Больцмана. Из полученного равенства выра-
зим концентрацию молекул газа
n = |
2λ |
. |
|
|
|
||
|
ikD |
|
|
Подставим числовые значения |
|
||
n = |
|
2 ×1,5 ×10−2 Вт/(м× К) |
= 3,0 ×1025 м−3 . |
6 ×1,38×10−23 Дж/К×1,2 ×10−5 м2 /с |
|||
§ 28
Вакуум и методы его получения. Свойства ультраразреженных газов
Если из сосуда откачивать газ, то по мере понижения давления число столк-
новений молекул друг с другом уменьшается, что приводит к увеличению их дли-
ны свободного пробега. При достаточно большом разрежении столкновения ме-
жду молекулами относительно редки, поэтому основную роль играют столкнове-
ния молекул со стенками сосуда.
Вакуумом называется состояние газа, при котором средняя длина свободного пробега <l> сравнима или больше характерного линейного размера d сосуда, в
котором газ находится.
В зависимости от соотношения < l > и d различают низкий ( < l ><< d ),
средний ( < l >≤ d ), высокий ( < l >> d ) и сверхвысокий ( < l >>> d ) вакуум.
Газ в состоянии высокого вакуума называется ультраразреженным.

Вопросы создания вакуума имеют большое значение в технике, так как, на-
пример, во многих современных электронных приборах используются электрон-
ные пучки, формирование которых возможно лишь в условиях вакуума. Для получения различных степеней разрежения применяются вакуумные насосы. В на-
стоящее время применяются вакуумные насосы, позволяющие получить предва-
рительное разрежение (форвакуум) до ≈ 0,1 Па, а также вакуумные насосы и ла-
бораторные приспособления, позволяющие получить давление до 10 мкПа ÷ 1,0
пПа.
Принцип работы форвакуумного насоса представлен на рисунке. Внутри цилиндрической полости корпуса вращается эксцентрично насаженный цилиндр. Две лопасти 1 и 1',
вставленные в разрез цилиндра и раздвигаемые пружиной 2,
разделяют пространство между цилиндром и стенкой полости на две части. Газ из откачиваемого сосуда поступает в область 3, по мере поворачивания цилиндра лопасть 1 отходит, пространство
3 увеличивается и газ засасывается через трубку 4. При дальнейшем вращении лопасть 1' отключает пространство
3 от трубки 4 и начинает вытеснять газ через клапан 5
наружу. Весь процесс непрерывно повторяется.
Для получения высокого вакуума применяются диффузионные насосы (рабочее вещество – ртуть или масло), которые не спо-
собны откачивать газ из сосудов, начиная с атмосферного давления, но способны создавать добавочную разность давлений, поэтому их употребляют вместе с фор-
вакуумными насосами. Рассмотрим схему действия диффузионного насоса, пред-
ставленного на рисунке. В колбе ртуть нагревается, пары ртути, поднимаясь по трубке 1, вырываются из сопла 2 с большой скоростью, увлекая за собой молеку-
лы газа из откачиваемого сосуда (в нем создан предварительный вакуум). Эти па-
ры, попадая затем в «водяную рубашку», конденсируются и стекают обратно в ре-
зервуар, а захваченный газ выходит в пространство (через трубку 3), в котором уже создан форвакуум. Если применять многоступенчатые насосы (несколько

сопл расположены последовательно), то реально при хороших уплотнениях мож-
но с помощью них получить разрежение до 10 мкПа.
Для дальнейшего понижения давления применяются так называемые «ловушки». Между диффузионным насосом и откачиваемым объектом
располагают специально изогнутое колено (1 или 2)
соединительной трубки (ловушку), которую охлаждают жидким азотом, как показано на рисунке. При такой температуре пары
ртути (масла) вымораживаются и давление в откачиваемом сосуде понижается приблизительно на 1÷2 порядка. Описанные ловушки называют охлаждаемыми;
можно применять также неохлаждаемые ловушки. Специальное рабочее веще-
ство (например, алюмогель) помещают в один из отростков соединительной
трубки вблизи откачиваемого объекта, которое поддерживается при тем-
пературе 300° С. При достижении высокого вакуума алюмогель охлаждается до комнатной температуры, при которой он начинает поглощать имеющиеся в сис-
теме пары. Преимущество этих ловушек состоит в том, что с их помощью в отка-
чиваемых объектах можно поддерживать высокий вакуум уже после непосредст-
венной откачки в течение даже нескольких суток.
Остановимся на некоторых свойствах ультраразреженных газов. Так как в состоянии ультраразрежения молекулы практически друг с другом не сталкивают-
ся, то газ в этом состоянии не обладает внутренним трением. Отсутствие соударе-
ний между молекулами разреженного газа отражается также на механизме тепло-
проводности. Если при обычных давлениях перенос энергии молекулами произ-
водится «эстафетой», то при ультраразрежении каждая молекула сама должна пе-
ренести энергию от одной стенки сосуда к другой. Явление уменьшения тепло-
проводности вакуума при понижении давления используется на практике для соз-
дания тепловой изоляции. Например, для уменьшения теплообмена между телом и окружающей средой тело помещают в сосуд Дьюара, имеющий двойные стенки,
между которыми находится разреженный воздух, теплопроводность которого очень мала.
