
glava5
.pdf
Тогда давление газа будет равно
p = 1 n M  vкв
vкв  2 .
2 .
3 NA
Из полученного равенства выразим концентрацию молекул
n = 3pNA . M vкв
vкв  2
2
Число молекул газа определим через концентрацию по формуле
N = nV = |
3pV |
|
NA . |
|
|
|
||
M v |
2 |
|
|
|
||||
|
|
|
|
|
|
|||
|
|
кв |
|
|
|
|
|
|
Подставим числовые значения в полученную формулу |
||||||||
N = |
3×2 ×103 Па×0,003 м3 |
×6,02 ×1023 |
моль−1 |
= 2,1×1021 . |
||||
0,032 кг/моль×(400 м/с)2 |
||||||||
|
|
|
|
|||||
Задача 3. Колба вместимостью 2 л содержит некоторый газ массой 0,6 г под
давлением 100 кПа. Определите среднюю квадратичную скорость молекул газа.
Дано: |
|
|
|
СИ |
|
|
|
|
|
Решение |
|||||
V = 2 л |
0,002 м3 |
|
Запишем основное уравнение молекулярно- |
||||||||||||
m = 0,6 г |
6 ×10−4 кг |
кинетической теории идеального газа |
|||||||||||||
p =100 кПа |
105 Па |
|
p = |
1 |
nm0 vкв |
2 , |
|||||||||
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|||
vкв = ? |
|
|
|
|
|
|
|
|
где m0 – массу одной молекулы определим по формуле |
||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
m0 = m N , |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||
в которой N – |
|
число молекул газа, концентрация молекул по определению равна |
|||||||||||||
n = N V . |
|
|
|
|
|
|
|
|
|
|
|||||
Подставим выражения для m0 и концентрации в первую формулу, получим |
|||||||||||||||
p = |
Nm |
v |
2 = |
m vкв |
2 |
. |
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||||
|
3VN |
|
|
кв |
3V |
|
|
|
|
|
|||||
Отсюда выразим среднюю квадратичную скорость молекул |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
v = |
|
|
3pV |
. |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|||||||
кв |
|
|
|
m |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||

Подставим в полученное выражение числовые значения
|
3×105 |
Па×0,002 м3 |
|
v = |
|
|
= 1000 м/с . |
|
|
||
кв |
6 |
×10−4 кг |
|
|
|||
§ 23
Закон Максвелла для распределения молекул идеального газа по скоростям и энергиям теплового движения
По молекулярно-кинетической теории, как бы не изменялись скорости мо-
лекул при столкновениях, средняя квадратичная скорость молекул массой m0 в
газе, находящемся в состоянии равновесия при T = const , остается постоянной и равной
< v >= 3kT . |
|
кв |
m0 |
|
|
Это объясняется тем, что в газе, находящемся в состоянии равновесия, устанавли-
вается некоторое стационарное, не меняющееся со временем распределение моле-
кул по скоростям, которое подчиняется вполне определенному статистическому закону. Этот закон теоретически был выведен Дж. Максвеллом.
Максвелл предположил, что газ состоит из очень большого числа N тожде-
ственных молекул, находящихся в состоянии беспорядочного теплового движе-
ния при одинаковой температуре. Предполагалось также, что силовые поля на газ не действуют.
Закон Максвелла описывается некоторой функцией f(v) , называемой
функцией распределения молекул по скоростям. f(v) определяет относитель-
ное число молекул dN(v)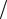 N , скорости которых лежат в интервале v ÷v + dv, т.е.
N , скорости которых лежат в интервале v ÷v + dv, т.е.
dN(v) = f(v)dv , N
откуда
f(v) = dN(v) . Ndv
Применяя методы теории вероятности, Максвелл нашел функцию f(v) –
закон для распределения молекул идеального газа по скоростям
|
m0 3 2 |
2 |
|
− |
m0v2 |
|
|
|
|
|
|
||||||
f(v) = 4π |
|
|
v |
e |
|
2kT . |
(23.1) |
|
|
||||||||
|
2πkT |
|
|
|
|
|
|
|
Условие |
нормировки |
|
выглядит |
следующим |
||||
образом
∞
∫f(v)dv =1.
0
Наиболее вероятная скорость молекул равна
v |
= |
2kT |
= |
2RT |
. |
(23.2) |
|
|
|||||
в |
|
m0 |
M |
|
||
|
|
|
||||
Для определения средней арифметической скорости молекул газа восполь-
зуемся функцией распределения
∞∞
<v >= 1 ∫vdN(v) = ∫vf(v)dv,
N 0 |
0 |
проинтегрировав которую по всем скоростям, получаем
< v >= |
8kT |
= |
8RT |
. |
|
|
|||
|
πm0 |
πM |
||
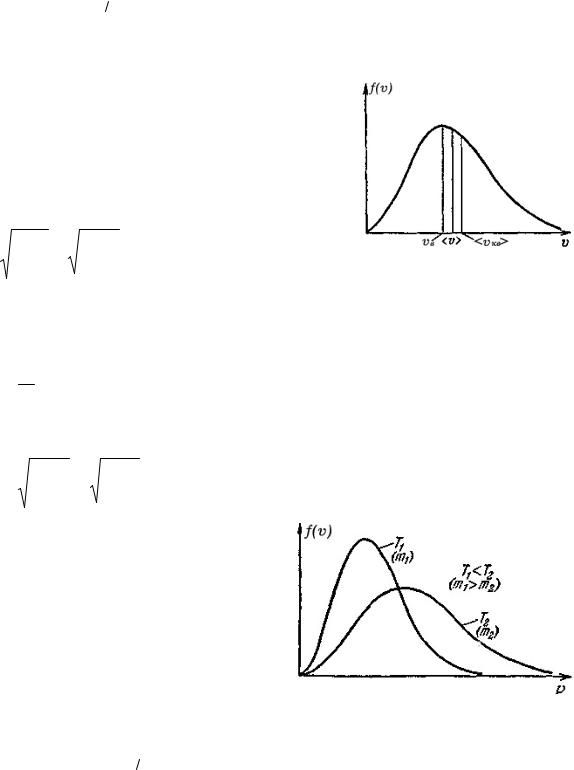
На рисунке сопоставлены две кривые
распределения, которые можно трактовать либо как относящиеся к различным темпера-
турам T1 и T2 (при одинаковой m ), либо как относящиеся к различным массам m1 и m2
(при одинаковой T ).
Исходя из распределения молекул по скоростям
|
m0 3 2 |
2 |
|
− |
m0v2 |
|
|
|
|
||||||
dN(v) = N4π |
|
|
v |
e |
|
2kT dv |
|
2πkT |
|||||||
(23.3)
(23.4)
можно найти распределение молекул газа по значениям кинетической энергии ε.

Для этого перейдем от переменной v к переменной e = m0 v2 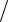 2 . Подставив в
2 . Подставив в
(23.4) v = 
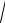 2e
2e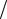 m0 и dv = de
m0 и dv = de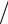

 2m0 e , получим
2m0 e , получим
dN(ε) = 2Nπ (kT)−3 2 ε1
2 ε1 2e−ε
2e−ε kTdε = Nf(ε)dε.
kTdε = Nf(ε)dε.
Из последнего выражения получим функцию распределения молекул по энергиям теплового движения, которая будет иметь вид
|
|
|
|
|
|
|
− |
ε |
|
f(ε) = |
2 |
|
|
ε |
|
||||
|
|
|
e kT . |
||||||
|
|
|
|
|
3 2 |
||||
|
π (kT) |
||||||||
|
|
|
|
|
|||||
Средняя кинетическая энергия <e> молекулы идеального газа с помощью этой функции может быть найдена следующим образом
∞ |
2 |
|
∞ |
3 |
|
|||
< e >= ∫ef(e)de = |
|
|
∫e3 2 e−ε kTde = |
kT. |
||||
|
|
|
3 2 |
|
||||
p(kT) |
2 |
|||||||
0 |
|
0 |
|
|||||
Задача 1. Найдите температуру углекислого газа, для которого распределе-
ние молекул по абсолютным скоростям имеет максимум при скорости 400 м/с.
Молярная масса газа равна 0,044 кг/моль.
Дано: |
|
|
|
|
Решение |
|
vв = 400 м/с |
Максимум распределения молекул по абсолютным |
|||||
M = 0,044 кг/моль |
скоростям соответствует наиболее вероятной скорости моле- |
|||||
|
кул газа, которую можно определить по формуле |
|||||
T = ? |
||||||
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
vв = |
2RT |
, |
|||
|
|
|||||
|
|
|
M |
|||
где R = 8,31 Дж/(моль×К) – универсальная газовая постоянная. Выразим из этой формулы температуру газа
T = Mvв2 .
2R
Подставим в полученное равенство числовые значения
T = 0,044 кг/моль×(400 м/с)2 = 424 К. 2 ×8,31 Дж/(моль× К)
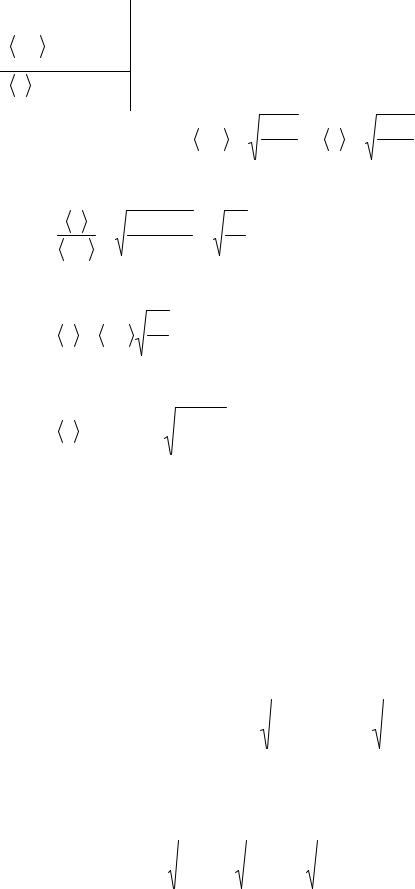
Задача 2. Определите среднюю арифметическую скорость молекул газа, ес-
ли их средняя квадратичная скорость равна 920 м/с.
Дано: |
Решение |
vкв = 920 м/с |
Запишем формулы для средней квадратичной и средней |
=арифметической скоростей молекул газа, соответственно
v ?
v = 3RT и v = |
8RT . |
|
кв |
M |
pM |
|
|
|
Разделим одно равенство на другое
v = |
8RTM = |
8 |
vкв |
pM3RT |
3p |
и выразим из полученного равенства среднюю арифметическую скорость
v = vкв |
8 . |
|
3p |
Подставим числовые значения
v = 920 м/с× |
|
8 |
= 848 |
м/с . |
|
×3,14 |
|||
3 |
|
|
||
Задача 3. При какой температуре воздуха средняя арифметическая скорость молекул азота и кислорода отличаются на 100 м/с? Молярная масса азота равна
0,028 кг/моль, кислорода – 0,032 кг/моль.
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Решение |
||||||
Dv = 100 м/с |
|
|
|
|
|
|
Запишем |
выражения |
для средних арифметических |
||||||||||||||||
M1 = 0,028 кг/моль |
скоростей молекул азота и кислорода, соответственно |
||||||||||||||||||||||||
M2 = 0,032 кг/моль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
= |
|
8RT |
|
|
и v2 = |
|
8RT |
|||||||||||||
|
|
|
|
|
|
|
v1 |
|
|
|
|
|
|
|
|
|
, |
|
|
||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
pM1 |
|
|
|
|
|
pM2 |
|||||||
T = ? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где R = 8,31 Дж/(моль×К) – |
универсальная газовая постоян- |
|||||||||||||||||||||
|
|
|
|||||||||||||||||||||||
ная. Найдем разность скоростей |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
- |
|
|
|
= |
|
|
|
. |
|||||||||||
Dv = v - v |
2 |
= |
|
8RT |
|
|
8RT |
|
|
8RT(M2 - M1 ) |
|
||||||||||||||
|
|
|
|||||||||||||||||||||||
1 |
|
|
|
pM1 |
|
|
pM2 |
|
|
|
pM1M2 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Из полученного равенства выразим температуру воздуха
T = πM1M2 ( v)2 . 8R(M2 −M1 )
Подставим числовые значения в полученное равенство
|
3,14 ×0,028 кг/моль×0,032 кг/моль×(15 м/с)2 |
T = |
8 ×8,31 Дж/(моль×К) ×(0,032 кг/моль - 0,028 кг/моль) = 106 К . |
Задача 4. На рисунке приведены две кривые распределение молекул CO2 и N2 по
абсолютным скоростям. Во сколько раз отличаются температуры T1 и T2 этих га- |
|
зов? |
|
Дано: |
|
M1 = 0,044 кг/моль |
|
M2 = 0,028 кг/моль |
|
v1 = 435 м/с |
|
v2 = 500 м/с |
Решение |
T1 T2 = ? |
Максимум распределения молекул по абсолютным ско- |
ростям соответствует наиболее вероятной скорости молекул газа. Запишем выра-
жения для наиболее вероятных скоростей молекул углекислого газа и азота, соот-
ветственно
v = |
2RT1 |
и v |
= |
2RT2 |
. |
|
|
||||
1 |
M1 |
2 |
|
M2 |
|
|
|
|
|||
Возведем оба равенства в квадрат и найдем отношение квадратов скоростей
v |
2 |
= |
2RT M |
= |
T M |
|
|||||
2 |
|
2 |
1 |
2 |
|
|
1 |
. |
|||
|
|
|
|
|
|
|
|
|
|||
v |
2RTM |
2 |
T M |
2 |
|||||||
1 |
|
|
1 |
|
1 |
|
|
|
|||
Из полученной формулы выразим отношение температур
T |
= |
M v2 |
|
||||
1 |
1 |
1 |
. |
|
|||
T |
|
|
|
||||
|
M |
v |
2 |
|
|
||
|
2 |
|
|
||||
2 |
|
2 |
|
|
|
||
T |
= |
0,044 кг/моль×(435 м/с)2 |
» 1,2 . |
||||
1 |
|
|
|
|
|||
T2 |
0,028 кг/моль×(500 м/с)2 |
||||||
|
|
||||||
§ 24
Барометрическая формула. Распределение Больцмана
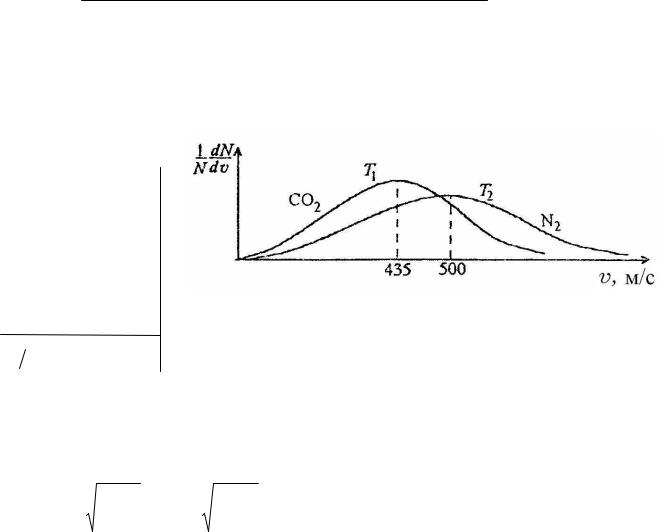
Получим закон изменения давления газа с высотой, |
|
предполагая, что поле тяготения однородно, температура |
|
постоянна и масса всех молекул одинакова. Разность дав- |
|
лений p и p + dp равна весу газа, заключенного в объеме |
|
цилиндра высотой dh с основанием площадью, равной |
|
единице площади |
|
p − (p + dp) = ρgdh , |
|
следовательно |
|
dp = −ρgdh . |
(24.1) |
Воспользовавшись уравнением состояния идеального газа pV = (m M)RT ,
M)RT ,
находим, что ρ = m V = pM (RT) . Подставив это выражение в (24.1), получим
dp = − Mg pdh, RT
или
dp = − Mg dh .
pRT
Проинтегрируем обе части последнего равенства
p2 |
|
dp |
|
= − |
Mg |
h2 |
|
|
|
|
|
|||||
∫ |
|
∫ dh |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||||
p |
|
p |
|
|
|
|
RT h |
|
|
|
|
|
||||
1 |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
||
и в результате получим |
|
|
|
|||||||||||||
|
|
p |
2 |
|
|
= − |
Mg |
|
|
− h ) . |
|
|
||||
ln |
|
|
|
|
|
|
(h |
2 |
|
|
||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
RT |
|
1 |
|
|
|||
|
|
p1 |
|
|
|
|
|
|
|
|
|
|||||
Выразим отсюда давление p2 |
|
|
||||||||||||||
p |
|
|
= p exp − |
Mg(h2 − h1 ) |
. |
(24.2) |
||||||||||
2 |
|
|||||||||||||||
|
|
|
1 |
|
|
|
|
|
RT |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Выражение (24.2) называется барометрической формулой. Она позволяет найти атмосферное давление в зависимости от высоты или, измерив давление, найти вы-
соту. Так как высоты обозначаются относительно уровня моря, где давление счи-
тается нормальным, то выражение (24.2) может быть записано в виде
|
|
Mgh |
|
|||
p = p0 |
exp − |
|
|
. |
(24.3) |
|
|
|
|||||
|
|
RT |
|
|||
Барометрическую формулу можно преобразовать, если учесть, что p = nkT |
||||||
|
|
Mgh |
|
|||
n = n0 |
exp − |
|
|
, |
|
|
|
|
|
||||
|
|
RT |
|
|||
где n – концентрация молекул на высоте h , n0 – |
концентрация молекул на высо- |
|||||
те h = 0 . Так как M = m0 NA , а R = kNA получаем |
|
|||||
|
|
m0gh |
|
|||
n = n0 |
exp − |
|
|
|
. |
(24.4) |
|
|
|
||||
|
|
kT |
|
|||
Учитывая, что m0gh = U – потенциальная энергия молекулы, получаем |
||||||
|
|
U |
|
|||
n = n0 |
exp − |
|
. |
(24.5) |
||
|
||||||
|
|
kT |
|
|||
Выражение (24.5) называется распределением Больцмана во внешнем потенци-
альном поле.
Задача 1. На какой высоте над поверхностью земли атмосферное давление в 1,5 раза меньше, чем на поверхности? Температура равна 7° С и не зависит от высоты, средняя молярная масса воздуха всюду равна 29 г/моль.
Дано: |
СИ |
|
|
|
|
|
|
Решение |
|
p0 p =1,5 |
|
Запишем барометрическую формулу |
|||||||
t = 7°C |
T = 280 К |
|
|
|
− |
Mgh |
|
||
|
|
||||||||
M = 29 г/моль |
0,029 кг/моль |
p = p0e RT . |
|||||||
Выразим отношение давлений воздуха |
|||||||||
|
|
||||||||
h = ? |
|
|
|
|
|
|
|
|
|
|
|
|
p0 |
|
Mgh |
||||
|
|
|
|
||||||
|
|
|
= e |
|
. |
||||
|
|
|
RT |
||||||
|
|
|
|
||||||
p
Прологарифмируем обе части равенства

p |
0 |
|
= |
Mgh |
|
ln |
|
|
|
||
|
|
|
|||
|
|
|
|
RT |
|
p |
|
|
|||
и из полученной формулы выразим высоту
h= RT ln(p0 p) .
Mg
Подставим числовые значения
h = 8,31 Дж/(моль × К) × 280 К × ln 1,5 = 3320 м . 0,029 кг/моль ×9,8 м/с2
Задача 2. Во сколько раз давление атмосферы на высоте 200 м больше, чем на высоте 2000 м? Примите молярную массу воздуха всюду равной 29 г/моль,
температуру неизменной и равной 0° С.
Дано: |
|
|
СИ |
|
|
|
|
|
|
|
Решение |
||||||||
t = 0°C |
|
|
T = 273 К |
Запишем |
барометрическую формулу для |
||||||||||||||
h1 = 200 м |
|
|
первой и второй высоты |
|
|
|
|
||||||||||||
h2 = 2000 м |
|
|
p = p |
− Mgh1 |
|
= p |
− Mgh2 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
e |
RT и p |
2 |
e RT . |
|||||||||||||||
M = 29 г/моль |
|
|
1 |
0 |
|
|
|
|
|
0 |
|
|
|
||||||
|
0,029 кг/моль |
Найдем отношение давлений |
|||||||||||||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p1 p2 = ? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
p1 |
= e |
Mg(h2 −h1 ) |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
RT . |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
p2 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В полученное выражение подставим числовые значения |
|
|
|
|
|||||||||||||||
|
p |
|
0,029 кг/моль×9,8 м/с2 ×(2000 м - 200 м) |
|
|
|
|
||||||||||||
|
1 |
|
= exp |
|
|
|
|
|
|
|
|
|
|
= 1,25 . |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
p2 |
|
8,31 Дж/(моль×К) × 273 К |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
Задача 3. При подъеме вертолета на некоторую высоту барометр, находя-
щийся в его кабине, изменил свое показание на 10 кПа. На какой высоте летит вертолет, если на взлетной площадке барометр показывал 100 кПа? Температура
280 К, молярная масса воздуха 0,029 кг/моль.
Дано: |
|
|
|
|
|
|
СИ |
|
|
|
|
|
Решение |
|||
T = 280 К |
|
|
|
|
|
|
|
|
Запишем барометрическую формулу |
|||||||
p =10 кПа |
|
|
|
104 Па |
|
|
−Mgh |
|||||||||
p0 =100 кПа |
|
|
105 |
|
p = p0e |
RT |
. |
|||||||||
|
|
Па |
Выразим отношение давлений воздуха |
|||||||||||||
M = 0,029 кг/моль |
|
|
|
|||||||||||||
|
|
|
|
|
|
Mgh |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
p0 |
|
||||
h = ? |
|
|
|
|
|
|
|
|
|
= e |
RT |
. |
||||
|
|
|
|
|
|
|
|
|
p |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Прологарифмируем обе части равенства |
||||||
|
|
|
|
|
|
|
|
|
|
|||||||
p |
0 |
|
= |
Mgh |
|
|
|
|
|
|
|
|
||||
ln |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
RT |
|
|
|
|
|
|
|
|
|||
p |
|
|
|
|
|
|
|
|
|
|
|
|||||
и из полученной формулы выразим высоту
h = RT ln(p0 p) . Mg
Поскольку с высотой давление воздуха уменьшается, то на высоте h давле-
ние будет равно |
|
|
|
|
|
|
|
|
|
|
|
|
||||
p = p0 − |
p . |
|
|
|
|
|
|
|
|
|
|
|
|
|||
Подставим это выражение в предыдущую формулу |
|
|||||||||||||||
|
RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
h = |
|
p0 |
|
|
|
|
|
|
|
|
|
|
||||
|
ln |
|
|
. |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Mg |
p0 |
- Dp |
|
|
|
|
|
|
|
|
|
|
|||
Подставим числовые значения в полученное равенство |
|
|||||||||||||||
|
8,31 Дж/(моль× К) × 280 К |
|
|
|
|
105 Па |
|
|
|
|
||||||
h = |
|
|
|
|
|
|
|
×ln |
|
|
|
|
|
|
|
= 860 м. |
|
|
|
|
|
|
2 |
|
|
5 |
|
4 |
|
||||
|
0,029 кг/моль×9,8 м/с |
|
10 |
Па -10 |
|
|
|
|||||||||
|
|
|
|
|
Па |
|
||||||||||
