
- •Морфология микроорганизмов
- •Ультраструктура прокариотической клетки
- •Любая питательная среда должна содержать необходимые для размножения легкоусвояемые вещества; иметь оптимальную влажность, вязкость, рН, быть изотоничной, прозрачной, стерильной биология вирусов
- •Течение инфекционного процесса
- •Метод иммуноблотинга (Western blot)
- •Аутоиммунные заболевания
- •9 «Микробиология.129
- •Нормальная микрофлора мочевыводящих путей
- •Нормальная микрофлора влагалища
- •Иммунобиологические препараты вакцины
- •Классификация вакцин по массовости и обязательности применения
- •Получение гетерологичных сывороток
- •Принципиальная схема иммунизации лошади
- •Основные принципы создания микробных биопрепаратов
- •1. Получение нужного гена:
- •Генная инженерия и конструирование новых организмов-продуцентов
Любая питательная среда должна содержать необходимые для размножения легкоусвояемые вещества; иметь оптимальную влажность, вязкость, рН, быть изотоничной, прозрачной, стерильной биология вирусов
ВЗАИМОДЕЙСТВИЕ ВИРУСОВ С КЛЕТКАМИ
Вирусные частицы, или вирионы являются инертными, статическими формами вируса. Когда вирионы находятся вне клетки, они не репродуцируются. В настоящее время известно три типа взаимодействия вирусов с клетками хозяина.
Продуктивныйтип взаимодействия заканчивается образованием вирусного потомства.
Абортивныйтип не завершается образованием вирусных частиц, поскольку инфекционный процесс прерывается и не сопровождается формированием инфекционного потомства.
Интегративныйтип взаимодействия вирусов с клеткой характерен для онкогенных вирусов, нуклеиновая кислота которых способна встраиваться (интегрироваться) в клеточную хромосому, вызывая трансформацию клеток. Границы между вирусами с автономной репликацией геномов и интеграционными вирусами довольно условны, и один и тот же вирус, в зависимости от вида клеток, может вести себя либо как инфекционный, либо как интеграционный геном. Результатом такого взаимодействия вируса и клетки является изменение наследственных свойств клетки. Данный тип взаимодействия вируса и клетки называютвироге-
60
нией,подобно лизогении при взаимодействии фагов с бактериями. Вирусы, способные вызывать вирогению, относят к группе умеренных.
Продуктивный тип взаимодействия вируса и клетки получил название репродукции вирусов (от англ. rерroduсе — воспроизводить).Репродукция вирусов —это образование по принципу комплементарности и путем репликации копий вирусных нуклеиновых кислот и индуцирование молекулами последних биосинтеза вирусных белков с последующей самоорганизацией этих компонентов в вирусные частицы.
Синтез и репликацию нуклеиновых кислот вирусов осуществляют ферменты. Используя нуклеотиды клетки, ферменты создают из них полинуклеотидные цепи новых молекул нуклеиновых. кислот вирусов. В зависимости от типа синтезируемых нуклеиновых кислот они называются ДНК-полимеразами или РНК-синтетазами. В некоторых случаях нуклеиновые кислоты вирусов реплицируются клеточными полимеразами — ферментами, присутствующими в клетке до ее заражения вирусом, хотя чаще репликацию вирусных нуклеиновых кислот осуществляют полимеразы, появляющиеся после заражения клетки вирусом. Такие полимеразы называют вирусспецифическими, так как биосинтез их закодирован в структуре нуклеиновых кислот самих вирусов. И, наконец, репликация нуклеиновых кислот некоторых вирусов происходит за счет предсуществующих в вирионе полимераз. Синтез вирусспецифических полимераз и вирусных структурных белков осуществляется на рибосомах клетки. Вирусные полимеразы, например РНК-репликазы, являются строго специфичными.
При большом разнообразии механизмов репродукции вирусов общим для них является то, что источником мономеров для синтеза и репликации нуклеиновых кислот служат нуклеотиды клетки. Источником мономеров для синтеза и построения белков всех вирусов являются аминокислоты, и синтез белков всех вирусов независимо от ультраструктуры их нуклеиновых кислот осуществляется в клеточных рибосомах. Источником энергии для биосинтетических процессов при репродукции вирусов является АТФ, которая вырабатывается в митохондриях клетки-хозяина.
Процесс репродукции вирусов включает шесть этапов: адсорбцию вируса на клетке; проникновение в клетку; депротеинизацию и освобождение вирусного генома; синтез вирусных компонентов в клетке-хозяине; сборку и формирование вирусов; выход зрелых вирусов из клетки.
Адсорбция,то есть прикрепление ви руса к клетке, осуществляется специфическими и неспецифическими механизмами. Неспецифический — определяется силами электростатического
61
взаимодействия. В этом процессе участвуют положительно заряженные аминные группы вирусного белка и кислые фосфатные группы клеточной поверхности, имеющие отрицательный заряд. Специфический механизм взаимодействия вируса и клетки обусловлен комплементарными клеточными и вирусными рецепторами. Вирусные рецепторы подразделяют на липопротеиновые (у арбовирусов) и мукопротеиновые (у миксовирусов и аденовирусов). Спектр чувствительности клеток к вирусам часто определяется наличием соответствующих рецепторов.
Резистентность клеток можно преодолеть путем разрушения клеточной мембраны, для чего используют инактивированный вирус Сендай. Специфические противовирусные антитела и антитела к нормальным клеткам препятствуют адсорбции вирусов. Процесс адсорбции состоит из двух периодов — обратимого и необратимого. Период обратимой адсорбции может закончиться десорбцией вируса. При длительном контакте клеток и вируса наступает стадия необратимой адсорбции. Адсорбированные вирионы таким образом могут частично элюироваться с поверхности клеток, небольшая часть остается интактной, а основная масса вирусных частиц проникает в клетку.
Проникновение вирусов в клеткуосуществляется путем ви-ропексиса, или пиноцитоза. При этом в месте адсорбции вириона происходит сначала инвагинация наружной мембраны клетки и образование внутриклеточной вакуоли с вирусной частицей. Через некоторое время вирусная и клеточная мембраны вакуоли лизируются и высвобождается нуклеокапсид вируса. Другие вирусы, например вирус Неrреs simр1ех, проникают в клетку не путем виропексиса, а расплавления мембран вируса и клетки. После расплавления вирусный нуклеопротеид оказывается в цитоплазме. Большинство вирусов проникают в клетку путем виропексиса, меньшинство видов — путем сплавления. У фагов этот процесс, то есть освобождение ДНК и ее последующая инъекция сквозь оболочку бактериальной клетки, происходит непосредственно на поверхности этой клетки сразу же после прикрепления к ней фага.
Депротеинизация,или «раздевание» происходит постепенно в несколько этапов. Процесс освобождения вирусной нуклеиновой кислоты идет при активном участии самого вируса, индуцирующего образование в клетке ферментов и активаторов ферментов, необходимых для депротеинизации вирусной нуклеиновой кислоты. В процессе депротеинизации вирусов могут участвовать ферменты клеточных лизосом. Таким образом, депротеинизация завершается освобождением вирусного генома.
Как только вирусный геном освобождается от белка, вирусная нуклеиновая кислота дезорганизует работу клеточных систем. Вирус стимулирует синтез ингибитора клеточных РНК. Ингиби-
62
тор представляет собой белок — гистон, кроме того блокирующий процесс синтеза клеточной ДНК. Второй «ранний» вирусный белок препятствует осуществлению функции клеточной и-РНК. Термин «ранние» обозначает молекулы, синтезированные до репликации ДНК.
Реализация генетической информации вирусов осуществляется в соответствии с процессами транскрипции — синтеза информационных РНК, комплементарных матричным ДНК или РНК; трансляции — синтеза белков на рибосомах клетки с участием и-РНК; репликации — синтеза молекул нуклеиновой кислоты, гомологичных геному (рис. 7).
| Синтез вирусных ДНКу ДНК-содержащих вирусов осуществляется с помощью ДНК-полимераз. Благодаря участию этого фермента из нуклеотидов клетки синтезируется и строится вторая комплементарная нить ДНК, в результате чего образуются новые двухцепочечные молекулы ДНК. Процесс репликации молекул ДНК продолжается до тех пор, пока в клетке не накопится определенное их количество, необходимое для потомства вирусной частицы, проникшей в клетку.
Поскольку типы и формы нуклеиновых кислот разнообразны — кроме двухцепочечной ДНК могут быть РНК, одно- и двухцепочечные, линейные и кольцевые молекулы — то и механизмы их репликации различны.
У вирусов, содержащих двунитевую РНК,синтез вирусных компонентов происходит сходным образом. «Ранняя» транскрипция у них осуществляется благодаря вирионному ферменту — РНК-зависимой РНК-полимеразе. Вирусы с однонитевой РНК по характеру синтеза белков разделяются на две группы: вирусы,
Вирусные
белки в т. ч. ферменты
ОАО
Новые
молекулы вирусной ДНК
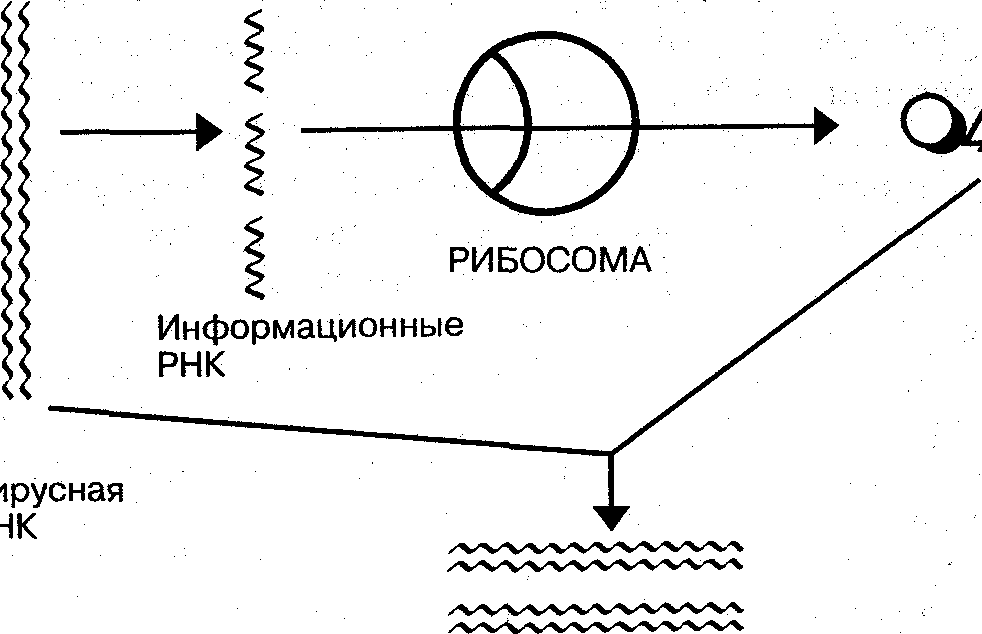
Рис. 7. Схема репликациодвухцепочечных молекул вирусных ДНК и передачи генетической информации в рибосомы
63
И-РНК(+)
Вирусные
белки в т. ч. РНК-репликаза
Транскриптаза
———————^
Вирусная
РНК
ОАО
Новые
молекулы вирусных(-) РНК

Рис. 8. Схема репликации вирусных минус-РНК и передачи генетической информации в рибосомы
у которых РНК обладает информационными свойствами и направляет синтез специфических белков (пикорна- и тогавирусы);
вирусы, у которых РНК не является информационной, а служит только матрицей для синтеза и-РНК (ортомиксо-, парамиксо-, рабдовирусы) (рис. 8).
Особым способом репликации отличаются РНК-содержащие двухцепочечные ретровирусы. Существенное отличие состоит в том, что у них имеется фермент — РНК-зависимая-ДНК-полимераза, с помощью которой на матрице вирионной РНК синтезируется ДНК-провирус кольцевой формы. Этот провирус встраивается в клеточную хромосому и транскрибируется клеточной РНК-полимеразой точно так же, как и обычные клеточные гены. Образующаяся РНК направляет синтез вирусных белков и одновременно является вирионной РНК. Вирусная нуклеиновая кислота кодирует синтез двух классов белков: неструктурных белков — ферментов, которые обеспечивают процесс репродукции вирусов на разных его этапах, и структурных белков, которые войдут в состав вирионов потомства. Наряду с синтезом белков в клетке при репродукции вирусов, имеющих суперкапсид, например, вируса гриппа, происходит синтез углеводных цепей, входящих в состав гликопротеидов. Присоединение углеводов осуществляется с помощью клеточных ферментов трансфераз, синтез липидов суперкапсида — клеткой-хозяином. Вирусный суперкапсид формируется при включении липидов из плазматической мембраны клетки-хозяина. Синтез вирусных нуклеиновых кислот и вирусспецифических белков происходит почти одновре-
64
менно и не менее чем на час опережает созревание вирусных частиц.
Сборка и формирование вирионовосуществляется после достижения критической концентрации нуклеиновой кислоты и белка так как чисто физико-химическая реакция агрегации белка с вирусными нуклеиновыми кислотами. Так, у парамиксовирусов формирование вирионов происходит путем самосборки, которая обусловлена «узнаванием» РНК белками. Вероятно, «узнающим» белком вляется белок Р, который наиболее жестко связан с РНК в вирионах. Нуклеокапсиды накапливаются в цитоплазме зараженных леток, причем скорость образования внутриклеточных нуклеокапсидов гораздо выше скорости образования вируса. Зрелые вирусные сложноустроенные частицы формируются при прохождении их нуклеопротеидов через цитоплазматическую или ядерную мембрану клетки-хозяина.
Компоненты этих мембран становятся элементами наружной оболочки вириона — суперкапсида. Заключительная стадия репро-дукции вирусов — выход вновь сформированных вирионов из клетки. У различных групп вирусов этот процесс происходит по-разному. При выходе из клетки вирусов, не имеющих суперкапсидной оболочки, как правило, клетка погибает из-за взрывного выхода одновременно большого количества вирусных частиц. Вирусы, имеющие суперкапсидную оболочку, выходят из клетки путем почкования. На заключительном этапе сборки нуклеокапсиды сложноустроенных вирусов фиксируются на клеточной мембране, модифицированной вирусными белками, и постепенно выпячивают ее, в результате чего образуется «почка», содержащая нуклеокапсид. Затем «почка» отделяется от клетки, то есть внешняя суперкапсидная оболочка этих вирусов формируется в процессе их выхода из клетки.
При таком механизме выхода вирионов из клеткипоследняя сохраняет в определенной мере свои функции. Так, например, процесс выхода вирусов гриппа может продолжаться более 30 часов. Герпесвирусы могут выходить из клетки через цитоплазматические трубочки, соединяющие ядерную оболочку с наружной мембраной клетки. Благодаря такому механизму выделения эти вирусы передаются от клетки к клетке, не выходя во внешнюю среду. Образовавшиеся в процессе репродукции вирионы могут инфицировать новые клетки и проходить в них новый цикл репродукции.
Интегративный тип взаимодействия характеризуется встраиванием нуклеиновой кислоты вируса в хромосому клетки-хозяина. При этом вирусный геном функционирует как составная часть клеточного генома. Интегративный тип взаимодействия присутствует у бактериофагов, онкогенных вирусов, вируса гепатита В, вирусов герпеса и вируса иммунодефицита человека. В частности,
5 «Микробиология»
65
умеренные фаги вступают в симбиоз с частью бактерий, при этом ДНК фага встраивается в хромосому бактерии. В данном случае геномом фага называют профаг, ставший частью хромосомы бактерии и не вызывающий ее лизиса.
Симбиоз микробной клетки с умеренным фагом называют лизогенией. Самопроизвольно или под действием ультрафиолета, или химических факторов профаг может из хромосомы переходить в цитоплазму и вести себя как вирулентный фаг, лизирующий бактерии.
У онкогенных вирусов и вируса иммунодефицита человека процесс интеграции является обязательным в цикле их репродукции. У этих вирусов на матрице РНК с помощью фермента РНК-зависимой ДНК-полимеразы синтезируется ДНК-копия, которая встраивается в хромосому клетки. ДНК вируса, находящаяся в составе хромосомы клетки, называется ДНК-провирусом. Клетка сохраняет свои функции и при делении передает ДНК-провирус дочерним клеткам.
Таким образом, состояние вирогении наследуется. ДНК-про-вирус несет дополнительную генетическую информацию, поэтому интеграция является причиной некоторых аутоиммунных и хронических заболеваний, опухолей. Под действием некоторых физических и химических факторов ДНК-провирус может вырезаться из клеточной хромосомы и переходить в автономное состояние, включаясь в цикл репродукции.
КУЛЬТИВИРОВАНИЕ ВИРУСОВ В ЛАБОРАТОРНЫХ УСЛОВИЯХ
Культивирование вирусов осуществляют для лабораторной диагностики вирусных заболеваний человека и животных, изготовления живых и инактивированных противовирусных вакцин и сывороток, изучения вопросов патогенеза и иммунитета.
Культивирование вирусов в организме естественно восприимчивых животных проводят в том случае, если исследователь заинтересован сохранить у вируса исходную патогенность и антигенные свойства.
Культивирование вирусов в организме лабораторных животных ограничено из-за невосприимчивости животных ко многим
вирусам человека.
Одним из наиболее доступных и удобных методов для выделения и культивирования вирусов является использование куриных эмбрионов. В куриных эмбрионах способны размножаться вирусы с различным тропизмом, поскольку они содержат четыре субстрата для вируса — амнион, алантоис, хорионаллантоисную мембрану и желточный мешок.
66
Индикацию вирусов в куриных эмбрионах осуществляют по характеру поражения тела и оболочек эмбриона, а у гемагглюти-нирующих вирусов — в реакции гемагглютинации (склеивания эритроцитов).
Вирусы — это абсолютные внутриклеточные паразиты, которые не способны размножаться ни в одной из бесклеточных питательных сред. В 1949 году Д. Эндерс, Т. Уэллер и Ф. Роббинс сообщили о том, что вирус полиомиелита может размножаться и вызывать характерные изменения в культурах не из нервной ткани. Благодаря этому открытию стало возможным выращивание вирусов в клеточных культурах, а также удалось выделить и описать множество ранее неизвестных вирусов. Открытие аденовирусов, эхо- и риновирусов, разработка вакцин против полиомиелита, кори и краснухи непосредственно связаны с использованием культур клеток.
Для культивирования различных вирусов используют первичные, диплоидные и перевиваемые клеточные линии.
Первичные культуры клетокполучают из измельченных животных тканей, обрабатывая их протеолитическими ферментами. После отмывки и подсчета клеток суспензию разбавляют средой и дают возможность клеткам прикрепиться к плоской поверхности стеклянной или пластмассовой посуды. Клетки быстро прикрепляются к поверхности и при оптимальных условиях делятся примерно один раз в день. Первичные или первичнотрипсинизи-рованные культуры клеток осуществляют не более пяти—десяти делений. Для лабораторных исследований и производства вакцин их получают из эмбриональных тканей человека (почек, амниона), обезьян, мышей, куриных эмбрионов.
Диплоидные клеточные культурыпредставляют собой клетки фибробластов, полученные из эмбрионов человека. Они могут осуществлять до 100 делений, сохраняя при этом свой исходный дип-лоидный набор хромосом.
Перевиваемые клеточные линии— это клетки одного типа, способные размножатьсяinvitrо неопределенно долго, их получают из трансформированных клеток. Часто они теряют сходство с теми клетками, от которых произошли, претерпевая в течение длительного культивирования последовательные мутации. Перевиваемые клеточные линии Нер-1, Нер-2, Не1а и КВ ведут н ачало от карцином человека. Эти линии, а также линии, происходящие от клеток тканей мышей (L929), хомячков (ВНК-21) широко используются в экспериментальной вирусологии.
О размножении вирусов в культуре клеток можно судить по датопатическому эффекту — ЦПЭ (см. вкл. IV); образованию в клет-:ах вирусных включений; бляшкам в клеточном монослое; явлению гемадсорбции; изменению цвета индикатора питательной среды для клеток.
67
СОХРАНЕНИЕ ВИРУСОВ И ВИРУССОДЕРЖАЩЕГО МАТЕРИАЛА
Вирусы можно сохранять при положительных температурах, в замороженном и лиофилизированном состоянии.
Стабильность вирусов при положительных температурах невелика. Продолжительность хранения отдельных видов вирусов даже при температурах, близких к нулю (2-4°С), исчисляется несколькими днями. Инактивация вирусов при положительных температурах происходит за счет действия различных групп ферментов вирусного и субстратного происхождения.
Неочищенные взвеси вирусов хранят в холодильнике при температуре минус 40—70°С.Чем ниже температура хранения, тем лучше сохраняются вирусы и вируссодержащие материалы.
В настоящее время наиболее совершенным способом хранения вирусов является замораживание (криоконсервирование) при температуре от минус 165°С (в парах жидкого азота) до минус 196° С (в жидком азоте). При такой температуре некоторые вирусы сохраняют ультраструктуру и биологические свойства в течение трех—пяти лет. Поэтому метод криоконсервирования широко используется при создании криобанков вирусов.
Некоторые виды вирусов можно сохранять путем высушива-ния в вакууме из замороженного состояния способом лиофилизации (сублимации). Так, например, можно сохранить вирусы бешенства и полиомиелита.
ГЕНЕТИКА МИКРООРГАНИЗМОВ
Генетика — наука об изменчивости и наследственности организмов. Основателем учения об изменчивости и наследственности является Ч. Дарвин, доказавший в 1859 году, что все существующие виды растений и животных произошли из немногих исходных форм в результате изменчивости.
В 1906-1907 годах М. Нейссер и Р. Манссини описали появление «дочерних» колоний кишечной палочки, в отличие от материнской не ферментировавших лактозу. В настоящее время центральное место в генетике микроорганизмов по-прежнему занимает интенсивное изучение кишечной палочки (Еscherihiа соli) и ее многочисленных вирусов-паразитов. Новым направлением в генетике микроорганизмов является генная инженерия, с помощью которой можно в определенной степени управлять наследственностью микроорганизмов.
Явление наследственности связано со спецификой молекул ДНК, которые программируют процессы индивидуального развития особей бактерий. У высших растительных и животных организмов
68
вся генетическая информация заложена в ядре, содержащем полный набор хромосом. Аналог ядра у бактерий представлен нуклеоидом, состоящим из одной уложенной или развернутой молекулы ДНК. Генетический материал бактерий представлен ДНК, в молекулах которой закодирована информация о структуре клеточных белков. Двунитевая молекула ДНК-хромосомы бактерии кишечной палочки состоит из 1,7×107нуклеотидных пар. Ее молекулярная масса составляет примерно 3 % сухой массы клетки бактерий. Единицей наследственности является ген, представляющий собой участок ДНК, в котором зашифрована последовательность аминокислот в полипептидной цепи, характеризующий отдельный признак особи. В отличие от растений и животных бактерии преимущественно являются гаплоидными — содержат одинарный набор генов и совмещают функции гаметы и особи. Синтез каждого фермента, или более точно полипептидной цепи контролируется отдельным геном генома. Если в геноме бактерии отсутствует ген данного фермента, этот фермент не может быть синтезирован. ДНК представляет собой длинный полимер-полинуклеотид. Каждый нуклеотид состоит из азотистого основания — аденина, гуанина; цитозина или тимина и остатка сахара дезоксирибозы и фосфатной группы, с помощью которых нуклеотиды соединяются между собой.
Генетический кодсоставляет особая последовательность нук-
леотидов на определенном участке ДНК. Последовательность ос- нований в ДНК характеризует собой структурную единицу — кодон, который кодирует каждую из 20 аминокислот, входящих в состав белков.
Генотип— это комплекс генов, наследственно переданный особи материнской клеткой. Комплекс внешних и внутренних признаков бактерий, таких как форма, размеры, окраска, химический состав, биохимические и микроскопические особенности соответствуют фенотипу, то есть внешнему проявлению генотипа. Процесс синтеза белка, закодированный в молекулах ДНК, осуществляется в несколько этапов и требует участия трех типов РНК:
информационной (матричной) — и-РНК; транспортной — т-РНК;
рибосомальной — р-РНК. Информационная РНК образуется при помощи специфического фермента РНК-полимеразы на матрице молекулы ДНК. При этом генетическая информация, определяемая типом последовательности чередования нуклеотидов, копируется в молекуле и-РНК. Этот этап передачи информации называется транскрипцией.
Информационная РНК направляется к рибосомам, находящимся в цитоплазме. У всех живых организмов рибосомы представляют собой рибонуклеопротеиды, содержащие 63 % РНК и 37 % белка. Лучше других рибосомы изучены у кишечной палочки. Метаболически активные рибосомы Е. соliимеют константу седимента-
69
ции 70S. В среде, содержащей двухвалентные ионы, они обратимо диссоциируют на составляющие 50S и 30Sсубъединиц. Рибосомы бактерий содержат три типа собственной рибосомальной РНК: 5S; 16S; 26S. Кроме РНК субъединицы рибосом имеют индивидуальные белки. Предполагают, что белки выполняют функции формирования структуры рибосом и центров связывания активизированных аминокислот, а также обеспечивают правильность считывания матрицы.
Перевод четырехбуквенного (А, Т, Г, Ц) языка нуклеиновых кислот (ДНК и РНК) на язык протеинов называется трансляцией.
Реализация наследственной информации происходит в определенных условиях внешней среды. Различия в условиях среды накладывают свой отпечаток на развитие особей бактерий. Поэтому развитие бактерий необходимо рассматривать как следствие действия двух важнейших факторов — действия генотипа; влияния на особь факторов среды. Под влиянием физических, химических и биологических воздействий некоторые микроорганизмы могут изменять свои морфологические признаки, принимая форму больших шаров, утолщенных нитей, колбовидных образований, ветвлений и т. д. Явление морфологических изменений у микробов Н. Ф. Гамалея назвал гетероморфизмом.Гетероморфизм легко возникает под влиянием солей лития, а также фага, кофеина, сульфаниламидов, антибиотиков, различных излучений, действия магнитных полей и других факторов. Любое изменение морфологических признаков, как правило, сопровождается изменением и физических свойств. Например, при посеве на плотную питательную среду чистой культуры образуются колонии двух основных типов: гладкие — S-формы (от англ. smoth— гладкий); шероховатые — R-формы (от англ.rough— шероховатый). Такого рода изменчивость получила названиедиссоциации.
Изменчивость бактерий затрагивает и их потребности в метаболитах. Под влиянием антибиотиков, химических веществ, ультрафиолетового облучения у некоторых микробов появляется потребность в витаминах, аминокислотах, факторах роста, в которых не нуждались исходные штаммы. Таким образом, в отличие от исходных прототрофов эти микроорганизмы превращаются в ауксотрофов.
Под действием некоторых веществ могут изменяться ферментативные свойства бактерий. Индукцию биосинтеза фермента -галактозидазы у Е.соП можно воспроизвести культивированием этой бактерии в присутствии лактозы.
Очень важным моментом является то, что под влиянием различных факторов изменяется степень патогенности у болезнетворных микробов.
В 1881 году Л. Пастер разработал метод получения живой вакцины против сибирской язвы. В течение 12—24 дней культи-
70
вирования сибиреязвенной бациллы при повышенной температуре (42—43 °С) микробы потеряли способность вызывать заболевание у животных при подкожном введении, сохранив при этом иммуногенные свойства. Используя этот пастеровский принцип, в 1883 году Л. С. Ценковский создал живую противосибиреязвенную вакцину, состоящую из взвеси спор ослабленных сибиреязвенных бактерий.
В 1885 году Л. Пастер изменил свойства возбудителя бешенства путем проведения 133 последовательных пассажей через мозг кроликов. При подкожном введении вирус оказался безвредным и в то же время способным предупреждать возникновение заболевания у людей, укушенных бешеными животными.
Ослабленный штамм микобактерий туберкулеза бычьего вида был получен во Франции в 1919 году А. Кальметтом, Ш. Гереном путем длительного пассирования на картофельной среде с желчью и глицерином при температуре 38°С в течение 13 лет через каждые 14 дней. Полученный штамм был назван вакциной БЦЖ (ВСG— от фр. Васilе Са1mеtte-Guеrin), которую применяют для прививок против туберкулеза.
Изменчивость микроорганизмов, возникающая под действием факторов внешней или внутренней среды, которая не сопровождается изменением структуры генотипа называется ненаследственной фенотипической изменчивостью.Например, культура кишечной палочки на среде с рициноолеатом натрия растет в виде длинных нитей, а при добавлении хлорида кальция клетки становятся очень короткими. Глицерин и аланин обусловливают полиморфизм у холерных вибрионов.
В процессе снижения степени патогенности микроорганизмов — аттенуации происходят наследственные генотипические изменения химического состава бактерий. У микобактерий туберкулеза уменьшается содержание липидов, у возбудителя чумы — белка, у туляремийных бактерий и бруцелл — снижение способности липидов к комплексообразованию.
При воздействии пенициллином, химическими веществами или иммунными сыворотками на стафилококки, микобактерии туберкулеза и многие другие бактерии возникают L-формы бактерий, у которых нарушается синтез клеточной стенки. Микробная клетка превращается в большой шар с вакуолями, гранулами, зернистостью.
МУТАЦИИ
При необратимой утрате определенных звеньев биосинтеза клеточной стенки бактерии способны перевиваться в L-форме независимо от наличия в среде пенициллина и других трансфор-|мирующих агентов. В данном случае наблюдается наследственная генотипическая изменчивость, связанная с мутациями — мутаци-
71
онная изменчивость.Мутации, ведущие к изменению генотипа, всегда наследственно закреплены. Различаютнуклеоидныемутации, происходящие в нуклеоиде, ицитоплазматическиемутации — в ДНК цитоплазмы. Мутации могут сопровождаться изменением последовательности нуклеотидов ДНК, выпадением (делеция) или добавлением (дупликация) одного основания или небольшой группы оснований.
По происхождению бактериальные мутации подразделяются на спонтанные, образующиеся под воздействием внешних факторов без вмешательства экспериментатора, и индуцированные, возникающие вследствие обработки микробной популяции мутагенными факторами.
По механизму действия на геном микробной клетки мутации подразделяются на:
точечные или мелкие, при которых в результате замены, вставки или выпадения одной пары азотистых оснований ДНК внутри самого гена изменяется, как правило, лишь генетический признак бактериальной клетки. При точечных мутациях может наблюдаться спонтанная (самопроизвольная) или индуцированная реверсия, то есть восстановление утраченного или утрата приобретенного признака;
крупные или множественные, при которых в основном наблюдается летальный исход;
супрессорные — это эффекты приобретения или утраты признака, непосредственно не связанного с действием мутагена на структурный ген, ответственный за этот признак. Закономерным исходом супрессорных мутаций является восстановление исходного генетического статуса.
ГЕНЕТИЧЕСКИЕ рекомбинации
Среди микроорганизмов широко распространен и такой вид изменчивости как генетическая рекомбинация,которая может происходить в результате трансформации, трансдукции и конъюгации. В эволюционном процессе рекомбинации играют второстепенную роль. Главным поставщиком эволюционного материала являются мутации.
Суть явления генетической рекомбинации состоит в том, что в реципиентную клетку попадает лишь фрагмент экзогенной ДНК бактерии-донора, который взаимодействует с цельной хромосомой реципиента, в результате чего происходит перераспределение — рекомбинация генетического материала с образованием рекомбинанта, имеющего признаки обоих родителей. Полученные рекомбинанты — это клетки, в которых полноценная хромосома состоит из хромосомы реципиента с включенными в нее фрагментами хромосомы донора.
72
Для осуществления возможности скрещивания донор должен обладать свойством фертильности (от англ. fertilitу — плодовитость). Фертильность определяется по способности бактерий адсорбировать специфические донорские фаги на поверхностных пилях, синтез которых детерминируется F-плазмидой, или на специфических участках поверхности клетки-донора при отсутствии таких пилей у некоторых видов бактерий. Рекомбинация может произойти при наличии у реципиента рекомбинационных генов, а также при отсутствии факторов ограничения экспрессии чужеродной ДНК.
Трансформация
Трансформация — передача генетической информации путем введения в клетку реципиента изолированной ДНК бактерии-донора. Поскольку эффективность трансформации зависит от степени гомологии структуры ДНК донора и реципиента, она более эффективна в пределах одного вида.
Трансформация возможна, когда у реципиента возникает состояние компетентности, заключающееся в изменении проницаемости клеточной стенки, позволяющее проникать в клетку высокомолекулярным структурам донорской ДНК. На поверхности клетки-реципиента находятся специфические ферментативно активные рецепторы, на которых адсорбируются фрагменты ДНК донора и затем проникают в клетку. Проникшие фрагменты расщепляются на комплементарные нити, из которых одна включается в хромосому реципиента. Трансформирующая активность ДНК очень высока. Достаточно 10 — 15 минут ее контакта с исследуемой культурой, чтобы вызвать начало изменчивости, которая завершается через 2 часа. При трансформации от донора к реципиенту могут передаваться гены, определяющие резистентность к антибиотикам, фаголизабельность и другие свойства микроорганизмов. При существенных различиях в степени гомологии нуклеотидного состава ДНК-компонентов донора и реципиента частота получения трансформантов ограничена. Тем не менее, межвидовая трансформация получена у бактерий родов Neisseria,Bacillus, Streрtососcus.
Трансдукция
Трансдукция— перенос генетической информации от донора реципиенту посредством умеренных бактериофагов, которые в отличие от вирулентных не всегда вызывают лизис бактериальной клетки. В явлении трансдукции принимают участие бактерия-донор, трансдуцирующий фаг и бактерия-реципиент. Умеренные бактериофаги могут находиться в цитоплазме бакте-
73
рии в автономном состоянии или включаются в структуру ДНК в виде профага. В интегрированном состоянии геном умеренного фага передается потомству клетки наравне с другими хромосомными генами. Переходя в автономное состояние, эти фаги могут присоединять к собственному геному небольшие фрагменты хромосомы, расположенные рядом с местом включения в нее профага. При инфицировании новых бактерий умеренные фаги, несущие хромосомные гены, выполняют функции переносчика генетического материала. Различают три вида трансдукции: общую, или неспецифическую, специфическую и абортивную.
При общейтрансдукции может быть передан любой участок хромосомы бактерий или несколько участков, определяющих целый ряд наследуемых признаков.Специфическаятрансдукция осуществляется группой фагов, которые способны трансдуцировать гены, расположенные рядом с местом включения генома фага в нуклеоид бактерий при ее лизогенизации. Некоторые умеренные фаги сальмонелл и шигелл осуществляют лизогенную или фаговую конверсию антигенов одновременно с лизогенизацией клетки-реципиента. При конверсии вместе с фагом передается фрагмент хромосомы, контролирующей синтез соматического антигена, что изменяет антигенную структуру реципиента.
Важное значение имеет фаговая конверсия у дифтерийных бактерий. Один из умеренных фагов Соrуnеbacteriumdiphteriае одновременно с лизогенизацией сообщает бактериям свойство токсигенности. У этих бактерий способность синтезировать токсин находится под генетическим контролем генома фага и исчезает одновременно с его утратой.
При абортивнойтрансдукции внесенный фагом фрагмент нук-леоида не включается в нуклеоид реципиента; он находится в цитоплазме и при делении передается только одной клетке, вторая дочерняя клетка содержит генетический аппарат реципиента.
Широкое распространение лизогенности у стафилококков и энтеробактерий позволяет предположить значительное влияние трансдукции на формирование атипичных бактерий, что ведет к осложнению эпидемиологического анализа. Наглядно это проявляется в антигенной конверсии, влекущей за собой изменение антигенной структуры близкородственных бактерий, у которых основу дифференциальной диагностики составляет серологическая характеристика.
Конъюгация
Конъюгация— половой путь передачи генетического материала при непосредственном контакте клеток донора и реципиента. Необходимое условие — наличие у донора фактора F-фертильности. У грамотрицательных бактерий обнаружены по-
74
ловые F-пили — длинные тонкие белковые трубочки, контролируемые F-фактором. Через F-пили при конъюгации происходит перенос генетического материала от донора к реципиенту. Клетки-доноры обозначают F+, клетки-реципиенты — F-. Скрещивание F+и F-, сопровождается плодовитостью, а F-× F-— бесплодностью. Диаметр канала пилей у Е. соliдостигает 25 А°, это позволяет проходить через него нити ДНК донора при контакте с клеткой реципиента.
Внехромосомные элементы, с участием которых совершаются процессы конъюгации, называются конъюгативными плазмидами. Конъюгативная плазмида —это внехромосомная генетическая структура бактерий, представляющая собой замкнутое кольцо двунитевой ДНК, находящейся в цитоплазме в автономном состоянии и ориентирующая на передачу хромосом, будучи с нею в интегрированном состоянии. Плазмиды несут необязательные для клетки-хозяина гены и придают бактериям дополнительные свойства, которые могут им обеспечивать преимущества по сравнению с бактериями, не имеющими плазмид.
К конъюгативным плазмидам относят фактор фертильности, а также плазмиды, контролирующие резистентность бактерий одновременно к нескольким лекарственным веществам (R-плазмиды); плазмиду Еnt, регулирующую синтез энтеротоксина у патогенных эшерихий; плазмиду Н1у — обеспечивающую синтез гемолизинов; плазмиды, контролирующие синтез поверхностных антигенов кишечной палочки — К-88, К-99 и др.
Внедряясь в клетку реципиента, конъюгативные плазмиды сообщают ей свойства донора. Они остаются в цитоплазме, сохраняя автономное состояние, и реплицируются независимо от хромосомы или встраиваются в структуру хромосомы — переходят в интегрированное состояние. Находясь в автономном состоянии, плазмиды могут быть выведены из клетки путем ее обработки акридиновыми красителями и некоторыми другими веществами. Особенность конъюгативных плазмид — наличие в их структуре генетического элемента трансмиссивности — фактора передачи — trа, обеспечивающего передачу генетической информации. Плазмиды, не имеющие такой частицы и соответственно неспособные к самопередаче, называются неконъюгативными.К ним относятся туберкулоцины, пестицины, вибриоцины — то есть некоторые факторы синтеза антагонистических субстанций.
В последнее время изучается роль плазмид в формировании условно-патогенных бактерий, поскольку условно-патогенные и патогенные микроорганизмы различаются степенью стабильности генетических факторов, контролирующих инвазивность и продукцию эндо- и экзотоксинов. Патогенный эффект у лизогенных сальмонелл может усиливаться по сравнению с нелизогенными бактериями за счет высвобождения эндотоксина при их
75
лизисе в результате спонтанной или индуцированной активации профагов. Плазмида Еnt сообщает бактерии-хозяину способность продуцировать энтеротоксины. Особенности полиплазмидных систем условно-патогенных бактерий необходимо учитывать при лабораторной диагностике острых энтеритов, токсикозов, коли-бактериозов при отсутствии облигатнопатогенных возбудителей заболевания.
Плазмиды являются удобной моделью для генной инженерии, широко используются для получения рекомбинантных штаммов. Кроме того, благодаря возможности конъюгационной передачи плазмид не только внутри вида, но и между видами и родами плазмиды играют важную роль в эволюции бактерий.
УЧЕНИЕ ОБ ИНФЕКЦИИ
Между микробом и макроорганизмом существует несколько форм симбиотических отношений (от лат. simbios— сожительство): мутуализм — взаимовыгодные отношения двух организмов; комменсализм — оба организма не принося пользы, не причиняют вреда друг другу; паразитизм — один из партнеров по симбиозу испытывает вредное воздействие со стороны другого. Паразитизм широко распространен в природе. Микробы-паразиты возникали по мере появления растительного, а затем животного мира и в процессе эволюции проспосабливались к существованию в одном или ограниченном числе видов высших организмов. Явление паразитизма представляет интерес для медицинской микробиологии, поскольку на основе этой формы взаимоотношений между микробом и макроорганизмом появились инфекционные болезни.
Инфекция
Микроорганизм Макроорганизм Внешняя среда (факторы)
токсины/капсула продукты восприим- резистент- социальные биологи-/ метаболизма чивость ность \ ческие
инвазивность агрессивность гомеостаз инфекционная болезнь особенности классификация
по источникам по механизму передачи
Рис. 9. Схема взаимодействия факторов, участвующих в инфекционном процессе
76
Инфекция(от лат. infесtiо — заражать) — процесс сложногоактивного взаимодействия макроорганизма с микроорганизмом, внедрившимся в его ткани и органы.
Инфекционный процесс —совокупность физиологических защитных и патологических процессов, развивающихся в организме в результате внедрения в него болезнетворного (патогенного) микроба.
Инфекционная болезнь —крайняя степень проявления инфекционного процесса, сопровождающаяся рядом характерных симптомов. Клиническая картина бешенства отличается ,от заболева-уция дизентерией, брюшного тифа — от сыпного тифа.
Для возникновения инфекционного процесса, заболевания необходимо взаимодействие трех факторов (рис. 9): патогенный
микроорганизм; восприимчивый макроорганизм; условия окружающей среды, в том числе и социальные.
МИКРООРГАНИЗМ И ИНФЕКЦИОННЫЙ ПРОЦЕСС
Роль микроорганизма в возникновении инфекционного процесса впервые была определена в 1840 году Я. Генле и позднее уточнена Р. Кохом в его триаде, согласно которой:
возбудитель заболевания может быть обнаружен только у больных;
из организма больного его нужно выделить в чистой культуре;
выделенная культура возбудителя должна вызывать заболевание у восприимчивых лабораторных животных.
В свое время триада Генле — Коха сыграла положительную роль, поскольку в ней были сформулированы условия, которым должен отвечать микроб — возбудитель инфекционного заболевания,
В настоящее время триада во многом утратила свое значение. Сейчас не вызывает сомнения возможность обнаружения возбудителя не только у больных с клинически выраженной формой заболевания, но и у практически здоровых лиц — бактерионосителей. Хорошо известно, что при ряде заболеваний, вызванных риккетсиями, вирусами, выделить возбудителя в чистой культуре не всегда удается, так как он не растет на искусственных питательных средах. И, наконец, весьма большое число патогенных микробов не могут вызвать у экспериментальных животных типичной клинической картины заболевания в связи с тем, что ко многим из них у животных имеется видовая устойчивость (сифилис, гонорея, брюшной тиф).
Патогенность -потенциальная способность микроорганизмов определенного вида вызывать инфекционный процесс, может быть реализована только в восприимчивом организме, является видовым, генетически обусловленным признаком.
77
Патогенный микроб обладает специфичностью, то есть каждый отдельный вид возбудителя вызывает только определенную болезнь. Некоторые микроорганизмы являются условно-патогенными: в обычной среде они существуют в организме (на коже, слизистых оболочках, в кишечнике) как сапрофиты, но при ослаблении сопротивляемости человека или животного могут становиться паразитами. К ним принадлежат: Е.соli, Strерtососсus fаесаlis, Рsеudomonas aeruginosa, Cаndidaаlbicаns, и др.
Вирулентность —индивидуальный признак патогенного микроба, определяющий степень или меру патогенности. У различных штаммов одного вида микроорганизмов вирулентность различна, ее можно измерить условно принятыми единицами:
DLМ (dosis1еtаlisminima) — наименьшее количество микробов, которое вызывает гибель 95 % зараженных восприимчивых лабораторных животных определенного вида и стандартной массы;
LD50— минимальная доза микроорганизмов, вызывающая гибель 50 % экспериментальных животных.
Вирулентность не является постоянным признаком и подвержена изменениям. Повышению вирулентности способствует воздействие на микроорганизм благоприятных факторов. Попадание микроба в среду, неблагоприятную для его развития, нередко приводит к снижению вирулентности. Искусственное снижение вирулентности путем культивирования микробов на неподходящих средах, пассажей через невосприимчивый организм, внесения в питательные среды антибиотиков, различных химических веществ, воздействия повышенной или пониженной температуры и т. д. применяется для получения аттенуированных (ослабленных) вакцин. Таким образом, вирулентность представляет собой довольно пластическое свойство, подверженное изменчивости как в естественных, так и в экспериментальных условиях.
Материальную основу вирулентности составляют: капсула, токсины, ферменты вирулентности.
Капсулазащищает патогенный микроб от воздействия фагоцитов и антител при попадании в макроорганизм.
Токсины— микробные яды. Различают экзотоксины и эндотоксины, отличающиеся целым рядом свойств.
Экзотоксины легко диффундируют в окружающую среду из клетки в процессе ее жизнедеятельности. По химической природе являются белками, термолабильны, очень ядовиты, обладают специфичностью действия, то есть поражают определенные органы и системы (столбнячный токсин — двигательные нейроны спинного мозга, дифтерийный — сердечную мышцу и надпочечники), вызывают образование в организме антител — антитоксинов. При действии формалина и температуры 39—40°С утрачивают ядовитость. Экзотоксины, лишенные ядовитых свойств, но сохранив-
78
шие антигенную структуру и иммуногенность, называются анатоксинамии используются в качестве препаратов для профилактических прививок.
Сильные экзотоксины продуцируют некоторые грамположительные микроорганизмы: возбудители дифтерии, столбняка, газовой гангрены, ботулизма.
Эндотоксины прочно связаны с бактериальной клеткой и поступают во внешнюю среду только после ее гибели и разрушения. Имеют липополисахаридную природу, термостабильны, менее ядовиты. Попав в организм, вызывают явления общей интоксикации, а в качестве ответной реакции — образование антибактериальных антител. Под действием формалина обезвреживаются частично. Большинство патогенных бактерий содержит эндотоксин (возбудитель брюшного тифа, паратифов, дизентерии, коклюша и др.).
Ферменты вирулентностиспособствуют проникновению (ин-вазивность) и распространению (инфекционность) микробов в организме. К ним относятся: гиалуронидаза, расщепляющая гиалуроновую кислоту (мукополисахарид) соединительной ткани; фибринолизин, лизирующий фибрин кровяного сгустка; коагулаза, свертывающая плазму крови; лецитиназа, разрушающая оболочку клеток крови и различных органов; гемолизины, растворяющие эритроциты и лейкоцидины, разрушающие лейкоциты. Некоторые патогенные микробы (возбудитель чумы, сибирской язвы) продуцируют агрессины — вещества, нейтрализующие антитела; антифагины, препятствующие фагоцитозу.
Вирулентным микробам присущи также адгезия и колонизация.
Адгезия— способность адсорбироваться на определенных, чувствительных к данному возбудителю заболевания клетках организма хозяина. Обусловлена, с одной стороны, поверхностными структурами микробной клетки (пили), с другой — наличием рецепторов клетки макроорганизма, способных вступать в соединение с микробной клеткой.
Колонизация— способность микробов размножаться либо на поверхности клетки макроорганизма, к которой они прикрепились (холерные вибрионы на энтероцитах), либо внутри клеток, куда проникают микробы (дизентерийная палочка в клетках толстого кишечника).
МАКРООРГАНИЗМ И ИНФЕКЦИОННЫЙ ПРОЦЕСС
Возможность возникновения инфекционного процесса определяется не только количеством и качеством патогенного микроба, но и состоянием макроорганизма, его сопротивляемостью, восприимчивостью.
79
Воспрдимчивость обусловлена наличием в организме опреде ленных клеток, тканей в которых микроб-паразит находит оптимальные условия существования. Человек наиболее восприимчив к тем заболеваниям, которыми болеют только люди (сифилис, дифтерия и др.) и невосприимчив к заболеваниям, поражающим животных (чумка собак, чума свиней).
Важным условием возникновения инфекционного процесса является внедрение патогенного микроба в организм через определенные входные ворота (место проникновения возбудителя). Дизентерийные, брюшнотифозные микробы, холерный вибрион вызывают инфекционный процесс, попав в организм через рот; возбудители газовой гангрены, стовбняка — через раневую поверхность; вирусы гриппа, кори — через слизистые оболочки верхних дыхательных путей и т. д. Возникновению и развитию инфекционного процесса способствуют недоедание, переохлаждение, переутомление, хроническое отравление алкоголем, авитаминозы. Все это ведет к ослаблению организма, снижению его защитных сил. Одним из тяжелых последствий голодания является то, что при недостатке белков уменьшается выработка организмом защитных веществ (антител), активность фагоцитов.
Большую роль в восприимчивости организма к инфекции играет гиповитаминоз. Недостаток витамина А снижает барьерную функцию кожи, способствует возникновению гнойно-воспалительных процессов на коже. Гиповитаминоз В и С повышает восприимчивость к туберкулезу, дифтерии, стрептококковым, стафилококковым поражениям.
Заболевания нервной и эндокринной систем способствуют возникновению и более тяжелому течению инфекционных болезней (гнойно-воспалительные процессы при диабете).
На восприимчивость к инфекции оказывает также известное влияние возраст, пол. Ко многим заболеваниям дети более восприимчивы, чем взрослые (корь, скарлатина, паротит). У людей пожилого возраста заболевания протекают тяжелее.
Определенные физиологические состояния женского организма при неблагоприятных условиях могут понизить сопротивляемость к инфекции.
ОКРУЖАЮЩАЯ СРЕДА И ИНФЕКЦИОННЫЙ ПРОЦЕСС
К факторам окружающей среды следует отнести климатические условия. Охлаждение или перегревание понижает устойчивость организма к патогенным и условно-патогенным микроорганизмам. В осенне-зимний сезон повышается заболеваемость гриппом и другими респираторными заболеваниями. На севере отмечена более высокая заболеваемость скарлатиной, чем на юге.
80
В условиях жаркого климата чаще регистрируются кишечные заболевания, в частности, амебная дизентерия.
Развитию инфекционных болезней способствует ионизирующая радиация в повышенных дозах, длительное и интенсивное действие солнечного света.
Немаловажную роль в возникновении и распространении инфекций играют плохие санитарно-гигиенические условия труда и быта людей, неблагоустроенность населенных пунктов, недостаточное водоснабжение и плохое качество питьевой воды, отсутствие ветеринарного надзора и др.
