
- •Министерство образования и науки украины
- •1. Строение атома
- •1.2. Некоторые сведения из квантовой механики
- •1.3. Уравнение Шредингера для атома водорода
- •1.4. Спин электрона
- •1.5. Атомная орбиталь
- •1.6. Принцип Паули
- •1.7. Многоэлектронные атомы
- •2. Химическая связь
- •2.1. Основные характеристики химической связи
- •2.1. Составление химических уравнений
- •2.3. Стехиометрические расчеты в химии
- •2.5. Номенклатура неорганических соединений
- •2.5. Скорость химических реакций.
- •3. Кристаллохимия
- •3.1. Ионные кристаллы
- •3.2. Ковалентные связи в кристаллах
- •3.3. Металлическая связь
- •3.4. Слабая (ван-дер-ваальсовая) связь в кристаллах
- •3.5. Кристаллохимические параметры
- •4. Кристаллография (1 часть)
- •4.1. Предмет кристаллографии
- •4.4. Сетка Вульфа. Сферические координаты
- •4.5. Элементы симметрии кристалла
- •5. Кристаллография (2 часть)
- •5.1. Сингонии. Решетки Бравэ
- •5.2. Некоторые наиболее распространенные типы решеток
- •5.3. Пространственная решетка
- •5.4. Индицирование направления
- •5.5. Индицирование плоскостей (hkl)
- •5.6. Индицирование гексагональных кристаллов (граней)
- •5.7. Термины в кристаллографии
- •6. Дефекты кристаллической решетки
- •6.1. Точечные дефекты
- •6.2. Миграция точечных дефектов
- •6.3. Диффузия в твердых телах
- •6.4. Дислокации в кристаллах
- •7. Макро-, микро- и наноструктура материалов
- •7.1. Макроскопический анализ
- •7.2. Микроскопический анализ
- •7.3. Принцип работы металлографического микроскопа
- •7.4. Определение балла зерна
- •7.5 Фазовый анализ
- •7.6. Наноструктура
- •7.7. Рентгеноструктурный анализ материалов
- •8. Механические свойства твердых материалов
- •8.1. Разновидности механических свойств материалов
- •8.3. Упругая линейная продольная деформация
- •8.4. Сдвиг. Упругая деформация сдвига
- •8.5. Взаимосвязь между деформациями растяжения (сжатия) и сдвига
- •9. Всесторонняя деформация сжатия
- •9.1. Закон Гука для всесторонней деформации
- •9.2. Закон Гука для деформации вдоль одной стороны
- •9.3. Связь между модулем всестороннего сжатия и
- •9.4. Напряжения при ударе
- •9.5. Упругое последствие
- •10. Изгиб и кручение материалов
- •10.1. Изгиб. Упругая изгибная деформация
- •10.2. Прогиб и поворот сечения балки
- •10.3. Прогиб балки на двух опорах
- •10.4. Кручение материалов. Деформация кручения
- •11. Пластичность. Твердость. Ударная вязкость
- •11.1. Пластическая деформация твердых тел
- •11.2. Физическая сущность пластической деформации
- •11.3. Пластическая деформация поликристаллов
- •11.4. Основные характеристики деформации и разрушения
- •11.5. Твердость материалов
- •12. Разрушение материалов. Пути повышения прочности
- •12.1. Прочность. Виды разрушений
- •12.2. Ползучесть материалов
- •12.3. Другие механические свойства
- •12.4. Пути повышения прочности материалов
- •13. Тепловые свойства твердых тел
- •13.1. Колебания атомов в кристаллах
- •13.2. Теплоемкость твердых тел
- •13.3. Теплопроводность твердых тел
- •13.4. Тепловое расширение твердых тел
- •13.5. Зависимость механических напряжений от температуры
- •13.6. Повышение механических свойств материалов под действием температуры
- •14. Жидкое состояние вещества
- •14.3. Вязкость жидкостей
- •14.4. Поверхностное натяжение
- •14.5. Явления смачивания
- •14.6. Жидкие растворы
- •14.9. Осмотическое давление
- •15. Структура полимеров
- •15.1. Молекулярное строение полимеров
- •15.2. Классификация полимеров
- •15.3. Превращения в полимерах
- •15.4. Надмолекулярная структура полимеров
- •16. Механические свойства полимеров
- •16.1 Высокоэластическое состояние полимеров
- •16.2. Модель Максвелла для линейных полимеров
- •16.3. Модель Кельвина-Фогта для сетчатых полимеров
- •17. Термодинамика фазовых превращений
- •17.1. Фазовые превращения. Правило фаз
- •17.2. Термодинамические функции и параметры
- •Свойства термодинамических функций:
- •17.3. Связь между основными термодинамическими функциями и параметрами
- •17.4. Химический потенциал
- •18. Фазовые переходы I рода. Плавление и
- •18.1. Фазовые переходы I рода
- •18.2. Уравнение Клапейрона-Клаузиуса
- •18.3. Плавление и кристаллизация
- •18.4. Термический анализ
- •19. Фазовые превращения в твердом состоянии
- •19.1. Изоморфизм и полиморфизм вещества
- •19.2. Полиморфные превращения
- •19.3. Бездиффузионные и диффузионные превращения
- •19.4 Кинетика твердофазных превращений
- •19. 5 Упорядочение и разупорядочение в сплавах
- •19.6. Диаграмма состояния сплавов с учетом твердофазных превращений
- •19.7. Эвтектоидные превращения
- •19. 8. Рекристаллизация
- •20. Сплавы
- •20.1. Классификация сплавов
- •20.2. Зависимость свободной энергии Гиббса от температуры и
- •20.3. Система с неограниченной растворимостью компонентов в жидком и твердом состояниях
- •20.4. Построение диаграмм состояния методом термического
- •21. Диаграммы состояния бинарных систем
- •21.1. Система с ограниченной взаимной растворимостью
- •21.2. Анализ диаграммы состояния для сплавов с эвтектическим
- •21.3. Анализ диаграммы состояния для сплавов с перитектическим превращением.
- •21.4. Диаграммы состояния для сплавов, когда компоненты образуют химические соединения
- •22. Изучение диаграмм состояния
- •22.1. Построение и расшифровка диаграмм состояния тройных сплавов
- •22.2. Основные типы диаграмм состояния трехкомпонентных
- •II. Изотермические и политермические сечения тройных диаграмм.
- •23. Определение концентрации компонентов
- •Бинарные сплавы
- •Найти молярную массу бинарного раствора м при известных ,,м1 и м2.
- •24.2. Неорганическое стекло
- •24.3. Механические и тепловые свойства стекла
- •24.6. Оптические свойства стекла
- •24.5. Применение технических стекол.
- •25. Дисперсные системы
- •25.1. Введение
- •25.2. Свойства малых частиц
- •25.3. Коагуляция частиц
- •26. Электрические свойства материалов
- •26.1. Элементы зонной теории твердого тела
- •26.2. Электропроводность твердых тел
- •26.2. Поляризация диэлектрика
- •26.4. Сверхпроводники
- •26.5. Электрический ток в жидкостях
- •27. Магнитные свойства твердых тел
- •27.1. Магнитные моменты атомов
- •27.2. Намагничивание. Диа- и парамагнетики
- •27.3. Ферромагнетики
1.2. Некоторые сведения из квантовой механики
Энергия кванта: Е = hv;
Формула де-Бройля: = h/p ( - длина волны; р = mV - импульс частицы; m - масса частицы);
- Формула Эйнштейна Е = mс2 (с = 3108 м/с – скорость света);
- с = v – связь скорости движения с электромагнитной волны с длиной волны и с частотой v.
- k = 2 / - волновое число;
- = 2 v – циклическая частота;
- Соотношение неопределенностей Гейзенберга:
rp ħ,
где r, p – неопределенности координаты и импульса частицы;
- волновая функция, характеризующая вероятность W нахождения частицы в некотором объеме V:
![]() ,
,
где
A
= Const,
![]() .
.
Уравнение Шредингера:
= (2m/h2)(E – U) = 0,
где
![]() - оператор Лапласа,
- оператор Лапласа,
E - полная энергия частицы,
U - потенциальная энергия частицы.
1.3. Уравнение Шредингера для атома водорода
Для атома водорода уравнение Шредингера имеет вид:
![]() , (1.6)
, (1.6)
где = (x,y,z) - волновая функция, не зависящая от времени.
U = -kе2/ r - потенциальная энергия притяжения электрона к ядру (протону).
Не вдаваясь в математические подробности решения уравнения (1.6), ограничимся рассмотрением важнейших результатов, которые из него следуют, пояснив их физический смысл.
а) Энергия электрона Еn.
При решении уравнения Шредингера для атома водорода получается та же формула для энергии электрона в атоме, что и в теории Бора:
![]() , (1.7)
, (1.7)
т. е. подтверждается дискретный характер энергетических уровней.
Здесь п = 1, 2, 3, ... - называют главным квантовым числом, которое определяет энергию электрона в атоме и радиус электронного облака.
При п=1 Е=-E1 = 13,55 эВ - энергия ионизации, т.е. энергия удаления электрона из атома в бесконечность.
б) Собственные функции определяются тремя квантовыми числами n, l, ml.
l - орбитальное квантовое число определяет дескретность момента импульса Ll электрона (т.е. его орбитального механического момента)
![]() , (1.8)
, (1.8)
где l = 0, 1, 2... (п-1).
Всего значений l: Zl = n.
ml - магнитное квантовое число определяет дискретные значения проекции вектора момента импульса LH на заданное направление внешнего магнитного поля Н:
![]() , (1.9)
, (1.9)
где ml = ±[0,1,2,3,4...(l-1), l].
Всего
значений ml: ![]() .
.
1.4. Спин электрона
Опыты Штерна-Герлаха позволили ввести еще одно квантовое число - спиновое квантовое число mS.
Спин - механический момент LS вращения электрона вокруг своей оси.
Согласно общим выводам квантовой механики спин квантуется аналогично Ll:
![]() , (1.10)
, (1.10)
где S = 1/2.
Проекция спина на направление внешнего магнитного поля Н также квантуется
![]() , (1.11)
, (1.11)
где mS - магнитное спиновое квантовое число.
Установлено два значения числа mS: mS = ± 1/2.
Всего
таких чисел ![]() = 2.
= 2.
1.5. Атомная орбиталь
Атомная орбиталь (АО) - совокупность положений электронов в атоме, характеризуемых определенными значениями квантовых чисел n, l, ml и ms.
Обозначения уровней:
- s-орбиталь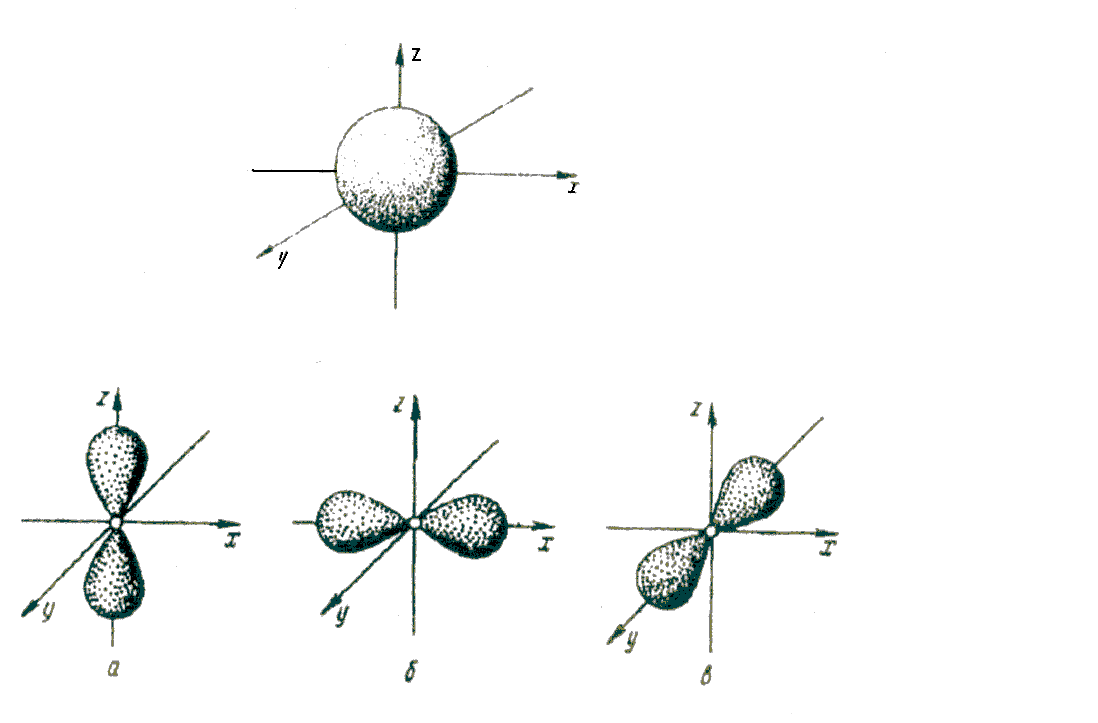
п = 1, 2, 3, 4, 5, ...
К L M N Q ... - орбитальные квантовые числа
l
р-орбитали
s p d f g h ...
Примеры: а) п=1; l=0 (1s)
s-электроны
б) п=2; l=0,1
при l=0 (2s); при l =1 (2р) р-электроны
в) п=3; l=0,1,2
при l=2 (3s3p3d) - d-электроны
г )п=4;
l=0,1,2,3
)п=4;
l=0,1,2,3
при l=3 (4s4p4d4f) - f-электроны,
-
магнитные
квантовые числа: ![]() = 2l
+1.
= 2l
+1.
При l = 0 Z = 1 один подуровень,
l = 1 Z = 3 три подуровня,
l = 2 Z =5 пять подуровней,
l = 3 Z = 7 семь подуровней,
и т.д.
Условные обозначения атомных орбиталей: Рис. 1.1. Атомные s-, p-, d- орбитали.
s- орбиталь при l =0 Z=l
р- орбиталь при l =1 Z=3
d- орбиталь при l =2 Z=5
f- орбиталь при l =3 Z=7.
На рис. 1.1 приведены формы атомных s-, p-, d- орбиталей.
