
- •Редактор Л.М. Тонкошкур
- •УДХТУ, 49005, Дніпропетровськ-5, просп. Гагаріна, 8.
- •Основні характеристики ковалентного зв’язку:
- •Таблиця 1.1
- •Характеристика ковалентних зв'язків
- •Нітроген, пірамідальна будова
- •Оксиген, кутова будова
- •Теорія хімічної будови органічних сполук О.М. Бутлерова
- •Класифікація в залежності від будови вуглецевого ланцюга
- •СПОСОБИ ОДЕРЖАННЯ АЛКАНІВ
- •ХІМІЧНІ ВЛАСТИВОСТІ АЛКАНІВ
- •СПОСОБИ ОДЕРЖАННЯ АЛКЕНІВ
- •ХІМІЧНІ ВЛАСТИВОСТІ АЛКЕНІВ
- •Швидкість приєднання галогеноводнів зменшується в ряду НI > НBr > НCl > НF відповідно із зменшенням міцності зв’язку Н-Hlg.
- •ХІМІЧНІ ВЛАСТИВОСТІ АЛКАДІЄНІВ
- •Природний каучук: цис-1,4-поліізопрен. Гутаперча: транс-1,4-поліізопрен
- •СПОСОБИ ОДЕРЖАННЯ АЛКІНІВ
- •ХІМІЧНІ ВЛАСТИВОСТІ АЛКІНІВ
- •АЛІЦИКЛІЧНІ СПОЛУКИ
- •Циклоалкани. Класифікація, номенклатура та ізомерія
- •Сучасні уявлення про будову циклоалканів
- •СПОСОБИ ОДЕРЖАННЯ ЦИКЛОАЛКАНІВ
- •Спеціальні методи
- •ХІМІЧНІ ВЛАСТИВОСТІ ЦИКЛОАЛКАНІВ
- •АРОМАТИЧНІ ВУГЛЕВОДНІ
- •СПОСОБИ ОДЕРЖАННЯ БЕНЗОЛУ ТА ЙОГО ГОМОЛОГІВ
- •ХІМІЧНІ ВЛАСТИВОСТІ
- •ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ
- •ПЯТИЧЛЕННІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ

33
Швидкість приєднання галогеноводнів зменшується в ряду НI > НBr > НCl > НF відповідно із зменшенням міцності зв’язку Н-Hlg.
Пероксидний ефект Караша. Спостерігається лише для приєднання НBr в присутності кисню, пероксидів та інших джерел вільних радикалів. При радикальному механізмі приєднання галогеноводню проходить проти правила Марковнікова через стадію утворення більш стійкого радикалу. Відбувається по ланцюговому атомарнорадикальному механізму АR.
H C |
|
|
CH |
|
|
CH |
2 |
+ HBr H2O2 |
H3C |
|
CH2 |
|
CH2Br |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO..OH |
|
|
|
2.OH ( ініціатор ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
H..Br + .OH |
|
H2O + .Br |
|
|
|
|
|
|
|
|
. |
|
|
CH2Br |
H Br |
|
|
|
|
|
. |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
CH |
H3C CH2 |
CH2Br + |
||||||||||||||
|
|
|
|
|
|
CH2 + .Br |
|
|
|
|
|
+ .. |
Br |
||||||||||||||||||
H3C |
|
|
CH |
|
|
|
|
|
|
|
H3C |
|
|
CHBr |
|
. |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
Приєднання до алкенів |
HF |
|
та |
|
HCl |
завжди |
відбувається |
за правилом |
|||||||||||||||||||||
Марковнікова, тому що пероксиди не розкладають ці галогеноводні, так як гемолітичний розрив зв’язку в молекулах HF та HCl вимагає значно більшої енергії. Напроти, атоми І, які легко утворюються при розщепленні молекули НІ пероксидами, мало реакційно здатні і не реагують з алкенами.
4. Гідратація – приєднання води до ненасичених сполук.
|
|
|
|
δ + |
|
δ - |
|
+ H2O |
|
H2SO |
4 H3C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
H3C |
|
|
CH |
|
|
CH2 |
|
|
|
|
|
|
CH |
|
|
|
CH3 |
|
2-пропанол |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H2O + H2SO4 |
|
|
|
|
|
H3O+ + HSO4- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
δ + |
|
δ |
- |
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
+ |
H3O+ |
|
|
|
|
|
|
|
|
|
|
H O |
H O |
|
CH3 + H3O+ |
||||||||||||||||||||||||||||||||||
H3C |
|
CH |
|
|
CH2 |
|
|
|
|
|
|
H3C |
|
CH |
|
|
CH3 |
|
|
|
|
H3C |
|
CH |
|
CH3 |
|
|
H3C |
|
CH |
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
+OH2 |
|
|
|
|
OH |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HSO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
H3C |
|
|
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OSO2OH |
|
|
|
|
|
|
|
|
||||||
5. |
|
Гідрогалогеновування – приєднання HOHlg. |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||

|
|
|
|
|
|
CH2 + HOCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
34 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
H3C |
|
CH |
|
|
|
|
H C |
|
|
CH |
|
CH |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H3C |
|
|
CH |
|
|
CH2 + Cl2 |
|
|
|
|
+ |
|
|
OH Cl H2O |
|
|
|
|
|
|
|
Cl |
- |
H3C |
|
CH |
|
|
CH2 |
||||||||||||
|
|
|
|
|
- |
H3C |
|
CH |
|
|
|
|
CH2 |
|
|
H3C |
|
CH |
|
|
CH2 |
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
OH |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+OH2 |
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
6.Полімеризація – утворення полімерів за рахунок з’єднання між собою великої кількості ненасичених молекул (мономерів) ковалентними зв’язками, які виникають внаслідок розриву π- зв’язків у молекулах мономерів. При невеликому ступені полімеризації утворюються олігомери. Розрізняють йонну та
радикальну полімеризації в залежності від ініціаторів полімеризації.
Йонна полімеризація ненасичених мономерів відбувається при ініціюванні реакції катіонними та аніонними каталізаторами.
а) Катіонна полімеризація – у присутності каталізаторів H2SO4, HCl, BF3, AlCl3, TICl4.
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
CH |
CH |
|
||||
|
|
|
|
|
CH2 + |
+ |
|
|
|
C+ |
|
3 |
|
|
3 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
H3C |
|
C |
|
|
H3C |
|
|
|
|
|
|
|
|
|
C+ |
|
||||||
|
|
H (HAlCl4) |
|
|
|
|
H3C |
|
C |
|
CH2 |
. . . |
||||||||||
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
CH |
CH |
3 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
||||||||
б) Аніонна полімеризація – каталізатори Циглера – Натта:
Al(C2H5)3 + 4 TiCl4 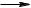 3 C2H5TiCl3 + AlCl3
3 C2H5TiCl3 + AlCl3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2H5 |
|
|
- |
+ |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
C2H5TiCl3 |
+ H2C |
CH |
CH3 |
|
|
CH CH2TiCl3 |
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
Ініціювання: |
|
|
|
CH3 |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
1. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
C H |
|
|
|
|
|
|
|
- |
|
+ |
|
H2C |
|
CH |
|
CH3 C H |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
- |
+ |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
2 |
5 |
CH |
|
|
CH2TiCl3 |
|
|
|
|
|
|
|
|
|
|
|
2 |
5 |
CH |
|
|
CH2 |
C |
|
|
CH2 TiCl3 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
2. |
Ріст ланцюга: |
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
3. Обрив ланцюга: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
C2H5 CH |
|
|
|
CH3 |
|
|
|
|
|
|
|
CH3 |
- |
+ |
|
|
|
|
|
C2H5 |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
CH3 |
||||||||||||
|
CH |
|
CH CH |
|
CH |
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
CH TiCl |
|
|
|
|
CH |
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
CH |
CH CH |
|
C |
|
CH2 + |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
2 |
|
|
|
2 |
2 |
|
|
|
|
|
2 |
3 |
|
|
|
CH |
|
|
|
2 |
|
n |
|
|||||||||||||||||||||||||||
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
2 |
|
2 |
|
|
HTiCl3 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Під дією каталізатора Ціглега-Натта в багатьох випадках утворюються стерео регулярні полімери. При полімеризації на каталізаторі, нанесеному на кристалічний носій добувають ізотактичні полімери або синдіотактичні полімери:

35
H |
CH |
H |
CH3 H |
CH3 H |
CH3 |
H |
CH |
СH |
H H |
CH |
СH |
H |
|
3 |
|
|
|
|
|
3 |
3 |
|
3 |
|
3 |
|
|
|
|
|
|
|
|
|
|
ізотактичний |
|
|
|
|
|
|
|
|
|
синдіотактичний |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
На аморфному носії утворюється атактичний полімер. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CN |
|
||||
|
|
|
|
|
|
|
|
|
|
Радикальна |
полімеризація. |
|
|
|
|
(PhCOO)2, |
|
(CH3)2C |
|
N |
2 |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
в) |
|
Ініціатори |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
азодіізобутиронітрил. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
CH |
|
|
|
|
|
CH |
|
|
|
CH |
|
|
|
|
|
|
CH |
|
|
|
|
|
CH3 |
||||||||||||||||||
|
|
|
3 |
|
|
|
|
|
|
|
3 |
|
|
|
|
C . |
3 |
H3C |
|
CH |
|
CH2 H C |
|
|
|
|
3 |
|
|
|
CH. |
|
|
|
|
|
|
||||||||
|
H C |
|
|
C |
|
N |
|
|
N |
|
C |
|
CH |
|
N |
H C |
|
|
|
|
|
C |
|
|
CH |
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
2 + |
3 |
|
|
|
|
3 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
CN |
|
|
|
|
|
|
CN |
|
|
|
|
CN |
|
|
|
|
|
|
|
CN |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
n H3C |
|
CH |
|
|
CH2 |
... |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
ІІ. Реакції окисненя.
Алкени легко окислюються за місцем етиленового зв’язку. Окислювачем можуть бути кисень повітря, О3, СuO, Ag2O, KMnO4, Cr2O3, OsO4, H2O2, над кислоти СН3СОООН та інші.
А.Окиснення без розриву зв’язку С-С:
1.Реакція Прилежаєва – взаємодія алкенів з H2O2, та іншими над кислотами з утворенням епоксидів:
H2C CH2 + CH3COOOH
CH2 + CH3COOOH  H2C CH2 + CH3COOH O
H2C CH2 + CH3COOH O
2. Каталітичне окиснення киснем повітря:
|
|
Ag, 250 |
0C |
|
|
|
H2C |
|
CH2 + O2 |
|
H2C |
|
CH2 |
|
|
|||||
|
|
|
||||
|
|
|||||
|
|
|
|
O |
||
3. Реакція Вагнера – утворення двохатомних спиртів – гліколей:
3 H2C CH2 + 2 KMnO4 + 4H2O
CH2 + 2 KMnO4 + 4H2O  3 HOCH2CH2OH + 2 MnO2 +2KOH
3 HOCH2CH2OH + 2 MnO2 +2KOH
Відбувається за механізмом цис-циклоприєднання KMnO4 до подвійного зв’язку:

|
- |
36 |
|
|
|
H2C CH2 + MnO4- |
|
|
H2O |
C + MnO3- |
|
|
|
|
|||
C C |
C C |
|
C |
||
O |
O |
O |
O |
HO |
OH |
|
|
||||
|
Mn |
Mn |
|
|
|
O |
O |
O |
O |
|
|
4. Окиснення в присутності солей Pd: |
|
|
|
|
|
H2C CH2 + PdCl2 + H2O |
H3C |
CH=O + Pd + 2 HCl |
|||
Б. Окиснення з розривом зв’язку С-С. Більш енергійна дія окислювачів (нагрівання, збільшення концентрації окиснювача) приводить до розриву молекули алкену за місцем подвійного зв’язку з утворенням карбоксильних сполук або карбонових кислот:
|
H3C C CH |
KMnO4, H2SO4 |
H3C |
C O |
+ CH3COOH |
|
|
||||||
|
нагревание |
|
|
||||||||||
|
|
CH3CH3 |
|
CH3 |
|
|
|
|
|
||||
1 |
. |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||
2. Озоноліз (за Гарієсом): |
|
|
|
|
|
|
|
|
|
||||
|
|
O3 |
|
O |
|
+ H2O |
|
|
O |
|
|
O |
|
H3C CH |
CH2 |
H3C CH |
CH2 |
H3C |
C |
+ H |
C |
||||||
|
H |
||||||||||||
|
|
|
|
O |
O |
- H2O2 |
|
|
H |
|
|
||
|
|
|
|
|
оцтовий альдегід |
мурашиний альдегід |
|||||||
ІІІ.Реакції заміщення – алільне хлорування.
Вреакціях радикального заміщення атоми гідрогену, зв’язані з атомами карбону подвійного зв’язку (вінільні атоми гідрогену), менш реакційно здатні, ніж атоми гідрогену, зв’язані з первинними атомами карбону в алканах. В той же час, атоми гідрогену, що зв’язані з атомами карбону, сусідніми по відношенню до подвійного зв’язку (алільне атоми гідрогену) більш реакційно здатні, ніж атоми гідрогену, що зв’язані з третинним атомом карбону в алканах:
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
||
H |
|
CH2 |
CH |
|
CH2 |
H3C |
|
C |
|
CH3 |
H3C |
|
H |
CH3 |
CH |
|
CH |
|
H |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|||||||||||||||
E, кДж/моль 322,4 |
339,1 |
H |
|
|
427,0 |
510,8 |
||||||||||||||
Алільний |
> |
третинний >> первинний >> вінільний |

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
37 |
|
|
|
|
|
|
|
Це |
|
явище обумовлене |
високою стабілізацією алільного проміжного радикалу за |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
рахунок ефекту спряження. Внаслідок, при термічному хлоруванні |
||||||||||||||||||||||||||||
|
|
|
|
|
|
пропілену: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
450 - 500 0C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
H3C |
|
|
|
CH |
|
CH2 + Cl2 |
|
|
|
|
|
H2C |
|
|
|
CH |
|
|
CH2 + HCl |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
Cl2 |
|
hv |
2 Cl. |
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
. |
||||||||||||||
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
Cl. + H C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
CH |
|
CH |
HCl + |
H C |
|
|
|
|
CH |
|
CH |
|
H C |
|
CH |
|
CH2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
3 |
|
. |
2 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
2 |
|
|
|
|
||||||||||
H2C |
|
CH |
|
CH2 + Cl2 |
|
|
H2C |
|
CH |
|
CH2 + Cl. |
. . . |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
АЛКАДІЄНИ
Алкадієнами або дієновими вуглеводнями називають ненасичені вуглеводні з двома подвійними зв’язками. Загальна формула алкадієнів CnH2n-2.
Залежно від взаємного розміщення подвійних зв’язків поділяють на три групи: а) Кумулени, в яких обидва подвійні зв’язки знаходяться біля одного атому
карбону;
H2C |
|
C |
|
CH |
|
CH2 |
CH3 |
1,2-пентадієн |
|
|
|
||||||
|
|
б) Дієни з ізольованими подвійними зв’язками, в яких подвійні зв’язки відділені однією або кількома групами СH2;
H2C |
|
C |
|
CH2 |
CH |
|
CH2 |
1,4-пентадієн |
|
|
|
||||||
|
||||||||
|
|
|
в) Спряжені (кон’юговані ) дієни, які містять групу атомів С=С–С=С.
H2C |
|
CH |
|
CH |
|
CH |
|
CH3 |
1,3-пентадієн |
|
|
|
|||||||
|
|
|
|||||||
|
|
|
Для спряжених дієнів спостерігається так звані s-цис- та s-транс- ізомери. При цьому s-транс- ізомер 1,3-бутадієну на 12,6 кДж/моль енергетично вигідніший від s- цис-ізомеру.
СПОСОБИ ОДЕРЖАННЯ АЛКАДІЄНІВ
