
- •Редактор Л.М. Тонкошкур
- •УДХТУ, 49005, Дніпропетровськ-5, просп. Гагаріна, 8.
- •Основні характеристики ковалентного зв’язку:
- •Таблиця 1.1
- •Характеристика ковалентних зв'язків
- •Нітроген, пірамідальна будова
- •Оксиген, кутова будова
- •Теорія хімічної будови органічних сполук О.М. Бутлерова
- •Класифікація в залежності від будови вуглецевого ланцюга
- •СПОСОБИ ОДЕРЖАННЯ АЛКАНІВ
- •ХІМІЧНІ ВЛАСТИВОСТІ АЛКАНІВ
- •СПОСОБИ ОДЕРЖАННЯ АЛКЕНІВ
- •ХІМІЧНІ ВЛАСТИВОСТІ АЛКЕНІВ
- •Швидкість приєднання галогеноводнів зменшується в ряду НI > НBr > НCl > НF відповідно із зменшенням міцності зв’язку Н-Hlg.
- •ХІМІЧНІ ВЛАСТИВОСТІ АЛКАДІЄНІВ
- •Природний каучук: цис-1,4-поліізопрен. Гутаперча: транс-1,4-поліізопрен
- •СПОСОБИ ОДЕРЖАННЯ АЛКІНІВ
- •ХІМІЧНІ ВЛАСТИВОСТІ АЛКІНІВ
- •АЛІЦИКЛІЧНІ СПОЛУКИ
- •Циклоалкани. Класифікація, номенклатура та ізомерія
- •Сучасні уявлення про будову циклоалканів
- •СПОСОБИ ОДЕРЖАННЯ ЦИКЛОАЛКАНІВ
- •Спеціальні методи
- •ХІМІЧНІ ВЛАСТИВОСТІ ЦИКЛОАЛКАНІВ
- •АРОМАТИЧНІ ВУГЛЕВОДНІ
- •СПОСОБИ ОДЕРЖАННЯ БЕНЗОЛУ ТА ЙОГО ГОМОЛОГІВ
- •ХІМІЧНІ ВЛАСТИВОСТІ
- •ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ
- •ПЯТИЧЛЕННІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ

2CH3Cl + 2 Na |
24 |
||
H3C |
|
CH3 + 2NaCl |
|
|
|||
Механізм реакції:
CH3Cl + .Na |
|
|
|
.CH3 + NaCl |
||||
|
|
|
||||||
.CH3 + .Na |
|
|
|
CH3Na |
||||
|
|
|||||||
CH3Na + CH3Cl |
|
|
H3C |
|
CH3 + NaCl |
|||
|
|
|
||||||
В реакцію Вюрца переважно вступають нерозгалужені галоїдні алкіли. При взаємодії з
Na суміші |
алоїдних алкілів |
утворюється суміш алканів. Наприклад: |
||||||||||||||||||||||
4 CH3Cl + 4 CH3CH2Cl + 8Na |
|
|
|
|
H3C |
|
CH3 |
+ 2 H3C |
|
CH2 |
CH3 +CH3CH2CH2CH3 + 8 NaCl |
|||||||||||||
|
|
|
|
|
||||||||||||||||||||
2. Реакція Кольбе – електрохімічне відновлення солей карбонових кислот |
||||||||||||||||||||||||
2 CH3CO2Na |
електроліз |
H3C |
|
|
CH3 + 2CO2 + 2NaOH |
|||||||||||||||||||
|
|
|
|
H O |
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Механізм реакції: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
CH3CO2Na |
|
|
|
|
|
|
|
|
|
CH3CO-2 + Na+ |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
CH3CO-2 - 1e |
|
|
|
|
CH3CO2. |
|
|
|
CH3. + CO2 |
|||||||||||||||
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
CH3. |
+ CH3. |
|
|
|
|
|
|
|
|
H3C |
|
CH3 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Na+ + 1e |
|
|
|
|
|
Na. |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
3. Термічне декарбоксилювання солей карбонових кислот |
||||||||||||||||||||||||
CH3CO2Na + |
NaOH |
t |
|
|
CH4 + Na2CO3 |
|||||||||||||||||||
|
|
|
|
|||||||||||||||||||||
ХІМІЧНІ ВЛАСТИВОСТІ АЛКАНІВ
Для алканів характерні реакції заміщення та розщеплення. Розщеплення по зв’язку С-С вимагає меншої енергії (350 кДж/моль), ніж по зв’язку С-Н (413,7 кДж/моль). Але хімічні реакції здебільшого проходять по зв’язку С-Н, оскільки ці зв’язки більш доступні для реагентів.
І. Реакції заміщення. Місце входження замісника в молекулу насиченого вуглеводню визначається в першу чергу енергією зв’язку, вірогідністю утворення та відносною стабільністю проміжної частки (вільного радикалу). В ряду первинний радикал ˂ вторинний радикал ˂ третинний радикал відносна стійкість радикалів зростає за рахунок прояву ефекту надсупряження. Енергія зв’язку С-Н зменшується у ряду:

|
|
|
|
25 |
|
|
|
|
|
|
|
Енергія звязку, кДж/моль |
422,9 |
401,9 |
|
393,6 |
|
|
372,6 |
|
|||
Сполука |
H3C |
|
H |
CH3CH2 |
H |
(CH3)2CH |
|
H |
(CH3)3C |
|
H |
|
|
|
|||||||||
В наслідок перелічених факторів заміщення гідрогену переважно відбувається біля третинного, потім у вторинного і на останок у первинного атому карбону.
1. Галогенування. Реакційна здатність зменшується в ряду F>Cl>Br>I. Реакція з F2 відбувається з вибухом, тому потребує розведення інертним газом, наприклад, аргоном. Реакція з Cl2 та Br2 вже потребує високої температури (3000С) або ініціювання ультро-фіолетовим опроміненням. Реакція з I2 практично не відбувається.
|
|
|
CH4 + 4 F2 |
|
|
|
|
|
|
|
CF4 + 4 HF |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
hv |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
CH4 |
+ Cl2 |
|
|
|
|
CH3Cl + HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
CH4 |
+ |
|
|
I2 |
|
|
|
|
CH3I + HI |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
Механізм реакції галогенування: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
1. Çàðî äæåí í ÿ ëàí öþ ãà: |
|
Ñl |
|
hv |
|
|
|
|
|
|
|
2 Cl . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
2. Ро звито к лан цю га: |
|
Cl .+2CH4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
HCl + CH3. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3. + Ñl2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3Cl |
+ Cl. |
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
3. Î áðèâ ëàí öþ ãà: |
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
+ |
CH3 |
|
|
|
|
|
|
H3C |
|
|
CH3 |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CHCl.3 |
++ |
ClCl. |
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl23 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
2. Нітрування розведеною нітратною кислотою за Коноваловим |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
H3C |
|
CH3 |
|
+ HNO3 |
|
|
|
|
|
H3C |
|
CH2 |
|
NO2 + H3C |
|
CH2 |
ONO + H2O |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Механізм реакції: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
1. N2O4 |
|
|
|
|
|
|
|
|
|
|
|
2 .NO2 |
або |
|
HO-NO2 |
|
|
|
|
|
|
|
|
HO . + .NO2 |
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
2. |
|
H3C |
|
|
|
CH3 + |
|
.NO2 |
|
|
|
|
|
H3C |
|
|
|
|
CH2. + HNO2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3. |
|
HNO2 + HNO3 |
|
|
|
|
|
|
N2O4 |
|
+ H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||
4. |
|
|
|
|
|
. . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
CH2 + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
H3C |
|
|
NO2 |
|
|
|
|
|
|
H3C |
|
|
|
|
|
CH2 |
NO2 + H3C |
|
CH2 |
O |
|
|
N |
|
O |
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
3. Сульфохлорування |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|||||||
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
SO2Cl + H3C |
|
|
|
|
|
|
CH3 + 2HCl |
|||||||||||||||||||||||||||||||||||
H3C |
|
|
|
CH3 + SO2 + |
2Ñl2 |
|
|
|
|
|
|
H3C |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
C |
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|||||||||||||||||

26
Механізм реакції:
1. |
Ñl2 |
|
hv |
|
|
|
2 Cl . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
2. |
H3C |
|
|
|
|
|
|
CH |
|
CH3 |
+ |
|
|
|
|
|
|
H3C |
|
|
|
|
C* |
|
|
|
CH3 |
+ H3C |
|
|
CH |
|
CH2* + HCl |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
SO2. |
|
|
CH3 |
||||||||||||||||||||
3. |
H3C |
|
|
|
|
CH |
|
|
|
|
CH2* + SO2 |
|
|
|
|
|
|
|
H3C |
|
|
|
|
CH |
|
|
|
CH |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
CH3 |
SO2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
3 |
|
|
|
|
|
|
|
+ Cl . |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
4. H3C |
|
|
|
|
|
CH |
|
|
|
|
CH |
|
|
+ Ñl2 |
|
|
|
|
|
|
H3C |
|
|
|
|
|
|
|
|
CH |
|
|
|
CH |
|
|
SO2Cl |
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|||||||||||||||||||
5. H C |
|
|
|
C* |
|
|
|
|
CH |
+ |
SO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ Cl . |
|
|
|
|
|
||||||||||||
|
H3C |
|
C* |
|
|
|
|
CH3 |
+ |
|
Ñl2 |
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
|
CCl |
|
|
CH3 |
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
Сульфохлорування відбуваєтьтся лише за первинними та вторинними атомами карбону. Через просторові ускладнення воно не можливе за третинними атомами карбону.
4. Сульфоокиснення:
H3C |
|
CH3 + 2 SO2 + O2 + H2O |
|
H3C |
|
CH2 |
SO3H + H2SO4 |
|
|
|
5. Окиснення
Кисень повітря та звичайні окисники (KMnO4, K2CrO4, K2Cr2O7) окиснюють алкани тільки при високих температурах з розривом С–С-зв’язків. При цьому в незначній кількості одержується кінцевий продукт окиснення – діоксид карбону СО2. Окиснюються алкани при t ≈ 150°C в присутності каталізаторів (солі Mn, Co, V).
Розглянемо окиснення н-бутану за вторинним атомом карбону.
При високих температурах внаслідок відщеплення атомів водню від зв’язку 
або при розриві зв’язку 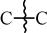 утворюються вільні радикали R., які далі взаємодіють з молекулярним киснем з утворенням пероксидного радикала:
утворюються вільні радикали R., які далі взаємодіють з молекулярним киснем з утворенням пероксидного радикала:

27
Подальше окиснення спиртів і альдегідів призводить до утворення карбоксильних сполук – карбонових кислот.
6. Крекінг Крекінг – це високотемпературне (470-540 °С) розщеплення алканів, що приводить
до утворення суміші насичених та ненасичених вуглеводнів з меншою молекулярною масою, ніж вихідний вуглеводень. Чим довший вуглеводневий ланцюг, тим легше він розщеплюється. Перетворення алканів при вищих температурах (700-1000 °С) називається піролізом.
Розрізняють термічний і каталітичний крекінг. |
|||
Метан розщеплюється лише при високій температурі: |
|||
а) CH4 ѕ ѕ ѕ ѕ→ C + 2H2 |
|
||
< 1000 ° C |
|
|
|
Цей процес використовують як дешевий метод одержання водню і газової сажі. |
|||
1500 ° C |
|
HC є CH + 3H2 |
дешевий промисловий метод одержання |
б) 2CH4 ѕ ѕ ѕ |
→ |
ацетилену |
|
|
|
|
|
Термічний крекінг – вільнорадикальний процес, у результаті якого утворюються, головним чином, ненасичені вуглеводні (мономери):
