
Patologija_obmiena-2012
.pdf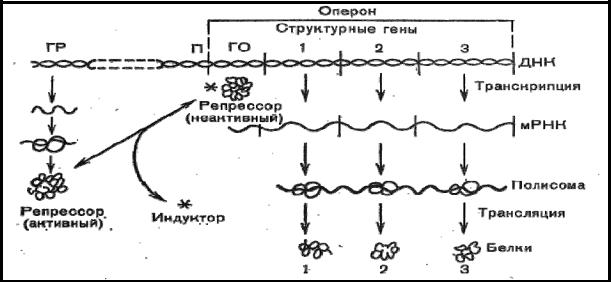
Рис.20а. Регуляция синтеза белка в клетке
Регулирующий ген ведает синтезом репрессора, который является ферментом и тормозит деятельность структурных генов. Репрессор взаимодействует с геномоператором, который составляет единое целое со структурными генами. Репрессор может быть в активном и неактивном состоянии. Активный репрессор подавляет геноператор и синтез белка на структурных генах прекращается. Активатором репрессора может быть определенная концентрация белка в клетке. При недостатке белка репрессор заторможен и синтез белка в структурных генах увеличивается. Анаболические гормоны, канцерогенные вещества тормозят репрессор.
Процесс биосинтеза поставляет белки не только для роста организма или для секреции в среду. Все белки живых клеток со временем претерпевают распад до составляющих их аминокислот, и для поддержания жизни клетки должны синтезироваться вновь.
Гормоны, регулирующие белковый обмен, делятся на
анаболические и катаболические. К анаболическим гормонам относятся соматотропный и гонадотропные гормоны передней доли гипофиза, гормоны половых же-
121
лез, инсулин. Гормоны щитовидной железы в физиологических дозах в растущем организме стимулируют синтез белка, морфологическую и функциональную дифференцировку тканей. Нормальные дозы в условиях взрослого организма при достаточном и усиленном белковом питании проявляют катаболический эффект, который не приводит к нарушению азотистого равновесия и способствует выведению избытка белка. Гиперпродукция тиреоидных гормонов и глюкокортикоидов оказывает катаболическое действие.
Причинами нарушения синтеза белка в клетке являются:
недостаточное содержание белков и незаменимых аминокислот в пище (например, при недостатке триптофана развивается гипопротеинемия, аргинина – снижается сперматогенез, метионина – развивается жировая инфильтрация печени, валина – возникают мышечная слабость, задержка роста, исхудание и развитие кератозов);
недостаток анаболических гормонов;
дефицит кислорода и недостаток выработки АТФ;
мутации структурных и регулирующих синтез белка генов (при включении вместо глутаминовой кислоты валина в молекулу гемоглобина развивается серповидноклеточная анемия); повреждение гена-репрессора (например, при блокировании его канцерогенными веществами возникает беспрерывный синтез белка);
нарушения отдельных этапов биосинтеза белков: транскрипции и трансляции (антибиотики, стрептомицин);
нарушение нейроэндокринной регуляции (перерезка нервов, недостаток анаболических гормонов: CТГ, половые, инсулин, избыток тироксина, глюкокортикоидов).
122
патология ферментов cинтеза белка (наследственные заболевания, авитаминоз, действие повреждающих факторов, ацидоз).
болезни печени.
Кроме приобретенных существуют наследственные дефекты биосинтеза белка (нарушения образования факторов свертывания крови, гемоглобина, структурных белков в организме).
Причины повышения распада белка в организме
избыточное поступление катаболических гормонов, активирующих внутриклеточные протеиназы, локализованные в лизосомах;
повышение проницаемости лизосом под воздействием бактериальных токсинов, продуктов распада тканей, ацидоза, гипоксии и других факторов, что способствует выведению катепсинов и усилению катаболических процессов;
углеводный голод;
сахарный диабет (недостаток инсулина);
повышение уровня катаболических гормонов: тиреотоксикоз, болезнь Иценко-Кушинга;
повышение активности симпатической нервной системы;
лихорадка;
операционная или другая травма (за 4 дня после операции потеря белка составляет 28 г, что равноценно распаду 1кг мышечной ткани)
Причины избыточной потери белка
кровотечение (1 л крови соответствует потере 30-40 г плазменных белков и 70 г гемоглобина). Восстановле-
123
ние белков крови после кровопотери происходит: фибриногена – за 1сутки, глобулинов – за 1-2 суток, альбуминов – за 3-8 суток;
ожоги (через кожу);
болезни почек (протеинурия);
непроходимость кишечника, перитониты;
дренажи, нагноения, язвы, пролежни.
Обмен аминокислот и его нарушение
Общая характеристика обмена аминокислот
Организм человека и большинства других животных сохранил способность синтезировать все аминокислоты за исключением девяти т.н. незаменимых аминокислот. Поскольку кетокислоты, соответствующие этим девяти, не синтезируются, незаменимые аминокислоты должны поступать с пищей. Остальные заменимые аминокислоты синтезируются в организме. В каждом случае ряд химических реакций приводит к образованию α-кетокислоты. α- кетоглутаровая (α-кетокислота) – компонент цикла трикарбоновых кислот, участвует в связывании азота. Азот глутаминовой кислоты может быть затем передан любой из других a-кетокислот с образованием соответствующей аминокислоты.
В организме млекопитающих аминокислоты используются не только для биосинтеза белков, но и как исходный материал для синтеза многих азотсодержащих соединений.
Аминокислота тирозин является предшественником гормонов адреналина и норадреналина.
Простейшая аминокислота глицин служит исходным материалом для биосинтеза пуринов, входящих в состав
124
нуклеиновых кислот, и порфиринов, входящих в состав цитохромов и гемоглобина.
Аспарагиновая кислота – предшественник пиримидинов нуклеиновых кислот.
Метильная группа метионина передается ряду других соединений в ходе биосинтеза креатина, холина и саркозина.
При биосинтезе креатина от одного соединения к другому передается также и гуанидиновая группировка аргинина.
Триптофан служит предшественником никотиновой кислоты, а из валина в растениях синтезируется витамин пантотеновая кислота.
Азот, поступивший в организм в виде аминокислот и не израсходованный в процессах биосинтеза, довольно быстро выводится из организма с мочой. В печени неиспользованные аминокислоты передают свой азот a- кетоглутаровой кислоте с образованием глутаминовой кислоты, которая дезаминируется, высвобождая аммиак. Далее азот аммиака может либо на время запасаться путем синтеза глутамина, либо сразу же использоваться для синтеза мочевины в печени.
Почти весь аммиак превращается в печени в мочевину, вследствие чего свободного аммиака в крови обычно почти нет. Однако при некоторых условиях довольно значительные количества аммиака содержит моча. Аммиак образуется в почках из глутамина и переходит в мочу в обмен на ионы натрия, которые таким образом реабсорбируются и задерживаются в организме. Этот процесс усиливается при развитии ацидоза – состояния, при котором организм нуждается в дополнительных количествах катионов натрия для связывания избытка ионов бикарбоната в крови.
125

Таблица 22 – Содержание аминокислот в плазме крови человека
Аминокислота |
Содержание |
Аминокислота |
Содержание |
|
мг/дл |
|
мг/дл |
Аланин |
2,5-7,5 |
лизин |
1,4-5,8 |
Аргинин |
1,2-3,0 |
метионин |
0,2-1,0 |
Аспарагин |
0,5-4,4 |
фенилалалин |
0,7-4,0 |
Аспарагиновая |
0,01-0,3 |
пролин |
1,5-5,7 |
кислота |
|
|
0,3-2,0 |
Глутаминовая |
0,4-4,4 |
серин |
|
кислота |
|
|
0,9-3,6 |
Глутамин |
4,5-10 |
треонин |
|
Глицин |
0,8-5,4 |
триптофан |
0,4-3,0 |
Гистидин |
0,8-3,8 |
тирозин |
0,8-2,5 |
Изолецин |
0,7-4,2 |
валин |
1,9-4,2 |
Лейцин |
1,0-5,2 |
цистин |
0,8-5,0 |
Избыточные количества пиримидинов распадаются в печени через ряд реакций, в которых высвобождается аммиак. Избыток пуринов подвергается окислению с образованием мочевой кислоты, выделяющейся с мочой.
Аминокислоты в организме используются для образования белков и других соединений (рис. 21).
При избыточном поступлении либо дефиците углеводов аминокислоты подвергаются окислительному расщеплению.
Важнейшим этапом обмена аминокислот является межуточный обмен, который поставляет субстраты для работы цикла Кребса, тем самым поддерживая энергетический обмен, обеспечивает образование заменимых аминокислот и синтез белка и др.
126
Таблица 23 – Функции аминокислот и их применение в клинике
Амино- |
Функции |
Применение в клинике |
кислота |
|
|
Аргинин |
источник оксида азота, |
Улучшение обезврежи- |
|
стимулятор выработки |
вающей ф-ции печени, |
|
инсулина, соматотроп- |
повышение иммуните- |
|
ного гормона, антиаг- |
та, улучшение реологи- |
|
регант |
ческих свойств крови, |
|
|
стимуляция роста, |
|
|
ишемические процессы |
Аспаргиновая |
нейромодулятор воз- |
повышение возбудимо- |
кислота |
будимого типа. |
сти нервной системы, |
|
связывание NH3 |
повышение устойчиво- |
|
синтез пиримидинов и |
сти к кислородному го- |
|
нуклеопротеидов |
лоданию, интоксикации |
|
|
наркотиками. |
Валин |
нормализующее влия- |
поражение печени, пе- |
|
ние на обмен веществ. |
ченочная энцефалопа- |
|
при недостатке оста- |
тия. |
|
новка роста |
|
Глутаминовая |
нейромедиатор возбу- |
при заболеваниях ЦНС |
кислота |
димого типа, связыва- |
(психозы, реактивные |
|
ние NH3, |
состояния, эпилепсия) |
|
источник ГАМК |
|
Глутамин |
перенос NH3 в печень, |
нарушение обмена глу- |
|
глюконеогенез, |
таминовой Ат, пролина |
|
синтез пуринов и на- |
и др.) |
|
уклеопротеидов |
|
Гаммаами- |
медиатор торможения |
при повышенной воз- |
номасляная |
в ЦНС, |
будимости ЦНС (эпи- |
кислота |
повышение устойчиво- |
лепсия, ишемический |
(ГАМК) |
сти к гипоксии |
инсульт, гипертониче- |
|
|
ская болезнь) |
|
|
|
Гистидин |
источник гистамина |
гепатиты, атеросклероз, |
|
|
язвенная болезнь |
127
Амино- |
|
Функции |
|
Применение в клинике |
|||
кислота |
|
|
|
|
|
|
|
Глицин |
нейромодулятор |
тор- |
противоболевой |
эф- |
|||
|
мозного типа в основ- |
фект, |
|
|
|||
|
ном в спинном мозге, |
седативное действие, |
|||||
|
синтез |
порфиринового |
улучшение |
обмена |
ве- |
||
|
кольца |
гемопротеинов |
ществ в головном мозге |
||||
|
(Нb и др. цитохромов) |
|
|
|
|||
Изолейцин |
участие в глюконеоге- |
регуляция обмена ами- |
|||||
|
незе, |
|
|
|
нокислот |
|
|
|
в составе окситоцина |
|
|
|
|||
Лейцин |
иммуномодулятор |
онкологические заболе- |
|||||
|
|
|
|
|
вания |
|
|
Лизин |
незаменимая |
амино- |
онкологические заболе- |
||||
|
кислота, с-з Нв, в кро- |
вания |
|
|
|||
|
ветворении, |
входит в |
|
|
|
||
|
состав |
фибриногена, |
|
|
|
||
|
участвует в отложении |
|
|
|
|||
|
кальция в костях, ак- |
|
|
|
|||
|
тивация ИС |
|
|
|
|
|
|
Метионин |
образование |
холина |
при поражениях пече- |
||||
|
(АцХ), таурина, липо- |
ни, алкоголизме, сахар- |
|||||
|
каина, |
катехоламинов, |
ном диабете и др. |
|
|||
|
источник |
SH |
групп |
|
|
|
|
|
белков и др., глутатио- |
|
|
|
|||
|
на, таурина (компо- |
|
|
|
|||
|
нента |
желчных ки- |
|
|
|
||
|
слот), цистеина (фос- |
|
|
|
|||
|
фолипиды, лецитин) |
|
|
|
|||
Пролин |
В состав коллагена |
при нарушении синтеза |
|||||
|
|
|
|
|
коллагена |
|
|
Серин |
нейромодулятор |
тор- |
улучшение |
обменных |
|||
|
мозного типа, источ- |
процессов |
в головном |
||||
|
ник цистеина, таурина, |
мозге |
|
|
|||
|
глутатиона, |
фисфоли- |
|
|
|
||
|
пидов |
|
|
|
|
|
|
Таурин |
продукт серусодержа- |
поражение печени, |
|
||||
|
щих |
аминокислот, |
заболевния с активаци- |
||||
128
Амино- |
|
Функции |
|
Применение в клинике |
||||
кислота |
|
|
|
|
|
|
|
|
|
нейромодулятор анти- |
ей окислительных про- |
||||||
|
оксидант, |
|
радиопро- |
цессов (лучевая бо- |
||||
|
тектор, |
стабилизатор |
лезнь, |
реперфузионный |
||||
|
клеточных мембран |
|
синдром и др.) |
|
||||
|
|
|
|
|
|
|||
Тирозин |
источник |
|
тироксина, |
недостаточность |
щито- |
|||
|
трийодтиронина, |
ме- |
видной железы, нару- |
|||||
|
ланина, катехоламинов |
шение |
функции |
нерв- |
||||
|
|
|
|
|
|
ной системы |
|
|
|
|
|
|
|
||||
Треонин |
в |
составе |
инсулина, |
по действию близок к |
||||
|
гликопротеидов и дру- |
изолейцину |
|
|||||
|
гих |
биологически |
ак- |
|
|
|
||
|
тивных веществ |
|
|
|
|
|||
Триптофан |
образование |
серотони- |
снотворное, антинарко- |
|||||
|
на, никотиновой ки- |
тическое |
|
|||||
|
слоты, |
гемоглобина, |
противоопухолевое |
|||||
|
сывороточных белков |
средство |
|
|||||
|
|
|
|
|||||
Цистеин |
антиоксидант |
|
профилактика лучевых |
|||||
|
|
|
|
|
|
поражений, |
|
|
|
|
|
|
|
|
лечение катаракты |
||
Фенилаланин |
источник |
тирозина, в |
источник тирозина |
|||||
|
состав вазопрессина |
|
|
|
||||
Нарушения межуточного обмена аминокислот
Межуточный обмен аминокислот складывается из реакций дезаминирования, трансаминирования и декарбоксилирования.
129
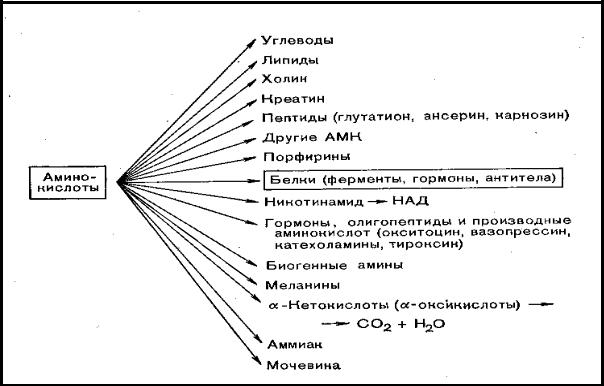
Рис. 21. Метаболизм аминокислот
Дезаминирование
Это этап межуточного обмена аминокислот, при котором происходит образование кетокислот и аммиака. Дезаминирование осуществляется ферментом аминооксидазой, коферментом которой является ФАД или НАД.
L-глутамат → NH3 + α-кетоглутарат
Дезаминирование является универсальным процессом в образовании аминокислот, когда неиспользованные для синтеза белка аминокислоты теряют аминогруппы и превращаются в безазотистые продукты. Из аминогруппы образуется аммиак, а из безазотистой части – кетокислоты.
Благодаря образованию α-кетоглутарата дезаминирование обеспечивает работу цикла Кребса, а благодаря
130
