
биотехнология кітап
.pdf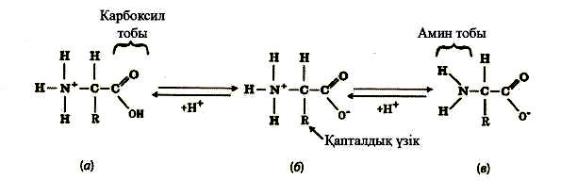
ІІІ тарау АҚУЫЗДЫҚ ИНЖЕНЕРИЯ НЕМЕСЕ ПРОТЕОМИКА НЕГІЗДЕРІ
Ақуыздар құрылымы
Биотехнологиядағы масштабты зерттеулер қатарына жататын«Адам геномы» басталар алдында, ғалымдар алда 100 мың шамасындағы гендердің нуклеотидтік тізбегін анықтау керек болатын шығар деп топшылаған болатын. Олар адамдардағы 100 мың жасуша ақуызының əрқайсысына тиісті өз гендері бар деп ойлаған еді. Осы зерттеулерді жүргізу барысында тек қана25-30 мың геннің ғана анықталуы, əрбір геннің бірнеше ақуыз синтезіне жауап беретініне көз жеткізді.
1838 жылы голландия ғалымы Мульдер алғаш рет барлық тірі ағзалард кездесетін күрделі органикалық затты белгілеу үшін«протеин» (ақуыз) терминін қолданған болатын. Тірі ағзаның құрамына кіретін ақуыздар немесе протеиндер (грекшеден protos – бірінші, алғашқы) органикалық қосылыстардың 50-85%-ын құрайды.
1871 жылы орыс химигі Н.Н.Любавин ақуыздардың амин қышқылдарынан тұратынын анықтады.
Қазіргі кезде көптеген аурулардың шығу себебі, ақуыз метаболизмінің бұзылуынан туындайтыны белгілі болып отыр. Сондықтан, ақуыздар мен олардың жұретін зат алмасу ерекшеліктерінің терең зерттелуі, денсаулық сақтау саласында гендерді зерттеудегіден де артық жетістіктеріне алып келуі мүмкін деген пікірлер жасалынуда.
Ғылымдағы ақуыздар түзілуі мен олардағы метаболизм үдерісінің жүруі
зерттейтін бағыт – протеомика деп атала бастады. |
|
||
Ақуыздардың |
құрылымына тоқталу үшін, олар жөніндегі бірнеше маңызды |
||
мəселелерді |
еске |
түсіруге тура келеді. Ақуыздардың |
амин қышқылдарынан |
тұратыны |
белгілі. |
Амин қышқылдарының шеткі жақ |
үзіктері(цепь), кейбір |
жағдайларда циклдық құрылым түзетін көмірсутекті үзіктерінен құрылады. Амин
қышқылдары |
өз |
кезегінде, аминдік |
топтарынан (–NH2) жəне |
карбоксилді |
топтарынан |
(–СООН) |
тұратыны бізге |
белгілі. Амин қышқылдары |
бір-бірімен |
пептидтік байланыс арқылы жалғаса келе, полимер түзеді.
Пептидтік байланыс – бір амин қышқылының аминдік тобы мен екінші амин қышқылының карбоксильді тобы жалғасуы арқылы жүзеге асады (сурет -9).
9-сурет. Пептидтік байланыстың түзілуі
40
Көптеген ақуыздардағы тиесілі атқарылатын жұмыстардың дұрыс ,жүру олардың пішіні мен құрылымына байланысты болады. Құрамына бірдей амин қышқылдарының түрлері кіргенімен, өздерінің молекуласында ами қышқылдарының орналасуы бойынша айырмашылықтары байқалған ақуыздардың пішіндері əр қилы келеді жəне соған сəйкес атқаратын қызметтері де өзгеше болады. Сонымен бірге, бір-біріне өте ұқсас ақуыздар бірдей қызметтерді атқаруы да, атқара алмауы да мүмкін.
Ақуыздардың құрылымының төрт түрі белгілі:
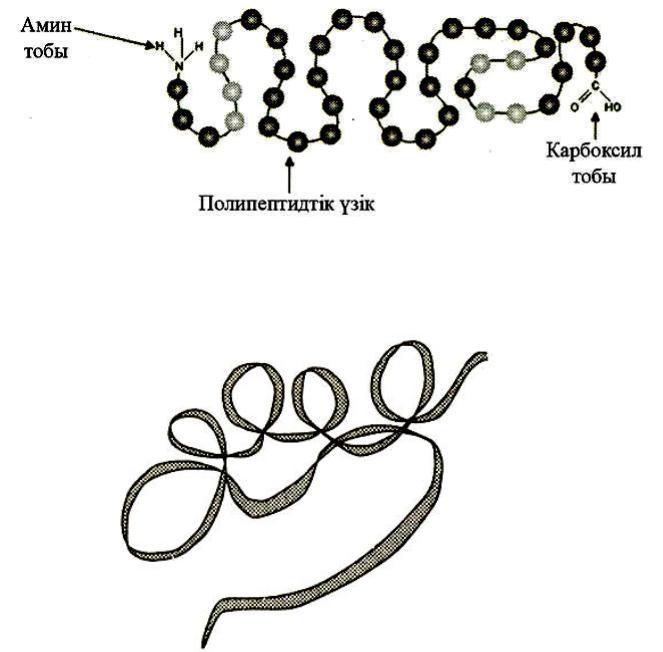
-бірінші реттік құрылымы – амин қышқылдары қалдықтарының бір-бірімен пептидтік байланыс арқылы тізбектеле жалғасуы(сурет-10). Ақуыздың бұл түрі рибосомада қалыптасады.
10-сурет. Ақуыздың бірінші реттік құрылымы
-екінші реттік құрылымы – радикалдар арасындағы сутектік байланысының пайда болуы себепті, ақуыз молекуласының жекелеген бөліктері спираль тəрізденіп бұрала бастайды, немесе қыртысты қабаттар түзеді (сурет-11).
11-сурет. Ақуыздың екінші реттік құрылымы
41

-үшінші реттік құрылымы – мұндағы пайда болатын қосымша байланыстар нəтижесінде көрініс табады (сурет-12).
12-сурет. Ақуыздың үшінші реттік құрылымы
-Төртінші реттік құрылымы – көптеген ақуыздарда (бірақ барлығында емес) кездесетін, үшіншілік құрылымы бар бірнеше ақуыз молекуласының, бір-бірімен амин қышқылдарының радикалдары арқылы байланысқа түсуі нəтижесінде пайда болады. Мұның нəтижесінде шар тəрізді молекулалы(глобулярлы ақуыздары) немесе жіпшумақ тəрізденген(фибриллярлы) ақуыздыр қалыптасады. Ферменттік белсенділік көрсету қабілетіне ие ақуыздар– көбінесе глобулярлы (сурет-13), ал құрылымдық ақуыздары – фибриллярлы тобына жатады(мысалы шаш немесе бұлшық еттері құрамына кіретіндер).
13-сурет. Ақуыздың төртінші реттік құрылымы
42
Радикалдар арасындағы өзара əрекеттер байланыстардың бірнеше түрлер
арқылы жүзеге асырылады. Олар бір-біріне жай ғана тартылуы арқылы (гидрофобты |
|
||||
əрекеттер), не болмаса сутектік байланыс түзуі нəтижесінде |
бір атомда |
пай |
|||
болатын бөлімдік теріс зарядының екінші атомда көрініс |
беретін |
оң |
зар |
||
тартылуы барысында жүзеге асырылуы мүмкін. Көп таралатын байланыстар түріне |
|
||||
дисульфидті байланыс жатады. |
|
|
|
|
|
Дисульфидті |
байланыс деп – күкірттің екі атомы арасында |
пайда |
болатын |
||
ковалентті байланыс айтылады. Цистеин амин қышқылы құрамына кіретіндіктен, |
|||||
көптеген ақуыздар сульфидтік топтарына ие болады. |
|
|
|
|
|
Коваленттік |
байланыс – электрондардың |
жалпыландырылуы, |
ортақ |
|
|
электрондық жұптарының түзілуі екендігін еске түсіре кетейік.
Дисульфидтік байланыс эукариот жасушаларының цитоплазмаларында пайда болады. Прокариот жасушаларында болса, мұндай байланыс түрінің пайда болуына алып келетін жағдайлар қалыптаса алмайды. Егерде, сіздер, құрылымы үшін дисульфидтік байланысы өте қажет болатын ақуызды бактерия жасушасы синтездегіңіз келсе, онда мұндай ақуыздың соңғы конформациясының қалыптаса қоймайтынын есепке алуыңыз керек болады. Сонымен, сіздер жасуша метаболизмін оған жат болып келетін ақуыз синтезіне бағыттағыңыз келетін болса, төмендегі келтірілген аспектілерді білуіңіз керек болады:
–көптеген онжылдықтар бойынша генетиктерде қалыптасқан «бір ген – бір ақуыз» сөз тіркесінің, қазіргі кезде ағат пікір екендігін есіңізде ұстаңыз. Белгілі бір гендер бірнеше ақуызын коделей (кодтай) алады;
–ақуыздың атқаратын қызметтері, олардың молекуласы қабылдайтын пішінге (конформация) байланысты болады;
–ақуыздың соңғы пішіні, күкірттің екі атомдары арасында болатын дисульфидті байланыстың қалыптасауына байланысты тұрақтанады. Мұндай байланыс түрі бактериялды жасушаларында қалыптаса алмайды;
–ақуыздың пішіні тек қана оның химиялық құрамы ғана емес, сонымен бірге
жасушада |
кездесетін |
басқа |
да |
молекулаларының |
əсеріне |
байл |
қалыптасады. |
Мұндай |
молекулалар |
ақуыздың дұрыс конформация |
түзуіне |
||
жəрдемдеседі; |
|
|
|
|
|
|
–ақуыздың пішіні өзгеріп тұруы мүмкін. Басқаша айтқанда, ақуыз жасушаның қажеттілігіне орай «ұйып» немесе қайтадан «жазылып» тұру қасиетіне ие;
–қоршаған ортада қалыптасқан жағдайға байланысты, жасушаның құрамындағы
ақуыздардың типі мен саны əрдайым өзгеріп тұрады.
Қазіргі кезде биоинженерлер, жасуша ішіндік ортасы өзгертілген мутантты бактерияларын пайдалану немесе жартылай пайда болған ақуызды ,алыпоның құрылымының ақырғы қалыптасуын жасушадан тыс жағдайда мүмкіндіктеріне ие болды.
|
|
|
2. Ақуыз фолдингі |
|
|
|
||
Амин |
қышқылдарының |
орналасу |
реті |
ақуыз |
молекуласының |
пі |
||
анықтайтын жалғыз белгі емес. Жасушада ақуыздың фолдингіне белсене қатысатын |
|
|||||||
арнаулы |
молекулалар |
да |
болады. Осындай |
|
ақуыз |
фолдингіне |
қатысаты |
|
молекулалар жиынтықтарын бірнеше типтерге бөледі. Мысалы, ақуыз |
фолдингі |
|
||||||
43
қарқынын арттыратын молекулалар – фолдинг катализаторлары деп аталса, ақуыз пішінін өзгертуге ат салысатындары– фолдинг шаперондары делінеді. Осындай шаперондік роль атқаратын молекулаларының төрт типі белгілі:
1.Ақуыздардың дұрыс фолдингін қамтамасыз ететін молекулалар(фолдинг-
шаперондары – folding chaperones)
2.Жартылай ұйыған ақуыз молекуласын білгілі бір қалыпта ұстап тұру үшін жаратылған молекулалар (ұстап тұрғыш шаперондар - holding chaperones)
3. |
Дұрыс |
емес |
пішінді |
ақуыздарды |
айналдыратын |
|
|
(дезагрегациялаушы шаперондар – disaggregating chaperones) |
|
||||
4. |
Жасушалар мембраналары арқылы тасымалданатын ақуыздарға ілесетін |
|||||
|
шаперондар (секреторлық шаперондар – secretory chaperones) |
|
||||
Фолдинг-шаперондары |
ақуыздардың |
дұрыс |
конформация |
қабылдауы |
||
көмектеседі. Олардың көбісі кішігірім қанттық немесе петидтік негіздерден тұрады. |
||||||
Фолдиг шаперондары молекулаларының атқаратын қызметтеріне түсіндірме жасау үшін, зауыттағы жинау конвейерінің жұмыс істеу ретін мысалға келтірейік. Айталық, қандай да бір қондырғының жиналуы барысында, олардың бөлшектерінің
қозғалмай |
тұруы |
үшін, қатырма (фиксатор) ретінде |
арнайы |
тартқыштар, |
|||
бекіткіштер, |
скобалар |
сияқты |
қосалқы |
заттар |
қолданылады. Қондырғыны |
||
жинастырудың келесі кезеңінде, жаңағы қосалқы заттар қажетсіз болып қалып, |
|||||||
қондырғының |
басқа |
бір |
бөлігін |
бекіту |
үшін қажет |
болатын |
қосымша за |
(қысқыштар, жапсырғыштар, |
түйрегіштер жəне т.б. тəрізді) пайдаланылуы мүмкін. |
||||||
Көлемі шағын келетін фолдинг-шаперон молекулалары, ақуыз синтезі конвейерінде жүретін əртүрлі кезеңдерінде осындай лайықты қызметтерін атқарып отырады. Егерде ақуыздар қажетті пішіндерін алмаған болса, бұл шаперондардың тиісті қызметтерін атқармағандығын білдіреді жəне қосындылар(включений) деп аталатын ерімейтін агрегаттар түрінде жинақтала береді.
Жасуша құрамында су мөлшері көп болатыны белгілі. Мұның ішіндегі молекулалар көбінесе зарядталған, яғни гидрофильді болып , келсеал зарядталмағандары гидрофобты деп аталады. Ұзына бойына тізбектеле орналасқан ақуыз құрылымында гидрофильді бөліктері мен гидрофобты тұстары да кездеседі.
Сулы орта жағдайында ақуыздың гидрофобты жасушалы бөлігі молекуласының ішкі жағына қарай ығысып, сырт жаққа гидрофильді бөліктерін қояды жəне олар су молекулаларымен əрекетке түседі. Көлемі шағын келетін фолдинг-шаперон молекулаларының негізгі қызметтері– ақуыздың гидрофобты бетімен əрекетке түсу арқылы оларды зарядтау, немесе керісінше – қажетті жағдайда зарядталған бөліктерін бүркеу арқылы ақуыздардың дұрыс пішінге ие болуларын қамтамасыз ету.
Ұстап тұрғыш шаперондар, фолдинг шаперондары босап, ақуыздармен өз қызметтерін бастағанға дейін, ақуыздарды тұтып-сақтап тұратын резервуар қызметін атқарады. Ұстап тұрғыш шаперондары, жасуша ішіндегі жағдай ақуыздың дұрыс фолдингін қамтамасыз ете алатын дəрежеге жеткенше, ақуыздарға қажетті химиялық жəне жылулық ортаны жасап тұрады. Бұл, жасушаның ақуыздың қате
фолдингінің жүрмеуін қамтамасыз ету үшін пайдаланатын механизмдерінің біреуі. |
|
|||
Екінші |
механизмі |
дезагрегациялаушы |
шаперондарды |
пайд |
байланысты. |
Дезагрегациялаушы |
шаперондар қате |
фолдинг жүрген ақуыздарды |
|
44
(дұрыс түзілмеген) рефолдинг (қайта шешу) қызметін атқарады. Олар жасушадағы дұрыс түзілмеген ақуыздарды бақылап, қажетсіз өнімдерден тазарту(утилизация) қызметін атқарады. Осындай механизмнің бар болғанымен, жасушада ақуыздардың белгілі бір пайызы қажетсіз қалдық қосындылары(включений) ретінде жиналып қалады. Мұндай қалдықтар жасушада кішігірім тығыз түйіршіктер ретінде байқалып тұрады.
Шаперондардың ерекше қасиеттері қатарына, олардың молекулаларының бір ғана ақуыз фолдингін басқармайтындығын айтуға болады. Ақуыздың қате фолдингі нəтижесін талдаумен айналысқан ғалымдар, кездейсоқ жағдайда бұзылған молекула арасынан, шаперондардың құрылымымен ұқсастарын тапқан. Олар қате ақуыз фолдингі нəтижелерін түзетуші молекулаларын анықтаған. Сондықтан, шаперондар тегінің универсалдығын негізге ала отырып, оны қандай да бір ортадағ ақуыздардың қате фолдингі нəтижелерін түзету мақсатындағы биоинженерл жұмыстарында пайдалануға болады деген қортындыға келуге болады.
3. Протеолиз немесе ақуыздың ыдырауы
Ақуыз метаболизмін қадағалайтын жасушалық жүйе, құрамындағы амин қышқылдарын қайта пайдалану мақсатында ақуыздарды ыдырату қызметіне и болады. Ақуыздардың ыдырауы – протеолиз деп аталады. Ыдырауға тиесілі көптеген ақуыздар бірнеше рет фолдингке жəне рефолдингке ұшыратылады. Ақуыз протеолизіне қатысатын ферменттер – протеолетикалық ферменттер деп аталады жəне олар протеасома түзеді. Көбінесе бұлар ақуыздарды кішігірім бөлшектерге кесуге арналған, цилиндр пішінді құрылымдар болып келеді.
Протеолетикалық ферменттер жасуша ішінде (аномальдібұрыс) полипептидтерінің жинақталып қалуының алдын алады жəне амин қышқылдарын
түзуге |
қажетті |
энергия |
көздерін |
сақтайды. Эукариотикалық |
жүйелерде, |
|
ақуыздардың ыдырауы алдында, олардың маркировкасы жүреді. Эукариотикалық |
||||||
жүйелерінде маркерлер барлық жерлерінде кездесуі себепті – убиквитиндер (ағылш. |
||||||
Ubiquitous – кездескіш, барлық жерде болғыш) деген атқа ие болды. |
|
|||||
Протеолетикалық |
ферменттерінің |
нысанасы |
болып табылатын көптег |
|||
ақуыздары, |
қоршаған |
ортаның |
қолайсыз(стрестік) |
жағдайларының |
əсерінен |
|
ыдырауға ұшырайды. Сонымен бірге əубастан қате фолдингі жүрген ақуыздар да ыдыратылады. Кейбір ақуыздар аз өмір сүру уақытына ие болады.
Келесі 14-ші суретте ақуыз ыдырауының барысы көрсетіледі.
45
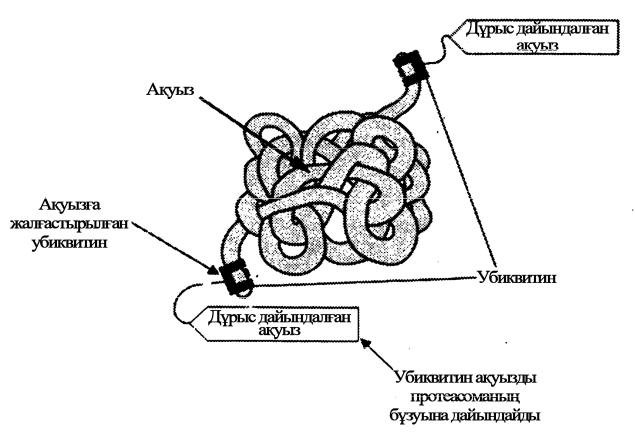
14-сурет. Ақуыздың ыдырауы
Төменде жасушаның ақуыз түзілуіндегі, ақуыздың дұрыс фолдингі жəне олардың ыдырау үдерістерінде өтетін іс-қимылдарының барысы беріледі:
1.Ақуыздың түзілуі қоршаған орта жағдайлары мұны қажет еткен жағдайда ғана жүреді.
2.Көптеген гендер бірнеше ақуыздарды коделейді. ДНҚ матрицасында синтезделетін мРНҚ өте көптеген кодондарға ие болуы мүмкін, сондықтан дұрыс құрылымды ақуызы түзілуі үшін ол «редакциялануы» қажет.
3.мРНҚ жасушалық ферменттер арқылы «редакцияланады».
4.Пайда болған ақуыздар, қоршаған ортаның жағдайы ақуыздың дұрыс фолдингін қамтамасыз ете алғанға дейін, арнаулы шаперондармен тұтылып тұрылады.
5.Фолдинг-шаперондары ақуыздардың дұрыс фолдингі үшін қажет.
6.Егерде ақуыз фолдингі дұрыс жүрмеген , болсадезагрегациялаушы шаперондары оларды жазып (ашып), қайтадан дұрыс конформация алуына мүмкіндік жасайды.
7.Көптеген ақуыздар мембранаға тіркесу үшін, рефолдингке ұшырауы қажет болады.
8. Секреторлық шаперондары жасушадан шығарылуы алдында, ақуыз құрамына кіретін арнайы амин қышқылдық ретімен байланысуы қажет.
9.Қартайған немесе қате фолдингі жүрген ақуыздары, убиквитиндермен тіркеседі жəне протеасоманың қатысуымен ыдыратылады.
46
1. Ақуыз типі мен оның қызметі
Протоем – жасушадағы барлық ақуыздар бірлігі. Бұрынғы көптеген ғылыми жұмыстарында əрбір жасуша протоемын жекелей сипаттап беруге талпыныстар
жасалған |
болатын. Протоем |
сараптауы |
қазіргі |
компютерлік технологияларды |
||
пайдалану |
мүмкіндігінің өзінде де өте |
күрделі |
жұмыс |
болып табылады ж |
||
əрдайым сирек ақуыз түрлерін анықтауға мүмкіндік бере бермейді. Протеомиканың |
||||||
мақсаты – ДНҚ-чипіне |
ұқсас микросараптауларын жасау. ДНҚ-чипінде матрикске |
|||||
бекітілген |
(байланған) |
белгілі |
жасушаның |
гені |
болатыны |
белгілі. Матрикске |
байланған гендер екі үзікті(цепь) ДНҚ молекуласының тек бір үзігі ғана чиптің
құрамына кіретіндей болып денатурацияға ұшырайды. Мұнда, ДНҚ-ның бір үзігі |
||||||
екінші |
үзігін |
комплементарлық |
принципі |
бойынша |
байлап. |
|
Комплементарлық үзікке белгіні«тігу» арқылы чиптегі генді байқауға болады. |
||||||
Алайда, ақуызда ДНҚ молекуласындағы комплементарлық үзігіне ұқсас нəрсе жоқ. |
||||||
Чиптегі əртүрлі ақуыздарды түстеп-тану(идентификация) |
үшін, олардағы |
əрбір |
||||
жеке ақуызға арналған моноклональді антиденелері қажет болады. |
|
|||||
Протеомадағы |
көптеген |
санды |
ақуыздардың |
қызметтерін |
анықта– |
|
биоинженерлердің жақын болашақта зерттеуі қажет болатын үлкен жұмыстары
қатарына |
жатады. |
Бұрыннан мұндай сараптаулар, қалыпты |
жəне мутантты |
|||
жасушаларының |
жəне |
индивидуумдардың |
протоемдарын |
салыстыру |
не |
|
жекелеген |
ақуыздарға биохимялық сараптаулар |
жүргізіп, олардың |
құрылымын – |
|
||
қызметі белгілі болған ақуыздың құрылымымен салыстыру жолымен жасалынып келінді. ДНҚ молекуласындағы нуклеотидтер реттілігін анықтаудың да маңызы жоғары, өйткені қызметтері ұқсас келетін коделенетін ақуыздар, туыстық картасы бойынша бір-біріне жақын орналасады. Кейбір жағдайларда, қарапайым ағзаларда бір-біріне жақын орналасқан гендер, эволюциялық тұрғыдан жоғары дамыған
түрлерде – алыс орналасады. |
|
|
|
Антисенс-технологиясын |
қолданып (антимағыналы |
реттілігін |
қолдану) |
гендерді ажырату мүмкіндігі белгілі-бір ген коделейтін ақуыздың қандай қызмет атқаратындығын анықтауға мүмкіндік береді. Антисенс-технологиясын қолдану нəтижесінде, осы жүйеге РНҚ молекуласын, комплементарлы мРНҚ молекулаларын ендіру арқылы, мРНҚ-ның дезактивизациясы жүреді. Мұнда ақуыз синтезінің алдын алып, РНҚ-ның комплементарлық молекуласы, мРНҚ-ның бір үзікті молекуласымен байланысқа түседі. Осындай сараптаулар жүргізу үшін көптеген мəліметтер қоры
(базасы) жасақталған. Осындай |
қорлар арасынан Шиковски бастаған бір то |
ғалымдардың (2000 ж) жасаған |
ашытқылардағы ақуыз-ақуыз жүйесін айтуға |
болады. Осындай жүйелерді пайдалану арқылы жасалған сараптаулар нəтижесінде, |
|
əлі де толық сипатталмаған |
ақуыздардың қызметтерін анықтауға мүмкіндікте |
туылады. |
|
5. Биоинженерлік жүйелердегі ақуыздың қате фолдингі мүмкіндігін төмендету
Ақуыз |
өндіру |
бағытындағы |
биоинженерлік |
жұмыстарында |
ең |
мəселелерінің |
бірі ретінде геном |
бактерияларына енгізілетін гендерінің |
дұр |
||
47
жұмыс істеуін қамтамасыз ету, яғни ақуыздың дұрыс фолдингін қамтамасыз ететін трансляция мен транскрипция үдерістерінің қалыпты жүретіндіктеріне көз жеткізуді айтуға болады. Сондықтан, ақуыз фолдингі жүретін бағыттың дұрыс қалыптасуын қамтамасыз ету қажет. Қазіргі кезде ғылымға ақуыздың қате фолдингісінің алдын алудың жолдары белгілі болды.
Микроорганизмдерді қажетті өнім шығаруға бейімдеудегі басты кедерг, оларды табиғатына жат құбылыс– эукариотты ақуыздарды синтездеуге бағыттау болып табылады. Қажетті ақуыздың синтезін жүргізу үшін, көбінесе вектор ретінде қолданылатын плазмида немесе вирустардың көмегімен белгілі бір ДНҚ реттілігін бактерияға енгізгеннен кейін, ақуыз синтезіне жауапты гендерінің транскрипциясы, бактериялды жасушасының өзіндік механизмі арқылы жүзеге асырылатын есімізде ұстайық. Мұндағы синтезі жүретін ақуыз– жасушалық ортаға жат болып табылады. Сондықтан ақуыздың қате фолдингі мəселесінің болуы күтілмеге жағдай емес. Осы мəселені шешу мақсатында қолдануға болатын бірнеше əдістер бар. Мұның біріншісі ретінде– ақуыз синтезінің қарқындылығын төмендетуге бағытталған жұмысты айтуға болады. Ақуыздың аса көп өндірілуі– жасуша үшін негізгі стресс-фактор болып табылады жəне мұның нəтижесінде қате фолдингінің жүру мүмкіндігі де артады. Сонымен бірге, мысалы, қоректік ортаның температурасын төмендету арқылы, өсіру жағдайын да өзгертуіңізге болады.
Басқа бір жолы ретінде – фолдинг регуляциясын коделейтін гендерді ендіруді айтуға болады. Мұнда жасушадағы фолдинг регуляциясына жауапты гендері, ақуыз түзілуіне жауапты құрылымдық гендерімен бірге экспрессиялануы қажет. Егер де, жасушада фолдинг регуляторларының гендері көп ,болсаақуыз фолдингінің тиімділігі мен дəлдігі де артады.
Сонымен бірге, молекула секрециясының тиімділігін – секрецияға қатысатын шаперондардың пайда болуына жауап беретін гендерді ендіру арқылы да арттыруға болады. Мұндағы тағы бір айта кететін жайт– бұл шаперондар жасушадан ақуызды шығаруды қамтамасыз етеді. Осындай жолмен шығарылған ақуыздарды қажетті мақсатта пайдалану үшін жинақтап алуға болады. Мұндай ақуыздарда арнайы амин қышқылдық орналасу реті болатынын еске түсірейік. Осы реттілікпен секреторлық шаперондары байланысады. Секреторлық шаперондары ақуыздардың жасушалық мембраналарынан өтуін қамтамасыз етеді. Сөйтіп, ақуыздардағы сигналдық реттілігінің болуы, олардың жасушадан секрециялануына жəрдемдеседі.
Ақуыздардың қате фолдингісінің жүру мүмкіндігі қоршаған ортаның кейбір факторларының əсеріне, мысалы ыстықтық қолайсыздығына (стресіне) байланысты артады. Ақуыз синтезінің қарқынды түрде жүру нəтижесі, олардың қате фолдингі мүмкіндігіне де алып келеді.
48
ІІІ тарау бойынша өзін-өзі бақылауға арналған сұрақтар мен тапсырмалар.
1. |
Протеомика нені зерттейді? Бұл бағыттың адамдар үшін маңызы қаншалықты? |
|||||
2. |
Ақуыздарға |
тиесілі |
атқарылатын |
жұмыстарының |
дұрыс |
жүруі |
|
байланысты қалыптасады? |
|
|
|
||
3. |
Егерде амин |
қышқыл түрлері бірдей, бірақ олардың орналасу |
тəртібі |
|||
|
өзгешелеу болса, атқаратын қызметтері бірдей бола ма? |
|
|
|||
4. |
Ақуыздардың құрылымының неше түрін білесіз? Сипаттамаларын айтыңыз. |
|
||||
5. |
Жасушаларды |
өзіне |
тиесілі емес ақуыздарды синтездеуге бағыттау , үші |
|||
қандай ерекшеліктерді басты назарда ұстау қажет екендігін еске түсіріңіз.
6.Ақуыз фолдингі дегеніміз не?
7.Ақуыз фолдингіндегі шаперондардың ролі қандай?
8.Шаперондардың ерекше қасиеттерін биоинженерлік жұмыстарында пайдалану мүмкіндіктері қандай деп ойлайсыз?
9.Ақуыздың ыдырауы ненің көмегімен жүзеге асырылады?
10.Убиквитиндер дегеніміз не жəне олар қандай қызмет атқарады?
11.Жасушаның ақуыз түзілуіндегі, ақуыздың дұрыс фолдингі жəне олардың ыдырау үдерістерінде өтетін іс-қимылдарының барысын айтып беріңіз.
12.Протеомиканың негізгі мақсаты қандай?
13.Антисенс-технологиясы дегеніміз не жəне ол не үшін қолданылады?
14.Протеомиканың болашақта қолданылу мүмкіндігі мен аясы қандай д ойлайсыз?
15.Ақуыздың қате фолдингі мүмкіндігін төмендету мақсатында не істелінеді?
16.Қоршаған ортаның факторлары ақуыз синтезіне əсер ете ме?
49
