
- •3. Биологическая роль элементов в зависимости от положения в пс д.И. Менделеева.
- •4. Понятие о биогенных элементах. Макро- и микроэлементы в организме человека. Топография важнейших биогенных элементов в организме человека.
- •5. Общая характеристика s-элементов. Характеристика элементов I a группы. Биогенная роль данных элементов, применение их соединений в медицине. Радионуклид Cs-137.
- •6. Общая характеристика s-элементов II a группы. Их биогенная роль и применение соединений в медицине. Радионуклид Sr-90.
- •7. Общая характеристика p-элементов и их соединений. Характеристика элементов III a группы. Биогенная роль данных элементов, применение их соединений в медицине.
- •19. Характеристика энергетического состояния электрона в атоме системой квантовых чисел. Принцип Паули. Правило Хунда. Принцип минимума энергии.
- •21. Периодичность изменения радиусов атомов и ионов, энергии ионизации, сродства к электрону и электроотрицательности атомов.
- •22. Химическая связь. Природа и типы химической связи. Зависимость потенциальной энергии системы из двух атомов водорода от расстояния между их ядрами. Энергия и длина связи.
- •26. Ионная связь.
- •27. Водородная связь. Межмолекулярная и внутримолекулярная водородная связь. Роль водородной связи в процессе ассоциации молекул.
- •1) Вода
- •28. Комплексные соединения. Координационная теория Вернера. Центральный атом, лиганды. Координационное число центрального атома.
- •31. Комплексообразующая способность s-, p-, d- элементов. Реакции комплексообразования. Реакции разрушения комплексных соединений.
- •39. Метод нейтрализации (кислотно-основное титрование). Ацидиметрия и алкалиметрия. Стандартные растворы. Кислотно-основные индикаторы.
- •48. Энтропия: термодинамическое и статистическое толкование. Уравнение Больцмана. Расчет энтропийного фактора химической реакции по стандартным энтропиям вещества.
- •51. Смещение химического равновесия обратимых реакций при изменении температуры, концентрации и давления. Принцип Ле Шателье.
- •52. Предмет химической кинетики. Химическая кинетика как основа для изучения скорости и механизма биохимических процессов.
- •53. Скорость химической реакции для гомогенных и гетерогенных превращений. Механизм химических реакций; молекулярность реакций.
- •54. Закон действующих масс для скорости химической реакции. Константа скорости. Порядок реакции.
- •57. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Температурный коэффициент реакции. Энергия активации. Уравнение Аррениуса.
- •58. Теория активного комплекса. Объяснение действия катализатора с позиций данной теории. Катализ и катализаторы. Автокаталитические реакции.
- •59. Кинетика ферментативных реакций. Уравнение Михаэлиса-Ментен. Молекулярная активность (число оборотов) фермента. Факторы, влияющие на активность ферментов.
- •60. Понятие о растворах. Классификация растворов. Роль растворов в жизнедеятельности организмов.
- •61. Способы выражения состава раствора: массовая доля, молярная концентрация, молярная концентрация эквивалента, молярная доля, объемная доля, титр.
- •62. Термодинамика растворения. Теплота растворения.
- •63. Насыщенный раствор. Растворимость. Факторы, влияющие на нее.
- •64. Растворимость газов в жидкостях. Уравнение Генри и Сеченова. Причина возникновения кессонной болезни. Растворимость газов в крови.
- •66. Растворимость жидкости в жидкости. Неограниченно смешивающиеся, несмешивающиеся и частично смешивающиеся жидкости. Закон распределения Нернста-Шилова. Экстракция из растворов.
- •67. Коллигативные свойства растворов. Давление насыщенного пара над раствором. Закон Рауля.
- •68. Криоскопический и эбулиоскопический законы. Криоскопия и эбулиоскопия как методы экспериментального определения молярной массы растворенного вещества.
- •69. Осмос и осмотическое давление. Уравнение Вант-Гоффа. Полупроницаемые мембраны в организме.
- •72. Основные положения теории слабых электролитов Аррениуса. Константа диссоциации, степень диссоциации. Закон разведения Оствальда.
- •74. Роль электролитов в жизнедеятельности человека. Ионный состав внутри- и внеклеточных жидкостей. Ионная сила плазмы крови.
- •77. Буферные системы, классификация, механизм их действия. Расчет рН буферных систем. Уравнение Гендерсона-Гассельбаха. Буферная емкость.
- •81. Метод электронного баланса и метод полуреакций при расстановке коэффициентов в уравнениях ов реакций. Важнейшие окислители и восстановители.
- •82. Устройство и принцип действия гальванических элементов. Ов, диффузные и мембранные потенциалы. Уравнение Нернста. Классификация электродов.
- •83. Потенциометрия. Потенциометрическое определение рН растворов. Хлорсеребряный электрод. Стеклянный электрод с водородной функцией.
- •86. Поверхностные явления и их значение в медицине и биологии. Поверхностная энергия и поверхностное натяжение. Определение поверхностного натяжения сталагмометрическим методом.
- •88. Твердые адсорбенты. Активная поверхность как важнейшая характеристика твердых адсорбентов. Классификация твердых адсорбентов. Биологическая роль пищевого волокна.
- •89. Адсорбция на твердых адсорбентах. Теория мономолекулярной адсорбции Ленгмюра. Уравнение Ленгмюра. Теория полимолекулярной адсорбции Поляни и бэт. Эмпирическое уравнение Фрейндлиха.
- •90. Адсорбция из растворов электролитов: избирательная, ионообменная. Правила Панета-Фаянса. Иониты, их применение в медицине и биологии.
- •91. Адсорбционная терапия. Гемо-, лимфо- и плазмосорбция. Энтеросорбция и энтеросорбенты.
- •92. Дисперсные системы. Их классификация. Методы получения и очистки коллоидных растворов.
- •93. Молекулярно-кинетические и оптические свойства дисперсных систем.
- •94. Электрокинетические явления. Электрофорез, электроосмос. Применение электрофореза в биологических и медицинских исследованиях.
- •95. Строение коллоидной мицеллы лиофобных золей. Двойной электрический слой. Электрокинетический потенциал коллоидной частицы и устойчивость коллоидного раствора.
- •98. Микрогетерогенные системы: эмульсии, аэрозоли, пены.
- •99. Высокомолекулярные соединения и их растворы. Природные и синтетические вмс. Методы получения вмс и их классификация.
- •101. Полиэлектролиты. Изоэлектрическое состояние и изоэлектрическая точка белка. Методы определения иэт.
1) Вода
Во льду молекула Н2О образует четыре водородные связи, что формирует его трехмерную ажурную структуру.
 При
плавлении льда часть водородных связей
разрывается (при 20оС
их сохраняется 46%) и молекулы воды
заполняют пустоты в структуре льда. С
этим связана аномалия плотности воды.
При
плавлении льда часть водородных связей
разрывается (при 20оС
их сохраняется 46%) и молекулы воды
заполняют пустоты в структуре льда. С
этим связана аномалия плотности воды.
Плотность льда меньше плотности жидкой воды(0,92 и 1,0 г/мл).

Жидкая вода содержит как ассоциаты (кластеры), так и молекулы, не связанные водородными связями. Кластеры называют мерцающими, т.к. среднее время их жизни составляет 10-10 с. 2) Фтороводородная кислота
.....Н F ..... Н F ..... Н F ..... 3) Спирты (R OH) ..... Н О .....Н О ..... Н О .....
R R R
Значение внутримолекулярных водородных связей заключается в том, что они участвуют в формировании пространственных структур биополимеров (белков, нуклеиновых кислот, полисахаридов).
28. Комплексные соединения. Координационная теория Вернера. Центральный атом, лиганды. Координационное число центрального атома.
Комплексными (координационными) соединениями называют вещества, в структурных единицах которых число связей, образованных центральным атомом, превышает его высшую валентность.



![]() Комплексные
соединения состоят из:
комплексообразователей
(Ме, реже неметаллы: Si,
P
и др.);
лигандов
(ионов или полярных молекул);
ионов
внешней сферы (могут отсутствовать).
Комплексные
соединения состоят из:
комплексообразователей
(Ме, реже неметаллы: Si,
P
и др.);
лигандов
(ионов или полярных молекул);
ионов
внешней сферы (могут отсутствовать).
 В
природе комплексных соединений больше,
чем простых. Их изучение началось ~ 200
лет назад. Первой теорией КС была теория
А. Вернера (1893).
Швейцарский
химик, выдвинувший и развивший
координационную теорию строения
комплексных соединений. Важнейшей
характеристикой комплексо-образователя
является его координационное
число (к.ч.),
т.е. число связей, образованных им с
лигандами.
В
природе комплексных соединений больше,
чем простых. Их изучение началось ~ 200
лет назад. Первой теорией КС была теория
А. Вернера (1893).
Швейцарский
химик, выдвинувший и развивший
координационную теорию строения
комплексных соединений. Важнейшей
характеристикой комплексо-образователя
является его координационное
число (к.ч.),
т.е. число связей, образованных им с
лигандами.
 Важнейшей
характеристикой лиганда является его
дентантность
– число связей, образованных с
комплексообразователем.
Классификация
лигандов:
монодентантные
лиганды: а) анионы: OH‾,
H‾,
F‾,
Cl‾,
Br‾,
I‾,
CN‾,
CNS‾,
NO2‾,
NO3‾;
б)
молекулы:
NH3,
H2O,
CO;
в)
катионы: NH2NH3+.
бидентантные
лиганды:
а)анионы:
SO42‾,
C2O42‾,
CO32‾;
б)молекулы:
NH2
– CH2
– CH2
– NH2
(этилендиамин)
NH2
– CH2
– COOH(глицин).
полидентантные
лиганды. Важнейшими из них являются
комплексоны – аминополикарбоновые
кислоты и их соли.
Важнейшей
характеристикой лиганда является его
дентантность
– число связей, образованных с
комплексообразователем.
Классификация
лигандов:
монодентантные
лиганды: а) анионы: OH‾,
H‾,
F‾,
Cl‾,
Br‾,
I‾,
CN‾,
CNS‾,
NO2‾,
NO3‾;
б)
молекулы:
NH3,
H2O,
CO;
в)
катионы: NH2NH3+.
бидентантные
лиганды:
а)анионы:
SO42‾,
C2O42‾,
CO32‾;
б)молекулы:
NH2
– CH2
– CH2
– NH2
(этилендиамин)
NH2
– CH2
– COOH(глицин).
полидентантные
лиганды. Важнейшими из них являются
комплексоны – аминополикарбоновые
кислоты и их соли.
![]()


 Метод
комплексонометрии позволяет определять
содержание катионов металлов Ca2+,
Mg2+,
Fe2+,
Fe3+
и др. в растворах и биологических
жидкостях
Метод
комплексонометрии позволяет определять
содержание катионов металлов Ca2+,
Mg2+,
Fe2+,
Fe3+
и др. в растворах и биологических
жидкостях
29. Строение комплексных соединений с точки зрения метода валентных связей. Типы гибридизации АО центрального атома. Конфигурация комплексных ионов. Теория кристаллического поля. Магнитные свойства комплексных ионов. Спектрохимический ряд лигандов.
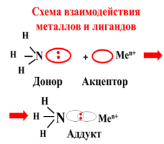
Строение КС описывается либо в рамках метода ВС, либо с позиций теории кристаллического поля. С позиций метода ВС связи металл-лиганд являются ковалентными полярными, образованными по донорно-акцепторному механизму. Лиганды выступают в роли доноров электронных пар, а комплексообразователи – в роли их акцепторов.
 Конфигурация
комплексного иона определяется типом
гибридизации АО комплексообразователя.
Конфигурация
комплексного иона определяется типом
гибридизации АО комплексообразователя.
 Теория
кристаллического поля исходит из того,
что металлы и лиганды связаны между
собой силами электростатического
притяжения. Эта теория рассматривает
воздействие лигандов на d-орбитали
иона-комплексообразователя. Если катион
металла находится в симметричном
магнитном поле, его d-орбитали
имеют одинаковый запас энергии (являются
вырожденными).
Если
ион находится в октаэдрическом,
тетраэдрическом или другом несимметричном
поле лигандов, то происходит расщепление
его d-подуровня.
Теория
кристаллического поля исходит из того,
что металлы и лиганды связаны между
собой силами электростатического
притяжения. Эта теория рассматривает
воздействие лигандов на d-орбитали
иона-комплексообразователя. Если катион
металла находится в симметричном
магнитном поле, его d-орбитали
имеют одинаковый запас энергии (являются
вырожденными).
Если
ион находится в октаэдрическом,
тетраэдрическом или другом несимметричном
поле лигандов, то происходит расщепление
его d-подуровня.


Величина энергии расщепления (∆) зависит от конфигурации комплекса и природы лиганда.
 В
поле слабых лигандов энергия расщепления
(∆) не велика, поэтому распределение
электронов на d-орбиталях
соответствует правилу Гунда.
В
поле сильных лигандов энергия расщепления
(∆) имеет большое значение, в следствие
чего первыми заполняются d-орбитали
нижнего подуровня (распределение
электронов происходит против правила
Гунда).
Рассмотрим
строение КС:
[FeF6]3‾
[Fe(CN)6]3‾
В
поле слабых лигандов энергия расщепления
(∆) не велика, поэтому распределение
электронов на d-орбиталях
соответствует правилу Гунда.
В
поле сильных лигандов энергия расщепления
(∆) имеет большое значение, в следствие
чего первыми заполняются d-орбитали
нижнего подуровня (распределение
электронов происходит против правила
Гунда).
Рассмотрим
строение КС:
[FeF6]3‾
[Fe(CN)6]3‾
х – 6 = – 3 х = + 3 Координационное число катиона Fe3+ равно 6, так как он связан с шестью монодентантными лигандами
![]() Оба
комплексных иона имеют октаэдрическую
конфигурацию, что обуславливает
одинаковый характер расщепления
d-орбиталей.
F-
является
«слабым лигандом» (∆ = 112,7 кДж/моль),
поэтому распределение электронов
катиона Fe3+
происходит
в соответствии с правилом Гунда.
CN-
является
«сильным лигандом» (∆
= 1464,8 кДж/моль),
поэтому распределение электронов
катиона Fe3+
происходит
против правила Гунда.
Ион
FeF6]3-
парамагнитен,
так как содержит неспаренные электроны
на внешнем уровне (высокоспиновый
комплекс).
Ион
Fe(СN)6]3-
диамагнитен,
(низкоспиновый комплекс).
Оба
комплексных иона имеют октаэдрическую
конфигурацию, что обуславливает
одинаковый характер расщепления
d-орбиталей.
F-
является
«слабым лигандом» (∆ = 112,7 кДж/моль),
поэтому распределение электронов
катиона Fe3+
происходит
в соответствии с правилом Гунда.
CN-
является
«сильным лигандом» (∆
= 1464,8 кДж/моль),
поэтому распределение электронов
катиона Fe3+
происходит
против правила Гунда.
Ион
FeF6]3-
парамагнитен,
так как содержит неспаренные электроны
на внешнем уровне (высокоспиновый
комплекс).
Ион
Fe(СN)6]3-
диамагнитен,
(низкоспиновый комплекс).
30. Классификация и номенклатура комплексных соединений. Хелатные и внутрикомплексные соединения. Комплексные соединения металлов с биолигандами, их роль в организме. Применение комплексных соединений в медицине.
Особую группу составляют хелатные (клешневидные) комплексы, содержащие полидентантные лиганды, образующие замкнутые циклы
![]() Наиболее
устойчивыми являются внутрикомплексные
КС, в которых часть связей Me-Lig
образованы по обменному, а часть – по
донорно-акцепторному механизму
Наиболее
устойчивыми являются внутрикомплексные
КС, в которых часть связей Me-Lig
образованы по обменному, а часть – по
донорно-акцепторному механизму
 Тетацин
применяется в медицине как лекарственный
препарат для детоксификации организма
при отравлении тяжелыми металлами:
Hg2+
+ [CaY]2‾
↔ Ca2+
+ [HgY]2‾
Тетацин
применяется в медицине как лекарственный
препарат для детоксификации организма
при отравлении тяжелыми металлами:
Hg2+
+ [CaY]2‾
↔ Ca2+
+ [HgY]2‾
 Б)
КС с би- и полидентантными лигадами
Б)
КС с би- и полидентантными лигадами
![]() НОМЕНКЛАТУРА
КС
(1960,
ИЮПАК)
1)
вначале называют катионы, затем анионы.
Названия комплексных анионов заканчиваются
суффиксом –ат;
2)
В комплексном ионе сначала называют
лиганды-анионы, затем лиганды-молекулы,
затем лиганды-катионы:
NH3
– аммин,
H2O
– аква,
СО
– карбонил
НОМЕНКЛАТУРА
КС
(1960,
ИЮПАК)
1)
вначале называют катионы, затем анионы.
Названия комплексных анионов заканчиваются
суффиксом –ат;
2)
В комплексном ионе сначала называют
лиганды-анионы, затем лиганды-молекулы,
затем лиганды-катионы:
NH3
– аммин,
H2O
– аква,
СО
– карбонил
 Названия
некоторых комплексообразо-вателей
зависит от их положения в КС
Названия
некоторых комплексообразо-вателей
зависит от их положения в КС

Степень окисления комплексообразователя указывают, если у металла их несколько. Na[Al(OH)4] натрий тетрагидроксоалюминат, [Cu(NH3)4]SO4 тетраамминмедь(II) сульфат, NH4[Co(NH3)2(NO2)4] аммоний тетранитродиамминкобальтат(III), [Pt(NH3)2Cl2 дихлородиамминплатина. В организме человека все металлы, кроме щелочных и, частично, щелочноземельных находятся в виде прочных хелатных КС с биолигандами: белками, аминокислотами, витаминами, гормонами и другими биоактивными соединениями. Важнейшими являются комплексы с белками. К ним относятся многочисленные металлоферменты, а так же гемоглобин (комплекс железа с порфином), хлорофилл (комплекс магния).

Сбалансированные потоки металлов и лигандов в биосистемах обуславливают металло-лигандный гомеостаз. Его нарушение приводит к различным заболеваниям: При недостатке железа – анемия, при его избытке – сидероз. По данным ВОЗ дефицит железа в организме человека является одной из наиболее серьезных проблем современности. На земном шаре от дефицита железа страдает 4-5 миллиардов человек (66-80% населения Земли). Недостаток железа - один из десяти глобальных факторов риска, являющийся причиной смерти 800 000 человек в год. Недостаток кальция приводит к остеопорозу, а его избыток в организме человека способствует развитию катаракты, атеросклероза, а также обызвествлению костной ткани. Для коррекции металло-лигандного гомеостаза используются: комплексоны, связывающие токсичные металлы, и выводящие их из организма человека; комплексные соединения: А)комплексы Pt –противоопухолевые препараты, например, соль Пейроне [Pt(NH3)2Cl2] (синтезирована в 1850, используется как препарат с 1969 года); Б) комплексы Au – лечение артритов и туберкулеза: Na3[Au(S2O3)2]; B)тетацин–при отравлениях тяжелыми Ме. Строение, свойства и биологическая роль КС металлов с биолигандами является объектом изучения бионеорганической химии, возникшей в середине 50-х годов, на стыке неорганической химии, биологии и медицины. Достижения бионеорганики широко внедряются в медицину.
