
- •3. Биологическая роль элементов в зависимости от положения в пс д.И. Менделеева.
- •4. Понятие о биогенных элементах. Макро- и микроэлементы в организме человека. Топография важнейших биогенных элементов в организме человека.
- •5. Общая характеристика s-элементов. Характеристика элементов I a группы. Биогенная роль данных элементов, применение их соединений в медицине. Радионуклид Cs-137.
- •6. Общая характеристика s-элементов II a группы. Их биогенная роль и применение соединений в медицине. Радионуклид Sr-90.
- •7. Общая характеристика p-элементов и их соединений. Характеристика элементов III a группы. Биогенная роль данных элементов, применение их соединений в медицине.
- •19. Характеристика энергетического состояния электрона в атоме системой квантовых чисел. Принцип Паули. Правило Хунда. Принцип минимума энергии.
- •21. Периодичность изменения радиусов атомов и ионов, энергии ионизации, сродства к электрону и электроотрицательности атомов.
- •22. Химическая связь. Природа и типы химической связи. Зависимость потенциальной энергии системы из двух атомов водорода от расстояния между их ядрами. Энергия и длина связи.
- •26. Ионная связь.
- •27. Водородная связь. Межмолекулярная и внутримолекулярная водородная связь. Роль водородной связи в процессе ассоциации молекул.
- •1) Вода
- •28. Комплексные соединения. Координационная теория Вернера. Центральный атом, лиганды. Координационное число центрального атома.
- •31. Комплексообразующая способность s-, p-, d- элементов. Реакции комплексообразования. Реакции разрушения комплексных соединений.
- •39. Метод нейтрализации (кислотно-основное титрование). Ацидиметрия и алкалиметрия. Стандартные растворы. Кислотно-основные индикаторы.
- •48. Энтропия: термодинамическое и статистическое толкование. Уравнение Больцмана. Расчет энтропийного фактора химической реакции по стандартным энтропиям вещества.
- •51. Смещение химического равновесия обратимых реакций при изменении температуры, концентрации и давления. Принцип Ле Шателье.
- •52. Предмет химической кинетики. Химическая кинетика как основа для изучения скорости и механизма биохимических процессов.
- •53. Скорость химической реакции для гомогенных и гетерогенных превращений. Механизм химических реакций; молекулярность реакций.
- •54. Закон действующих масс для скорости химической реакции. Константа скорости. Порядок реакции.
- •57. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Температурный коэффициент реакции. Энергия активации. Уравнение Аррениуса.
- •58. Теория активного комплекса. Объяснение действия катализатора с позиций данной теории. Катализ и катализаторы. Автокаталитические реакции.
- •59. Кинетика ферментативных реакций. Уравнение Михаэлиса-Ментен. Молекулярная активность (число оборотов) фермента. Факторы, влияющие на активность ферментов.
- •60. Понятие о растворах. Классификация растворов. Роль растворов в жизнедеятельности организмов.
- •61. Способы выражения состава раствора: массовая доля, молярная концентрация, молярная концентрация эквивалента, молярная доля, объемная доля, титр.
- •62. Термодинамика растворения. Теплота растворения.
- •63. Насыщенный раствор. Растворимость. Факторы, влияющие на нее.
- •64. Растворимость газов в жидкостях. Уравнение Генри и Сеченова. Причина возникновения кессонной болезни. Растворимость газов в крови.
- •66. Растворимость жидкости в жидкости. Неограниченно смешивающиеся, несмешивающиеся и частично смешивающиеся жидкости. Закон распределения Нернста-Шилова. Экстракция из растворов.
- •67. Коллигативные свойства растворов. Давление насыщенного пара над раствором. Закон Рауля.
- •68. Криоскопический и эбулиоскопический законы. Криоскопия и эбулиоскопия как методы экспериментального определения молярной массы растворенного вещества.
- •69. Осмос и осмотическое давление. Уравнение Вант-Гоффа. Полупроницаемые мембраны в организме.
- •72. Основные положения теории слабых электролитов Аррениуса. Константа диссоциации, степень диссоциации. Закон разведения Оствальда.
- •74. Роль электролитов в жизнедеятельности человека. Ионный состав внутри- и внеклеточных жидкостей. Ионная сила плазмы крови.
- •77. Буферные системы, классификация, механизм их действия. Расчет рН буферных систем. Уравнение Гендерсона-Гассельбаха. Буферная емкость.
- •81. Метод электронного баланса и метод полуреакций при расстановке коэффициентов в уравнениях ов реакций. Важнейшие окислители и восстановители.
- •82. Устройство и принцип действия гальванических элементов. Ов, диффузные и мембранные потенциалы. Уравнение Нернста. Классификация электродов.
- •83. Потенциометрия. Потенциометрическое определение рН растворов. Хлорсеребряный электрод. Стеклянный электрод с водородной функцией.
- •86. Поверхностные явления и их значение в медицине и биологии. Поверхностная энергия и поверхностное натяжение. Определение поверхностного натяжения сталагмометрическим методом.
- •88. Твердые адсорбенты. Активная поверхность как важнейшая характеристика твердых адсорбентов. Классификация твердых адсорбентов. Биологическая роль пищевого волокна.
- •89. Адсорбция на твердых адсорбентах. Теория мономолекулярной адсорбции Ленгмюра. Уравнение Ленгмюра. Теория полимолекулярной адсорбции Поляни и бэт. Эмпирическое уравнение Фрейндлиха.
- •90. Адсорбция из растворов электролитов: избирательная, ионообменная. Правила Панета-Фаянса. Иониты, их применение в медицине и биологии.
- •91. Адсорбционная терапия. Гемо-, лимфо- и плазмосорбция. Энтеросорбция и энтеросорбенты.
- •92. Дисперсные системы. Их классификация. Методы получения и очистки коллоидных растворов.
- •93. Молекулярно-кинетические и оптические свойства дисперсных систем.
- •94. Электрокинетические явления. Электрофорез, электроосмос. Применение электрофореза в биологических и медицинских исследованиях.
- •95. Строение коллоидной мицеллы лиофобных золей. Двойной электрический слой. Электрокинетический потенциал коллоидной частицы и устойчивость коллоидного раствора.
- •98. Микрогетерогенные системы: эмульсии, аэрозоли, пены.
- •99. Высокомолекулярные соединения и их растворы. Природные и синтетические вмс. Методы получения вмс и их классификация.
- •101. Полиэлектролиты. Изоэлектрическое состояние и изоэлектрическая точка белка. Методы определения иэт.
57. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Температурный коэффициент реакции. Энергия активации. Уравнение Аррениуса.


 Для
большинства химических реакций
выполняется правило Вант-Гоффа: при
повышении температуры на каждые 10°
скорость реакции возрастает в 2-4 раза.
Для
большинства химических реакций
выполняется правило Вант-Гоффа: при
повышении температуры на каждые 10°
скорость реакции возрастает в 2-4 раза.
 Для
биохимических реакций 1,5 <
< 3, поэтому при повышении температуры
больного до 39,5°С скорость биохимических
реакций возрастает в 1,13 - 1,39 раза (на
13-19%).
Для
биохимических реакций 1,5 <
< 3, поэтому при повышении температуры
больного до 39,5°С скорость биохимических
реакций возрастает в 1,13 - 1,39 раза (на
13-19%).
 где
0
и k0
- коэффициенты пропорциональности,
называемые предэкспоненциальными
множителями,
где
0
и k0
- коэффициенты пропорциональности,
называемые предэкспоненциальными
множителями,
Еак - энергия активации, кДж/моль. С точки зрения теории активного комплекса, энергия активации - это энергия образования активного комплекса из реагирующих веществ. Энергия активации иначе называется энергетическим барьером химической реакции.
58. Теория активного комплекса. Объяснение действия катализатора с позиций данной теории. Катализ и катализаторы. Автокаталитические реакции.
Активный комплекс - промежуточная частица, в которой старые связи еще не полностью разорвались, а новые - не полностью образовались.
![]()
![]()

 Энергия
активации (Еак)
зависит от природы реагирующих веществ
и не зависит от температуры.
Энергия
активации (Еак)
зависит от природы реагирующих веществ
и не зависит от температуры.
С повышением температуры возрастает доля активных молекул в реакционной смеси, способных преодолеть энергетический барьер химической реакции, что приводит к увеличению ее скорости. Кроме термических, существуют нетермические способы активации молекул: фотохимические, электрические и радиационные. Катализ – это явление изменения скорости реакции под влиянием веществ, называемых катализаторами. Катализаторы – это вещества, изменяющие скорость химической реакции, но не изменяющиеся в ходе процесса ни качественно, ни количественно. Они не входят в состав продуктов реакции. Небольшие количества катализаторов способны существенно изменить скорость взаимодействия большого количества реагирующих веществ.

![]()
![]()
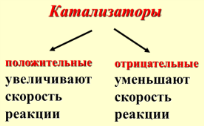
Ингибиторы – вещества, уменьшающие скорость реакции, но расходующиеся при этом сами. С точки зрения теории активного комплекса механизм действия катализаторов в том, что они изменяют высоту энергетического барьера химической реакции. Без катализатора: А + В ↔ А...В → АВ. В присутствии катализатора: А + В + К↔ А...К...В → → АВ + К
 Под
воздействием положительного катализатора
в реакционной смеси возрастает доля
активных молекул при данной температуре.
Скорость реакции увеличивается.
Под
воздействием положительного катализатора
в реакционной смеси возрастает доля
активных молекул при данной температуре.
Скорость реакции увеличивается.
 Под
воздействием отрицательного катализатора
в реакционной смеси снижается доля
активных молекул при данной температуре.
Скорость реакции уменьшается.
Под
воздействием отрицательного катализатора
в реакционной смеси снижается доля
активных молекул при данной температуре.
Скорость реакции уменьшается.
Частным случаем катализа является автокатализ: катализатором служит один из продуктов реакции.
Пример автокаталитической реакции:
2 KMnO4 + 5 H2C2O4 + 3 H2SO4 → 2 MnSO4 + 10 CO2 + K2SO4 + 8 H2O. Катализатор: Mn2+
 Разрушение
озонового слоя Земли – пример гомогенного
катализа, протекающего в атмосфере под
воздействием фреонов. Фреоны – это
фторо-хлороуглеводороды (СF2Cl2),
применяемые как хладагенты. При обычных
условиях они отличаются высокой
устойчивостью к разложению. В атмосфере
происходит разложение фреонов под
воздействием ультрафиолетового
излучения солнца:CF2Cl2
CF2Cl•
+ Cl•
Разрушение
озонового слоя Земли – пример гомогенного
катализа, протекающего в атмосфере под
воздействием фреонов. Фреоны – это
фторо-хлороуглеводороды (СF2Cl2),
применяемые как хладагенты. При обычных
условиях они отличаются высокой
устойчивостью к разложению. В атмосфере
происходит разложение фреонов под
воздействием ультрафиолетового
излучения солнца:CF2Cl2
CF2Cl•
+ Cl•
Cl• - катализатор разложения озона. Без катализатора процесс протекает по схеме:O3 + O 2 O2 Eак = 17,1 кДж/моль. В присутствии катализатора:


Вещества, усиливающие действие катализаторов, называются промоторами, а ослабляющие - каталитическими ядами.
