
Хімія / Общая химия конслек Модуль 1_
.pdf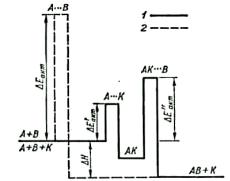
|
∆Еакт |
|
А+В → А ••• В → АВ. |
|
Як правило, для каталітичних процесів |
|
енергія активації ∆Еакт має досить високе |
|
значення. Тому речовини А і В взаємоді- |
|
ють з дуже малою швидкістю або зовсім не |
|
взаємодіють. Можливий інший спосіб |
|
утворення сполуки АВ. Нехай є речовина |
|
К, яка дуже легко вступає у взаємодію з ре- |
|
човиною А: |
Рис. 6.3. Енергетична схема взаємодії речо |
∆Е/акт |
вин А і В з каталізатором К (/) та без ка талі- |
А+К → А ••• К → АК |
затора (2) |
Легкість взаємодії А і К означає, що ене- |
|
ргія її активації ∆Е/акт мала, а швидкість ве- |
лика. В свою чергу, сполука АК легко взаємодіє з речовиною В, утворюючи АВ і К:
∆Е//акт
АК + В → АК ••• В → АВ + К.
Отже, внаслідок реакції речовина (каталізатор) залишилась без зміни і утворилась сполука АВ. Енергетична схема двох способів взаємодії А і В (рис.6.3) показує, що при наявності каталізатора енергія активації реакції зменшується. Відповідно до рівняння (6.5) енергія активації входить у показник степеня з від'ємним знаком і тому навіть незначна її зміна приводить до значного збільшення швидкості реакції.
За своїм агрегатним станом каталізатори можуть бути твердими (Pt, Fe, Co, Ni, V2O5), рідкими і газоподібними (NО2). У зв'язку з цим каталітичні процеси поділяють на гомогенні і гетерогенні.
При гомогенному каталізі всі реагуючі речовини і каталізатор утворюють одну фазу (газоподібну або рідку). Прикладом гомогенного каталізу є окислення CO в газоподібній фазі при наявності пари води як каталізатора. Основою добування сірчаної кислоти баштовим методом також є гомогенна каталітична реакція
H2SO3 + NO2 = H2SO4 + NO,
яка може відбуватися як у рідкій, так і в газоподібній фазах.
При гетерогенному каталізі каталізатор утворює самостійну, як правило, тверду фазу, на поверхні якої відбуваються каталітичні процеси. Прикладом гетерогенного каталітичного процесу може бути окислення SO2 до SO3 на поверхні V2O5.
Важливою особливістю каталітичних процесів є специфічність дії каталізатора. Крім каталізаторів, здатних прискорювати лише одну реакцію, є каталізатори, які прискорюють цілу групу аналогічних реакцій. Наприклад, платина, нікель ї паладій досить добре каталізують реакції приєднання водню. Залежно від природи каталізатора, можна спрямувати взаємодію тих самих речовин у різному напрямі. Так, при наявності АІ2О3 метиловий спирт розкладається на Н2О і С2Н2, а при наявності залі- зо-мідного каталізатора СН3ОН утворює альдегід і водень.
Каталітичні процеси мають велике практичне значення. Значна частина продуктів сучасної хімічної промисловості виробляється на основі каталітичних реакцій. До каталітичних
81
процесів належать синтез аміаку (каталізатор залізо) і метанолу, окислення SO2 до SO3(каталізатор V2O5), окислення МН3 до NO (каталізатор платина), добування поліетилену та інших полімерних матеріалів. Велику роль відіграють каталізатори в фізіологічних процесах, що відбуваються в рослинних і тваринних клітинах. Як каталізатори в живих клітинах виступають різного типу ферменти.
6.6. Хімічна рівновага
При вивченні основних закономірностей рівноважних процесів насамперед розглядають поняття про оборотні і необоротні реакції і оборотність хімічних процесів.
Необоротними хімічними реакціями називаються реакції, які відбуваються лише в одному напрямі. З погляду термодинаміки, відповідно до рівняння для ізобарного потенціалу ∆G=∆H-T∆S необоротні процеси відбуваються із зменшенням ентальпії (—∆H) і збільшенням ентропії (+∆S). Це означає, що ізобарний потенціал ∆G за будь-яких умов (концентрація реагуючих речовин і температура) завжди матиме від'ємне значення і реакція відбуватиметься тільки в одному напрямі.
До необоротних реакцій належать, наприклад, розкладання перманганату калію при нагріванні:
2КМп04 = К2МпО4 + МпО2 + 02, розкладання бертолетової солі за рівнянням
2КС103=2КС1+302,
або взаємодія лужних металів з водою за рівнянням 2К + Н2О = 2КОН + Н2
та багато інших процесів.
Оборотними називаються реакції, які можуть відбуватися в прямому і в зворотному напрямах. Оборотні реакції відбуваються, як правило, із зменшенням ентальпії (—∆H )і ентропії (—∆S) системи. З рівняння ∆G=∆H-T∆S видно, що залежно від температури величина ізобарного потенціалу ∆G може мати або від'ємне (переважає ентальпійний фактор), або при високих температурах додатне значення (переважає ентропійний фактор). Для таких процесів за певних умов можлива пряма реакція або зворо-
тна.
Розглянемо докладніше оборотні реакції, які одночасно за певних умов відбуваються в обох напрямах. До таких реакцій, як уже зазначалось, належить взаємодія Н2 і І2 при 300—400° С:
Н2 + І2 2НІ У перший момент швидкість прямої реакції
v1 k1CH2 CI2
визначається початковими концентраціями вихід-
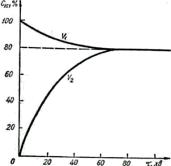
Рис. 6.4. Зміна швидкості прямої V1 та них речовин. Швидкість зворотної реакції при зворотної V2 реакцій. цьому дорівнює нулю. В міру взаємодії Н2 і I2 і
утворення НІ швидкість прямої реакції зменшу-
82
ватиметься, а швидкість зворотної реакції
v2 k2CHI2
зростатиме. Через деякий час швидкості прямої і зворотної реакцій зрівняються (рис.6.4). При цьому кількість утворених молекул НІ дорівнюватиме кількості молекул НІ, яка розклалася. Тобто концентрації всіх речовин у момент, коли швидкості прямої і зворотної реакцій однакові, не змінюються. Такий стан реакційної системи називається хімічною рівновагою. При хімічній рівновазі склад системи не змінюється, оскільки в системі відбувається хімічна взаємодія в обох напрямах з однаковою швидкістю. Тому хімічна рівновага має також назву динамічної рівноваги.
У момент хімічної рівноваги, коли швидкості прямої і зворотної реакцій однакові, можна записати:
v |
v |
|
|
|
|
|
|
k2CHI2 , звідки |
k |
C2 |
|
|
||||||
2 |
або k1CH |
|
CI |
|
1 |
|
|
HI |
|
|
||||||||
2 |
2 |
|
|
|
|
|
||||||||||||
1 |
|
|
|
|
|
|
|
|
k2 |
CH |
|
C |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
При даній температурі константи швидкості k1 |
і k2 є величини сталі, тому їх від- |
|||||||||||||||||
ношення К. = k1/k2 |
теж величина стала. Тоді |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
K |
CHI2 |
|
|
[HI]2 |
|
, |
|
|
|
|
|
(6.7) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
CH |
2 |
C |
|
[H2] [I2] |
|
|
|
|
|
|
|
|||
|
|
|
|
|
I |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
де K— константа хімічної рівноваги. Квадратними дужками позначають рівноважні концентрації речовин.
У виразі для константи рівноваги (6.7) у чисельнику записують концентрації продуктів реакції, а у знаменнику - концентрації вихідних речовин, причому беруть
рівноважні концентрації. Для зворотної реакції |
|
|||||||
аА+bВ eE+dD |
|
|||||||
константа рівноваги |
|
|
|
|
|
|
|
|
CeCd |
[E]e[D]d |
|
||||||
K |
E |
|
D |
|
|
|
, |
(6.8) |
a |
C |
b |
a |
b |
||||
C |
B |
[A] |
[B] |
|
||||
|
A |
|
|
|
|
|||
У вираз константи хімічної рівноваги, як і у вираз константи швидкості, концентрації входять у степенях, які дорівнюють стехіометричним коефіцієнтам у рівнянні реакції.
Рівняння (6.8) є одним з виразів закону діючих мас.
Слід зауважити, що закон діючих мас справедливий і для гетерогенних систем, але тільки для однорідних їх частин. Наприклад, для гетерогенної системи
С(т) + СО2 (г) 2СО(г)
у відповідності до закону діючих мас для швидкості прямої реакції можемо записати:
v k1CСО2 .
Вираз константи рівноваги для даної системи буде мати вигляд:
83

K CСО2
CСО2
Константа хімічної рівноваги показує, що в момент рівноваги відношення добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій реагуючих речовин є величиною сталою при Т == const. Тобто незалежно від початкових концентрацій рівновага в системі встановлюється завжди при тому самому відношенні концентрацій продуктів реакції і реагуючих речовин. Це співідношення не залежить від того, які речовини беруться як вихідні, наприклад Н2 + I2 або НІ.
Отже, константа рівноваги не залежить від концентрації речовин, а залежить від природи реагуючих речовин і температури реакції.
6.7. Вплив зовнішніх факторів на хімічну рівновагу. Принцип ле Шательє
Стан хімічної рівноваги за сталих умов може зберігатися будь-який час. Проте при зміні умов рівноваги (температури, концентрації, тиску) стан рівноваги порушується. Зміна зовнішніх факторів по-різному впливає на швидкості прямої і зворотної реакцій і тому швидкість однієї з реакцій буде більша за другу. Внаслідок цього хімічна рівновага зміститься в той чи інший бік. Через деякий час знову в системі встановиться рівновага, але вже за інших умов.
Характер зміни рівноваги залежно від зовнішніх факторів можна визначити за принципом ле Шательє.
Цей принцип, відкритий у 1882 p. французьким вченим А. ле Шательє, фо-
рмулюється так: якщо на систему, що перебуває в рівновазі, подіяти зовнішнім
фактором, то рівновага зміститься у напрямі процесу, який зменшить цю дію.
Розглянемо принцип ле Шательє на прикладі рівноважної системи ЗН2 + N2 2NH3, H298o 46,2êÄæ
Якщо до суміші речовин, які перебувають у стані рівноваги, добавити певну кількість водню або азоту, то швидкість прямої реакції, збільшиться. Збільшення швидкості прямої реакції призведе до зменшення кількості реагуючих речовин (N2 і Н2) і збільшення концентрації NН3. Система, з одного боку, відповіла на зовнішній вплив процесом, який зменшив цей вплив. З другого боку, збільшення концентрації NН3 приведе до збільшення швидкості зворотної реакції, яке відбуватиметься доти, поки швидкість зворотної реакції не зрівняється з швидкістю прямої реакції. Тобто в системі знову настає стан рівноваги, але вже за нових умов, а саме при вищих швидкостях реакцій.
Вплив тиску на стан рівноваги можна проаналізувати, розглянувши зміну об'єму реакції синтезу аміаку. З рівняння реакції видно, що з чотирьох молекул реагуючих речовин (ЗН2 + N2) утворюється дві молекули NН3, тобто синтез аміаку відбувається із зменшенням об'єму. Підвищення тиску для газоподібних систем спричинює пропорційне зменшення об'єму, що відповідає збільшенню концентрацій речовин.
84
Оскільки відносне збільшення концентрацій реагуючих речовин у реакції синтезу аміаку перевершуватиме збільшення концентрацій продуктів реакції, то рівновага зміститься в бік утворення аміаку, тобто в бік реакції, яка призводить до зменшення об'єму системи.
У реакціях, які відбуваються без зміни об'єму або в яких не беруть участь газоподібні речовини, зміна тиску не викликає зміщення рівноваги.
Підвищення температури зазначеної системи спричинює зміщення рівноваги в бік зворотної реакції, оскільки розкладання аміаку призводить до поглинання тепла.
Каталізатор не впливає на стан рівноваги, однаково прискорюючи як пряму, так і зворотну реакції. Тобто каталізатор прискорює встановлення рівноваги, не впливаючи на рівноважні концентрації речовин.
На основі аналізу зазначених прикладів можна сформулювати ряд загальних положень, які випливають з принципу ле Шательє, а саме:
нагрівання системи, що перебуває у стані рівноваги, зміщує її рівновагу в бік ендотермічної реакції, а охолодження – в бік екзотермічної;
підвищення тиску призводить до зміщення рівноваги в бік утворення тих речовин, які займають менший об'єм. Якщо об'єм системи при реакції не змінюється, то тиск не впливатиме на стан рівноваги;
збільшення концентрацій реагуючих речовин або зменшення концентрацій продуктів реакції зміщує рівновагу в напрямку прямої реакції.
Принцип ле Шательє справедливий не тільки для хімічних процесів, він має загальнонаукове значення і поширюється на всі процеси, що перебувають у стані динамічної рівноваги.
Принцип ле Шательє має велике практичне значення, особливо для хімічної промисловості. Наприклад, при синтезі аміаку підвищення температури зменшує вихід аміаку, оскільки рівновага при високих температурах встановлюється при малому вмісті NН3 в системі. Отже, для підвищення виходу реакцію треба проводити при низьких температурах. Проте стан рівноваги при цьому завдяки дуже малій швидкості встановлюватиметься за такий великий проміжок часу, що практичне використання реакції буде неможливе. Тому синтез NН3 проводять при високій температурі (450—600°С), а для прискорення встановлення рівноваги застосовують каталізатор. Проте при високих температурах і навіть при наявності каталізатора при атмосферному тиску вихід аміаку становить всього 1%. Тому промислове використання взаємодії водню і азоту для синтезу аміаку стало можливим лише при застосуванні високого тиску, який у 300—1000 раз перевищує нормальний, зміщуючи рівновагу в бік підвищення вмісту NН3 до 30%. При такому виході процес синтезу аміаку стає придатним для промислового використання.
6.8.Запитання та задачі для самоконтролю
1.Що таке швидкість хімічної реакції, як її визначити і від яких факторів вона залежить?
2.Який фізичний зміст константи швидкості, як вона виражається? Коли числові значення швидкості та константи швидкості збігаються?
3.У чому полягає відмінність між порядком і молекулярністю хімічної реакції? Коли вони збігаються?
4.Константа швидкості реакції першого порядку дорівнює 4,5•10-5 с-1, початкова концентрація реагента становить 1,6 моль/л. Обчислити початкову швидкість
85
реакції.
5.Реагенти А і В з початковою концентрацією кожного 0,2 моль/л беруть участь у реакції другого порядку. Чому дорівнює константа швидкості цієї реакції, якщо її початкова швидкість 1,6•10-4 моль/л • с?
6.Назвати порядок реакції, обчислити константу швидкості, якщо рівняння швидкості має вигляд v=k•[А]•[В]2, a v=0,036 моль/л•год, [А] = 0,37 моль/л і [В] = 1,26 моль/л.
7.У скільки разів зросте константа швидкості хімічної реакції при підвищенні температури на 40 оС, якщо температурний коефіцієнт швидкості дорівнює 3,5?
8.Обчислити, як зміниться швидкість реакції 2NO + О2 2NO2 внаслідок збільшення тиску втричі?
9.Як збільшиться швидкість реакції при підвищенні температури з 10 до 100 °С, якщо при нагріванні на кожні 10оС швидкість подвоюється?
10.Записати швидкість реакцій 2Н2 + О2 2Н2О і 2Mg + O2= 2MgO у вигляді кінетичних рівнянь.
11.Для яких реакцій підвищення температури зумовлює сповільнення їх швидкості?
12.Обчислити енергію активації реакції, швидкість якої при підвищенні температури від 27 до 37°С зростає вдвічі.
13.Що таке активований комплекс і в чому полягає його дія?
14.Який принцип дії каталізатора? Як він впливає на енергію активації?
15.Що таке константа рівноваги, про що вона свідчить і від яких факторів залежить?
16.Що сталося б, якби каталізатор неоднаковою мірою впливав на швидкість прямої та зворотної реакцій?
17.Записати вирази для констант рівноваги ендотермічних оборотних реакцій:а) СО2 + С 2СО; б) Fе3О4 + 4Н2 3Fe + 4Н2О. Вказати напрямок зміщення рівноваги при підвищенні температури та тиску.
18.При температурі 2000°С константа рівноваги реакції N2+O2 2NO дорівнює 6,0 • 10-4. Обчислити рівноважну концентрацію оксиду Нітрогену, якщо початкові концентрації азоту та кисню становлять відповідно 0,1 і 0,02 моль/л.
19.Обчислити константу рівноваги оборотної реакції А+2В С+D, якщо початкові концентрації речовин дорівнюють: [А] = 6 моль/л, [В] = 5 моль/л і до моменту появи рівноваги прореагувало 80 % речовини В.
20.Рівноважні концентрації речовин у системі 2А + В 2С + D дорівнюють: [А] = 2 моль/л, [В] = 1 моль/л, [С] = 1,6 моль/л. Обчислити початкові концентрації.
21.У посудину об'ємом 10л помістили 56 г чадного газу та 54 г водяної пари. Константа рівноваги для реакції CO + Н2О СО2 + Н2 за умов реакції дорівнює 1. Якими стали концентрації всіх речовин у момент рівноваги?
86
Список рекомендованої літератури
1.Романова Н.В. Загальна та неорганічна хімія: Підруч. для студ. вищ. навч. закл. – К.; Ірпінь: ВТФ “Перун”, 2002. – 480с.
2.Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.;
Химия, 1985 – 89. – 704с.
3.Васильева З.Г., Грановская А.А., Таперова А.А. Лабораторные работы по общей и неорганической химии: Учеб. пособие для вузов. – Л.: Химия, 1986, - 288с.
4.Кириченко В.І. Загальна хімія: Навч. посіб.- К.:Вища шк., 2005,- 639 с.:іл..
5.Телегус В.С., Бодак О.І., Заречнюк О.С., Кінжибало В.В. Основи загальної хімії/ За ред. В.С.Телегуса: Підручник.- Львів:
Світ, 1998.- 424 с.: іл.
6.Басов В.П., Юрченко О.Г. Хімія: Навчальний посібник для самопідготовки до екзамену/ Київ "Каравела", Львів "Новий Світ-2000", 2001,- 132 с.
7.Голуб А.М., Скопенко В.В. Основи координаційної хімії. К.:
Вища шк., 1977, -304 с.: іл.
8.Рейтер Л.Г., Степаненко О.М., Басов В.П. Теоретичні розділи загальної хімії: Навчальний посібник. - К.: Каравела, 2003, - 344 с.: іл.
9.Методичні розробки кафедри хімії КТУ до виконання лабораторних робіт.
87
МЕТОДИЧНІ ВКАЗІВКИ
до самостійної роботи з дисципліни «Хімія»
для студентів I курсу будівельних і гірничих спеціальностей
УКЛАДАЧІ: Мовчан Віталій Васильович, Мовчан Ольга Григорівна
Реєстрац.№ _________ |
|
Підписано до друку |
______________ 2008 р. |
Формат |
_____А5_______ |
Обсяг |
______________ стор. |
Тираж |
______________прим. |
Видавничий центр КТУ, вул.ХХІІ партз’їзду, 11 м.Кривий Ріг
88
