
Хімія / Общая химия конслек Модуль 1_
.pdf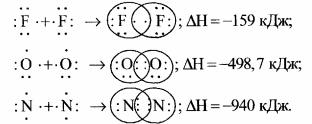
Хімічні зв'язки зображають за допомогою електронів зовнішнього енергетичного рівня у вигляді крапочок, поставлених біля хімічного елемента. Утворення ковалентного зв'язку між атомами Флуору, Оксигену й Нітрогенуможнаподатисхемами:
Завдяки взаємодії цих атомів і встановлення між ними ковалентного зв’язку, навколо кожного атома утворюється стійка конфігурація із восьми електронів.
Якщо між атомами виник один ковалентний зв'язок (одна спільна електронна пара), він називається одинарним; якщо більше, то кратним: подвійним(двіспільніпари),потрійним(триспільні електронні пари).
Одинарний зв'язок зображується однією рискою (штрихом), подвійний - двома, потрійний - трьома. Риска між двома атомами показує, що у них пара електронів узагальнена, унаслідок чого і утворився хімічний зв'язок. За допомогою таких рисок зображують структурні формули молекул.
F – F (одинарний зв'язок); О = О (подвійний зв'язок); N≡N (потрійний зв'язок).
Потрійний зв'язок міцніший, ніж подвійний і первинний (одинарний). Тому молекула азоту є міцнішою, ніж молекула кисню або водню, чим зумовлена значна інертність азоту у хімічних реакціях.
Валентність атома визначається числом неспарених електронів на його валентному рівні.
Наприклад:
8O1s22s22px2 p1y p1z - валентність ІІ;
11Na 1s22s22р63s1 - валентність І.
Число неспарених електронів на валентному рівні атома може змінюватися під час переходу атома у збуджений стан. Такий перехід можливий тільки тоді, коли в атома на валентному рівні є вакантні АО.
51
Наприклад, в алюмінію: 13Al, 1s22s22р63s23p1 можливе розпаровування 3s-електронів з переходом одного s-електрона в р-стан, де є вакантні АО.
13Al, 1s22s22p63s1 3p1x3p1y
Уцьому випадку три неспарених електрони і алюміній буде проявляти валентність ІІІ.
Якщо в атомі, виходячи з його електронної структури, на зовнішньому енергетичному рівні немає вакантних АО, розпаровування з переходом електронів на суміжні АО даного енергетичного рівня неможливе. Наприклад, для азоту, кисню і фтору характерний лише нормальний стан, тому що на валентному (другому) рівні є лише s- і р- підрівні, що заповнені електронами.
7 N, 1s22s22p1x2p1y 2p1z ; 8O, 1s22s22px22p1y 2p1z ; 9F, 1s22s22px22p2y2p1z ;
Тому за рахунок неспарених електронів атом азоту може утворювати три ковалентних зв’язки, атом кисню – два і атом фтору – ли-
ше один. У неону 10Ne, 1s22s22px22p2y 2pz2 взагалі немає вакантних АО на валентному рівні. Валентність нульова. Збудженого стану немає. Цим і пояснюється його інертність.
Атоми елементів третього періоду на зовнішньому енергетичному рівні мають d-підрівень, на який при збудженні можуть переходити s- і р-електрони зовнішнього рівня. При цьому з’являється додаткова можливість збільшення числа неспарених електронів. Так, наприклад, атом хлору в основному стані має один неспарений електрон і при затраті енергії може бути переведений у збуджений стан, що характеризується наявністю трьох, п’яти і семи електронів.
17Cl,.....3s23px2 py2 p1z |
(В=I) Нормальний стан |
17Cl,.....3s23px2 p1y p1z3d1xy |
(В=III) Збуджений стан |
17Cl,.....3s23p1x p1y p1z3d1xyd1xz |
(В=V) Збуджений стан |
17Cl,.....3s13p1x p1y p1z3d1xydxz1 d1yz |
(В=VII) Збуджений стан |
Тому атом хлору проявляє валентність – І, ІІІ, V, VII.
52
Приклад 1. Яку валентність проявляє магній?
Відповідь. У нормальному стані розподіл електронів такий: 12Mq, 1s22s22р63s2. Неспарених електронів немає, отже магній у нормальному стані не утворює хімічних сполук. Проте на валентному рівні (третьому) у нього є вакантні АО. Тому атом магнію легко переходить у збуджений стан. Один 3s-електрон переходить на 3р- підрівень. У збудженому стані атом магнію проявляє валентність ІІ.
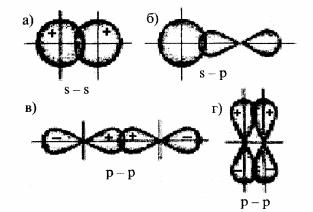
Хімічний зв’язок між атомами зумовлюється перекриванням s-, р-, d-атомних орбіталей, які певним чином орієнтовані у просторі. Тому й хімічний зв’язок, що утворюється за їх участю, має в просторі певну напрямленість. Залежно від способу перекривання електронних орбіталей розрізняють σ (сигма)-, π (пі) і δ(дельта) – зв’язки.
σ-зв’язок здійснюється при перекриванні електронних орбіталей уздовж лінії, що з’єднує ядра взаємодіючих атомів. Так перекриваються: s- і s-, s- і р-, р- і р-, d- і d-АО між собою.
Рис.4.2. Схема перекривання орбіталей під час утворення σ (а, б, в) – та π (г)
– зв’язків
σ-зв’язок характеризується однією областю перекривання електронних орбіталей, він завжди одинарний, тобто утворюється за рахунок однієї електронної пари.
π- зв’язок виникає при перекриванні АО по обидва боки від лінії, що з’єднує ядра атомів. Наприклад, під час взаємодії двох р- орбіталей, розташованих перпендикулярно до лінії, що з’єднує ядра атомів, виникають дві області перекривання (рис.4.2, г). Відповідно
53
π-зв’язок характеризується двома областями перекривання, що розташовані по обидва боки від лінії, яка з’єднує ядра атомів. π- зв’язок також може утворитися при перекриванні двох d-орбіталей тощо.
Часто при утворенні молекул відбувається зміна форми й енергії АО. Замість нерівноцінних (різних за формою і енергією) АО утворюються рівноцінні (гібридні) АО, що мають однакову форму й енер-
гію, тобто відбувається гібридизація (змішування) АО.
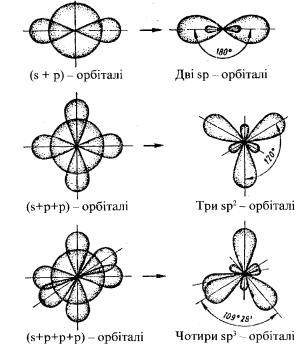
Тип гібридизації визначається типом і кількістю орбіталей, що беруть участь у гібридизації. Число гібридизованих орбіталей завжди дорівнює числу орбіталей, які беруть участь у гібридизації. Гібридні АО мають несиметричний вигляд.
Рис.4.3. Гібридизація валентних орбіталей
sp-гібридизація (q2) відбувається у випадку перекривання s- і р- орбіталей. Гібридні орбіталі розташовуються симетрично під кутом 180º. Зв’язки, що утворюються за участю електронів цих орбіталей, також розташовуються під кутом 180º. Форма молекул – лінійна. Наприклад, молекули BeH2 і BeCl2 мають лінійну форму.
54

Рис.4.4. Лінійна молекула BeCl2
Такий тип гібридизації має місце при утворенні галогенідів елементів ІІ групи періодичної системи.
sp2-гібридизація (q3) виникає при перекриванні однієї s- і двох р- орбіталей. У цьому випадку гібридні АО розташовуються одна до другої під кутом 120º.
Під таким самим кутом розміщуються зв’язки, утворені електронами цих орбіталей. Такий тип гібридизації характерний для молекул елементів ІІІ групи періодичної системи. Наприклад, молекула ВCl3 має форму правильного рівностороннього трикутника, у центрі якого розташований атом бору, а на вершинах – атоми хлору.
Рис.4.5. Плоска трикутна молекула ВCl3
sp3-гібридизація (q4) виникає при перекриванні однієї s- і трьох р-орбіталей. Чотири гібридні орбіталі, що утворюються, симетрично орієнтуються у просторі під кутом 109º28´ (тетраедрична орієнтація).
Тетраедричне розміщення зв’язків і форма тетраедра характерні для багатьох сполук чотиривалентного вуглецю, наприклад, у молекулі CCl4 або CH4.
sp3-гібридизація характерна і для інших молекул елементів IV групи періодичної системи.
55

Рис.4.6. Схема утворення хімічних зв’язків у тетраедричній молекулі метану
Проте можуть біти відхилення від тетраедричної форми. Наприклад, у молекулах аміаку спостерігається sp3-гібридизація, проте молекули мають пірамідальну будову. Це пояснюється тим, що в молекулах аміаку тільки три гібридні орбіталі приймають участь в утворені зв’язків з атомами водню, а четверта – насичена власними електронами.
Таке явище спостерігається й у молекулах води (sp3- гібридизація), де дві гібридні АО насичені тільки власними електронами. Тому молекули води побудовані у площині з кутом між зв’язками, що дорівнює 104,5º.
Рис.4.7. Схема утворення хімічних зв’язків у молекулах H2O і NH3
Ковалентний зв'язок може бути неполярним або полярним. Полярність хімічного зв’язку виникає при зміщенні електронної пари до атома з більшою електронегативністю (æ) (див. розділ 3.6). Кількісно полярність зв’язку визначають за значенням дипольного моменту μ (мю), що дорівнює добутку заряду на відстань між центрами негатив-
56
ного і позитивного полюсів диполя: μ=q·l, де μ – дипольний момент; q
– ефективний заряд; l - довжина диполя.
Молекули, що утворилися за рахунок полярного ковалентного зв’язку, як правило, полярні. Наприклад, HCl, HBr, HI тощо. Проте зустрічаються неполярні молекули, що утворилися за рахунок полярного зв’язку, наприклад, СH4, СCl4, СО2, ВH3, BCl3. Таке явище пов’язане із симетричним розташуванням атомів у просторі. Дипольні моменти зв’язків, що виникли в молекулі, компенсуються іншими дипольними моментами зв’язків тієї самої молекули. Тому молекули в цілому неполярні.
Молекули, утворені за допомогою ковалентного неполярного зв’язку (наприклад Cl2, Br2, І2, О2, N2, )- неполярні. Це пояснюється тим, що æ атомів однакова й тому немає зміщення електронних пар.
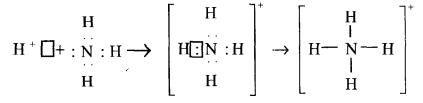
Ковалентний зв'язок може виникнути за обмінним (кожен з атомів надає по одному електрону для утворення спільної електронної пари) або донорно-акцепторним механізмом.
Донорно-акцепторний механізм утворення ковалентного зв’язку полягає в тому, що виникає перекривання АО за рахунок спареної (неподіленої) електронної пари одного атома з вакантною АО другого атома. Атом, що дає неподілену електронну пару, називається донором електронів; атом, який дає вакантну АО – акцептором електронів.
Донорно-акцепторний механізм утворення ковалентного зв’язку
схематично можна зобразити так: |
|
А: + |
В□ →А:В |
донор |
акцептор |
Прикладом донорно-акцепторної взаємодії є реакція між йоном Гідрогену Н+ (ls° - вільна s орбіталь) і молекулою амоніаку NH3, яка має неподілену пару електронів (двоелектронну хмару). Процес утворення йона амонію можна подати схемою:
або NH4 .
57
Слід зауважити, що всі чотири зв'язки N - Н у катіоні амонію є рівноцінними і однаковими за властивостями.
4.2. Іонний зв'язок
Іонний зв’язок утворюється в результаті електростатичної взаємодії двох різнойменно заряджених іонів. Він утворюється між атомами типових металів і неметалів. Його можна розглядати як граничний випадок полярного ковалентного зв’язку, коли пара електронів, що утворює зв’язок, настільки зміщена до одного з атомів, що практично належить тільки цьому атому.
Характерною ознакою іонного зв’язку є його ненасиченість і ненапрямленість у просторі. Іони можна розглядати як заряджені кульки, силові поля яких рівномірно розподілені в усіх напрямках у просторі. Тому, наприклад у сполуці NaCl іони натрію можуть взаємодіяти з іонами хлору у будь-якому напрямку, притягуючи певну їх кількість. Так само й іони хлору можуть взаємодіяти з іонами натрію.
Оцінку типу хімічного зв’язку в сполуках можна зробити на підставі значень ефективних зарядів атомів. Наприклад, у молекули HCl
ефективний заряд H – (+0.17), CI – (-0,17), у NaCl - +0,8 і (-0,8) від заряду електрона. Отже, в молекулах HCl зв’язок ближчий до ковалентного, а у NaCl – до іонного, тобто сполук тільки з іонним зв’язком немає, річ може йти лише про частку іонного зв’язку в хімічних сполуках.
4.3. Металічний зв'язок
Металічний зв’язок характерний для металів, що на зовнішніх оболонках мають вакантні орбіталі. При об’єднанні атомів у кристали ці орбіталі перекриваються таким чином, що між атомами утворюються зони, по яких вільно можуть рухатися електрони. Валентні електрони в кристалі металу вільно рухаються по всьому об’єму кристала. Отже, металічний зв’язок делокалізований. Цим і пояснюється висока електро- і теплопровідність, а також ковкість та інші властивості металів. Металічний зв'язок характерний для металів у твердому і рідкому станах. Однак, у пароподібному стані атоми металів, як і всіх речовин, сполучені між собою ковалентними зв’язками.
58
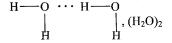
4.4. Водневий зв'язок
Водневий зв’язок виникає між позитивно поляризованим атомом водню однієї молекули і негативно поляризованим атомом з великою електронегативністю, (наприклад, атом фтору, кисню або азоту), іншої молекули. Позитивно поляризований атом водню характеризується унікальними властивостями (дуже малим розміром і відсутністю внутрішніх електронних оболонок), тому він може проникати в електронну оболонку негативно поляризованого атома сусідньої молекули. Між двома молекулами виникає взаємодія, що має електростатичний і частково донорно-акцепторний характер. Внаслідок цього відбувається асоціація молекул у ді-, три-, тетрамери тощо. Водневий зв'язок позначають трьома крапочками, він набагато слабший від ковалентного зв’язку (у 15 – 20 разів).
Водневий зв’язок особливо характерний для молекул води. Рідкий стан води обумовлений здатністю її молекул сполучатися в асоці-
ати (Н2О)n, де n =1, 2, 3, 4 тощо.
4.5. Міжмолекулярна взаємодія
Міжмолекулярна взаємодія. Між молекулами може відбуватися як електростатична, так і донорно-акцепторна взаємодія. Сили електростатичної молекулярної взаємодії, виникнення яких не супроводиться передачею атомами електронів, називаються силами Ван-дер-
Ваальса. Їх поділяють на орієнтаційну, індукційну і дисперсійну вза-
ємодії.
Орієнтаційна взаємодія виявляється між полярними молекулами. При зближенні вони орієнтуються таким чином, що різнойменно заряджені кінці їх диполів притягаються і молекули орієнтуються по прямій. Чим більш полярні молекули, тим сильніше вони притягуються і тим сильнішою є орієнтаційна взаємодія.
Індукційна взаємодія. Якщо зустрічаються полярні й неполярні молекули, то полярні молекули поляризують неполярні, внаслідок чого останні стають індуковано полярними. Між постійним диполем полярної молекули і індукованим диполем неполярної молекули виникає
59
індукційна взаємодія, при якій індукований диполь збільшує дипольний момент полярної молекули.
При взаємодії двох полярних молекул у них під дією власних електричних полів виникають додатково індуковані диполі. Тому загальна взаємодія складається з орієнтаційного й індукційного ефектів.
Дисперсійна взаємодія. Всередині неполярних молекул постійно відбувається перерозподіл електронної густини внаслідок руху електронів в атомах і коливання ядер. Це приводить до синхронної появи і зникнення миттєвих мікро диполів, за рахунок яких молекули притягуються одна до одної. Дисперсійні сили універсальні. Вони діють як між усіма видами молекул, так і між атомами та іонами.
Слід зазначити, що загальна енергія притягання між молекулами є сумою орієнтаційної, індукційної та дисперсійної взаємодій.
Е=Еорієнт+Еіндукц+Едиспер
Енергія кожного виду цих сил у явищах міжмолекулярної взаємодії різна. Так, наприклад, для молекул Ar, H2, Ne, Едиспер=100%, для молекул NH3 Едиспер=50%, Еорієнт=44,6%, Еіндукц=5,4%.
4.6. Тверді тіла. Типи кристалічних граток
Тверді тіла перебувають у двох станах: аморфному і кристалічному. Аморфний стан характеризується хаотичним розміщенням частинок у просторі. Для аморфного стану характерна ізотропія властивостей, тобто фізичні властивості у різних напрямках однакові. Прикладом аморфного стану можуть бути скло, смола, пластмаса, твердий клей тощо. У кристалічному стані молекули, атоми чи іони речовин знаходяться тільки в певних точках простору, що мають назву вузлів кристалічної гратки.
Для кристалічного стану характерна анізотропія властивостей кристалу (міцність, електро- і теплопровідність, оптичні властивості тощо) у різних напрямках різні.
Типи кристалічних граток. Залежно від природи частинок, що містяться у вузлах кристалічної гратки, а також від характеру сил між ними, розрізняють такі основні типи кристалічних граток: молекуляр-
ні, атомні, іонні й металічні (табл.4.1).
Приклади речовин з різним типом кристалічних граток: - молекулярні
60
