
Хімія / Общая химия конслек Модуль 1_
.pdf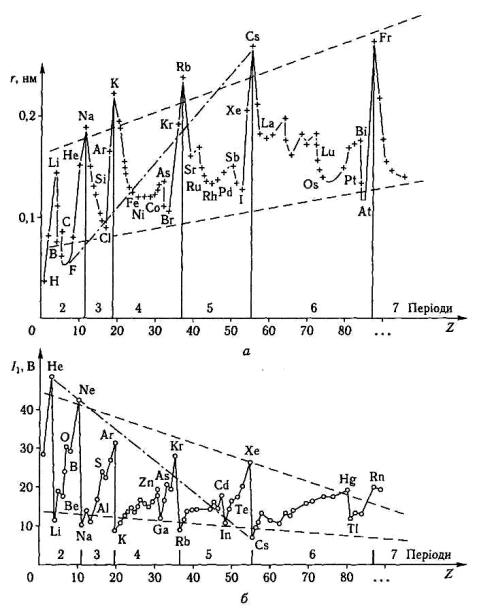
Рис.3.4. Закономірності зміни радіусів r атомів елементів (а) і потенціалів їх іонізації (б).
41

•Враховуючи характер зміни величин I1 у групах і періодах, треба за значити, що зліва в системі елементів, і особливо в її нижній частині,знаходяться найактивніші метали-відновники, здатні енергетично легко окиснюватися. Тобто, енергія іонізації може бути кількісною мірою відновлювальноїздатності елемента, його “металічності”.
Енергія спорідненості до електрона
Енергія спорідненості до електрона (Eсп, кДж/моль; еВ) — кіль-
кість енергії, що виділяється під час приєднання до атома одного електрона з утворенням негативно зарядженого йона: R° + e → R-, Eсп <0. Енергія спорідненості до електрона кількісно характеризує протилежну за відношенням до металів тенденцію — здатність атомів неметалів утворювати негативно заряджені йони (окисні властивості неметалів), тобто є мірою “неметалічності” елемента.
Характер зміни значень Eсп в групах і періодах системи елементів наведено в табл. 3.2.
Таблиця 3.2. Енергія спорідненості до електрона атомів деяких елементів.
Символ |
Електронна формула |
Eсп, eB |
«Йони»елементів |
|
елемента |
атомів елементів |
|
Електронна формула |
Символ |
Н |
1s1 |
0,747 |
1s2 |
H- |
F |
2s22p5 |
3,450 |
2s22p6 |
F- |
Cl |
3s23p5 |
3,610 |
3s23p6 |
Cl- |
Вг |
3d104s24p5 |
3,360 |
3d104s24p6 |
Вг- |
І |
4d105s25p5 |
3,060 |
4d105s25p6 |
І- |
О |
2s2 2p4 |
1,470 |
2s22p5 |
O- |
S |
3s23p4 |
2,070 |
3s23p5 |
S- |
Se |
3d104s24p4 |
1,700 |
3d104s24p5 |
Se- |
N |
2s2 2p3 |
-0,100 |
2s2 2p4 |
N- |
Р |
3s23p3 |
0,700 |
3s23p4 |
P- |
С |
2s2 2p2 |
1,250 |
2s2 2p3 |
C- |
Si |
3s23p2 |
1,630 |
3s23p3 |
Si- |
Be |
2s2 |
-0,600 |
2s22p1 |
Be- |
Li |
2sl |
0,540 |
2s2 |
Li- |
Аналізуючи даніцієї таблиці, можназробити такі висновки:
42
Угрупах елементів зверху вниз значення Есп зменшується у міру того, як радіуси атомів зростають уцьомунапрямі;
Уперіодах елементів зліва направо |—>| значення Есп зростають у
міру того, як радіуси атомів зменшуються уцьомунапрямі;
Аналізуючи характер зміни величин Есп у групах і періодах елеме-
нтів,
можна зробити висновок про те, що праворуч у системі елементів (IVA, VA, VIA і VIIA групи) й особливо у правій верхній частині її знаходяться найактивніші неметали-окисники, здатні активно приєднувати електрони та перетворюватися на негативні йони з одночасним виділенням найбільшої кількості енергії Есп.
Найбільшою спорідненістю до електрона характеризуються елементи VIIA групи. Для більшості металів та для благородних газів енергія Есп має невеликі значення або є від'ємною.
Електронегативність атомів
Електронегативність атомів (æ, кДж/моль; еВ/атом) — умовна величина, що характеризує здатність атома в хімічних сполуках приєднувати електрони, якіберуть участь в утворенні хімічного зв'язку.
Фізичну суть електронегативності æ можна уявити як питому густину валентних електронів, тобто як електронну густину, яка припадає на одиницю поверхні зовнішньої оболонки (сфери) атома. Чим менший радіус атома, тим менша його сфера. Однак чим більшою є кількість електронів, що знаходяться на зовнішньому рівні, і чим меншою є поверхня сфери атома, тим більшою буде електронна густина, а отже, й електронегативність æатома елемента.
Зауважимо, що хімічні елементи за своєю природою двоїсті, тому поділ їх на метали і неметали умовний. Із посиленням в елементів неметалічних властивостей спостерігається послаблення металічних властивостей і навпаки. Тому для характеристик загальної хімічної активності будь-якого з елементів потрібна кількісна характеристика, яка враховувала бобидвітенденції: як відщеплення, так іприєднання електронів.
Такою характеристикою запропоновано вважати енергію, яка є сумою енергії йонізації I1 та енергії спорідненості до електрона (Есп), і
називається електронегативністю (æ):
43
æ= I1 + Есп
Користуватися абсолютними значеннями æ не зовсім зручно, тому вводять простіші та зручніші для зіставлення значення відносної електронегативності елементів æ, які є співвідношеннями абсолютних значень æ цього елемента та æ елемента, що має найменше значення серед усіх елементів системи.
Значення відносних електронегативностей елементів, які розрахованіза методом Л. Полінга, наведено в табл. 3.3.
Із даних таблиці випливає, що значення æ змінюються закономірно, підпорядковуючись періодичномузакону, від æCs = 0,86 до æF =4,1:
•уперіодах(—>)значення æзростаютьзізбільшеннямпорядкових номерів елементів, досягаючи найбільших значень в елементів VIIA групи;
•у групах елементів зверху вниз значення æзменшуються;
•аналізуючи характер зміни значень æ у групах і періодах, можна зробити висновок, що у верхній правій частині системи елементів знаходяться найбільш електронегативні елементи (найбільше значення æ у Флуору), які досить активно виявляють неметалічні (окислювальні) властивості.
Електронегативність, як одна з фундаментальних величин у хімії, досить широко використовується при вирішенні багатьох практичних і теоретичних питань як науки, так і технологічних процесів. Зокрема, різницювідносних електронегативностей(Δæ) атомів різних елементів, що утворюють хімічний зв'язок між собою, використовують для встановлення типу зв'язку. Якщо Δæ має значення від 1,9 до 3,24, то зв'язок між атомами йонний; якщо Δæ = 0 — ковалентний неполярний; у проміжних випадках, якщо 0 <Δæ<1,9, зв'язок— ковалентнийполярний.
Таблиця 3.3. Відносні електронегативності деяких елементів.
|
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
|
1 |
H |
|
|
|
|
|
|
|
He |
|
2,10 |
|
|
|
|
|
|
|
- |
2 |
Li |
Be |
B |
C |
N |
O |
F |
|
Ne |
|
0,97 |
1,47 |
2,01 |
2,50 |
3,07 |
3,50 |
4,10 |
|
- |
3 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
|
Ar |
|
1,01 |
1,23 |
1,47 |
1,74 |
2,10 |
2,60 |
2,83 |
|
- |
44
|
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
|
4 |
0,91 |
1,04 |
1,20 |
1,32 |
1,45 |
1,56 |
1,60 |
1,64 |
1,70 |
1,75 |
|
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
|
|
|
Kr |
|
|
|
|
|
||||||||
|
1,75 |
1,66 |
1,82 |
2,02 |
2,20 |
2,48 |
2,74 |
|
|
|
- |
|
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
|
5 |
0,89 |
0,99 |
1,11 |
1,22 |
1,23 |
1,30 |
1,36 |
1,42 |
1,45 |
1,35 |
|
Ag |
Cd |
In |
Sn |
Sb |
Te |
In |
|
|
|
Xe |
|
|
|
|
|
||||||||
|
1,42 |
1,45 |
1,49 |
1,72 |
1,82 |
2,01 |
2,21 |
|
|
|
- |
|
Cs |
Ba |
La* |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
|
6 |
0,86 |
0,97 |
1,08 |
1,23 |
1,33 |
1,40 |
1,46 |
1,52 |
1,55 |
1,44 |
|
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
|
|
|
Rh |
|
|
|
|
|
||||||||
|
1,42 |
1,44 |
1,44 |
1,55 |
1,67 |
1,76 |
1,90 |
|
|
|
- |
7 |
Fr |
Ra |
Ac** |
|
|
*Лантаноїди 1,08 – 1,14 |
|
|
|||
0,89 |
0,97 |
1,00 |
|
|
**Актиноїди 1,11 – 1,20 |
|
|
||||
3.7. Запитання для самоконтролю
1.Назвіть хоча б одне експериментальне підтвердження хвильової природи електрона. Хто з учених вперше висловив ідею про двоїсту природу електрона?
2.Стан кожного електрона в атомі характеризується чотирма квантовими числами — назвіть і вкажіть фізичний зміст кожного з них. 3.Відомі чотири стабільні ізотопи Барію з масовими числами 135, 136, 137 і 138. Яке число протонів і нейтронів у ядрах кожного з нуклідів? 4.Назвіть ізотопи елемента, масові числа яких відрізняються у півтора і більше раза.
5.Який атомний номер і приблизна атомна маса елемента, ядро якого складається з 81 протона і 122 нейтронів? Напишіть повне позначення цього нукліда, вказавши хімічний символ, атомний номер і масове число.
6. Запишіть значення усіх квантових чисел для двох електронів, що містяться на 4s-орбіталі.
10.Напишіть набори усіх чотирьох квантових чисел для кожного з електронів, що містяться на Зр-орбіталях.
11.Поясніть, чому в періодичній системі елементів Аг, Co Те, Th, U розміщені відповідно перед К, Ni, I, Pa, Np, хоча і мають більшу відносну атомну масу.
45
12.Беручи до уваги правила квантування, виведіть формулу, що виражає місткістьенергетичногоелектронного шару.
13.Якамаксимальна кількість електронів може міститися в атомі на енергетичному рівні з п = 4?
14. Що такеізотопи, ізобари, ізотони?
15.Чому не можна одночасно точно визначити координати електрона та його швидкість?
16.Скільки є значень магнітного квантового числа для енергетичного підрівня, що характеризується значенням орбітального квантового чис-
ла l= 2?
17.Вкажіть максимальну кількість електронів, які можуть міститись в атомі на енергетичному рівні з п = 3.
18.Уякогоелементапочинаєтьсязаповнення5s-підрівня?
19.Яким є максимальне значення головного квантового числа n для елементів періодичноїсистеми?Що характеризує головнеквантовечисло? 20.Якими літерами позначають енергетичні рівні, що мають головне квантовечисло від1до 7?
21.Якийфізичнийзмістквадрата хвильовоїфункції[Ψ]2?
22. Якими квантовими числами визначається енергія електрона в атомі?
23.Які значення орбітального квантового числа можливі для енергетичного рівня N(n=4)?
24.Скільки орбіталей міститьсяна енергетичномупідрівніl=3? 25.Яких значень може набувати магнітне квантове число для l = 2? 26.Яке обмеження накладає принцип Паулі на значення квантових чисел електронів у атомі?
27.У чомусуть правил Клечковського?Проаналізуйте відносну енергію Зр-, 3d-, 4s- та 4р-орбіталей.
28. Які електронні орбіталі мають однакове значення суми (n + l) = 6? Яка послідовність зростання їх енергії?
29.Скільки неспарених електронів у збудженого атома хлору? 30.Запишіть електронну формулу атома купруму. Підкресліть валентні електрони. До якої родини елементів він належить?
31.Яке число атомних орбіталей міститься на електронних підрівнях атома: s-,p-, d-, f-; яке максимальне число електронів можуть містити: а) кожна АО; б) кожний підрівень?
46
32.У елементів якого періоду електрони валентного рівня характеризуються значеннями суми квантових чисел n + l = 5? 33.Вкажіть порядкові номери і назви елементів в яких: а) закінчується заповнення електронами орбіталей 4s ; б) починається заповнення підрівня 4p ; Як змінюється значення суми (n + l) для цих елементів?
34.Що таке період у періодичній системі елементів? Які є періоди? 34.Що таке група у періодичній системі елементів? Які є групи? 35.Які родини елементів розрізняють у періодичній системі на підставі уявлень про енергетичні підрівні? Назвіть місткість кожної родини.
3.8.Задачі для самоконтролю
1.Обчисліть довжину хвилі де Бройля, яка відповідає електрону з масою 9,1 • 10-31 кг, що рухається зі швидкістю 6,5 • 106 м/с.
2.Розрахуйте швидкість, з якою повинна рухатися α-частинка масою
6,64 • 10-27 кг, якщо їй відповідає довжина хвилі де Бройля λ = 1,42 • 10-3 нм (1нм = 10-9 м).
3. Обчисліть середню відносну атомну масу елемента Силіцію, знаючи, що у природних сполуках він трапляється з таким ізотопним складом: 92,28% (за масою) 28Si, 4,67% 29Si і 3,05% 30Si.
4.Складіть електронні та електронно-графічні формули валентних рівнів атомів елементів з порядковими номерами 42 і 52. До яких сімейств вони належать?
5.Які атомні орбіталі заповнюються електронами раніше: 4d- чи 5s-; 6s- чи 5p-? Складіть електронну формулу валентного рівня атома з порядковим номером 44.
6.Які з наведених електронних формул, що відтворюють будову
незбуджених |
атомів |
|
певних |
елементів, |
неправильні: |
|
a)1s22s22p53s1; |
|
б) |
Is22s22р63s2; |
в)Is22s22р63s23р63d4; |
||
r)Is22s22р63s23р64s2; д) Is22s22р63s23d2? Чому? Атомам яких елементів відповідають правильно складені формули?
7.Складіть електронні формули йонів елементів: a) Sn2+; б) Sn4+;
в) Mg2+; г)Си2+; д) Сl-; е) S2- .
8.На основі електронних формул валентних рівнів атомів Хрому і Селену визначте їх можливі ступені окиснення в сполуках. Скла-
47
діть формули їх типових сполук (оксидів, гідроксидів, гідрогенових сполук, солей).
9.Виходячи з положення металу в періодичній системі, дайте мотивовану відповідь на запитання, який з двох гідроксидів є сильнішою основою:
Ca(OH)2 чи Fe(OH)2; Cd(OH)2 чи Sr(OH)2 ?
10.Які найнижчі ступені окиснення виявляють неметали: Хлор, Сульфур, Нітроген і Карбон? Чому? Як розрахувати ці ступені окиснення? Складіть формули сполук цих елементів з Гідрогеном і Алюмінієм, назвіть їх.
48
4.Хімічний зв’язок. Кристалічний стан речовин
4.1.Основні типи хімічного зв’язку. Ковалентний зв’язок
Хімічний зв'язок значною мірою визначає будову молекул і тіла
загалом, а отже, і властивості хімічних сполук, речовин і тіл.
Серед індивідуальних хімічних речовин, що поділяються на прості та складні, простих порівняно небагато. Але й серед простих речовин тільки благородні гази складаються з хімічно не зв’язаних один з одним атомів. У решті випадків атоми сполучені між собою хімічними зв’язками. Будова атома, стан електрона в ньому, та вчення про періодичність пояснюють механізм утворення молекул і природу хімічного зв’язку.
Молекули хімічних речовин утворюються із атомів за рахунок хімічного зв’язку, що має електричну природу. Хімічний зв'язок утворюється за рахунок валентних електронів, але здійснюється він по різному. Залежно від характеру розподілу електронної густини в речовині, розрізняють такі основні типи хімічного зв’язку: ковалентний.
іонний і металічний.
Хімічний зв’язок, утворений спільними електронними пара-
ми, називається ковалентним. Ковалентний зв’язок здатний до на-
сиченості, має певний напрямок у просторі й поляризується.
З метою пояснення природи зв’язку англійські вчені Гейтлер і Лондон запропонували метод валентних зв’язків (МВЗ).
Необхідно твердо засвоїти основні положення МВЗ. 1.Хімічний зв’язок виникає за рахунок утворення спільних елек-
тронних пар між взаємодіючими атомами, причому в утворенні зв’язку беруть участь електрони із антипаралельними спінами.
2.Процес утворення молекул із атомів енергетично вигідний, енергія молекул менша від суми енергій атомів.
3.Хімічний зв’язок утворюється за рахунок перекривання орбіталей взаємодіючих атомів.
4.Ковалентний зв’язок тим міцніший, чим більша площина перекривання АО.
Механізм утворення ковалентного зв'язку розглянемо на прикладі утворення молекули водню:
Н + Н = Н2; ∆Н = - 436 кДж/моль
49

Ядро вільного атома Гідрогену оточене сферичною симетричною електронною хмарою, утвореною 1s-електроном. Під час зближення атомів до певної відстані відбувається часткове перекривання їх електронних хмар (орбіталей) (рис 4.1). У результаті між центрами обох ядер виникає молекулярна двоелектронна хмара, що має максимальну електроннугустинув просторіміж ядрами.
Збільшення густини негативного заряду сприяє швидкому зростанню сил притягання між ядрами та молекулярною хмарою. Отже, утворення ковалентного зв'язку є результатом перекривання електронних
хмар атомів. У результаті виникнення хімічного зв'язку спільної пари електронів між двома атомами Гідрогену кожен з них досягає електронної конфігурації атома благородного газу гелію:
Н· + ·Н → Н:Н
Неспарені |
Спільна, або |
електрони |
поділена пара електронів |
Ковалентний зв'язок у молекулі хлору також утворюється за допомогою спільних електронів або електронної пари:
Як бачимо, кожен атом Хлору має три неподілені пари і один неспарений електрон. Хімічний зв'язок виникає за рахунок неспарених електронів кожного атома. Неспарені електрони зв'язуються у спільну пару електронів, яка називається також поділеною парою.
Отже, у молекулі хлору кожен його атом має завершений зовніш-
ній рівень звосьми електронів (s2p6), причомудва з них(електронна пара)
однаковою мірою належать обом атомам.
50
