
- •Міністерство освіти і науки україни
- •Криворізький технічний університет
- •Кафедра хімії
- •Методичні вказівки
- •1. Теоретична частина 4
- •Гальванічні елементи. Корозія металів
- •Електроліз
- •Лабораторна робота "Загальні властивості металів. Гальванічні елементи. Корозія"
- •Домашня підготовка до лабораторної роботи
- •Запитання та задачі для самоконтролю
- •Література
- •Стандартні електродні потенціали металів у водних розчинах
Міністерство освіти і науки україни
Криворізький технічний університет
Кафедра хімії
Методичні вказівки
до самостійного вивчення теми та виконання лабораторної роботи
«ЗАГАЛЬНІ ТА ЕЛЕКТРОХІМІЧНІ ВЛАСТИВОСТІ МЕТАЛІВ»
для студентів I курсу
всіх спеціальностей
денної та заочної форм навчання
Кривий Ріг
2007
Укладачі: Мовчан В.В., канд. хім. наук, доцент
Гостюхин І.А., асистент
Мовчан О.Г., канд. хім. наук, доцент
Вiдповiдальний за випуск: Часова Е.В., канд. хім. наук, доцент
Рецензент: Ломовцева С.Б., ст.викладач
Методичні вказівки до самостійного вивчення розділу хімії та до виконання лабораторної роботи «Загальні та електрохімічні властивості металів» для студентів 1 курсу всіх спеціальностей містять основні відомості з теорії електрохімічних процесів, приклади, а також питання для самоконтролю та задачі для самостійного розв’язування.
|
РОЗГЛЯНУТО
на засіданні кафедри хімії |
СХВАЛЕНО на вченій раді металургійного факультету
|
|
Протокол №
від «___» _______200_ р.
|
Протокол №
від «____» ________200_ р. |
ЗМІСТ
1. Теоретична частина 4
1.1. Загальні властивості металів 4
1.2. Гальванічні елементи. Корозія металів 11
1.3. Електроліз 15
2. Лабораторна робота "Загальні властивості металів. Гальванічні елементи. Корозія" 18
3. Домашня підготовка до лабораторної роботи 19
3.1. Запитання та задачі для самоконтролю 19
4. Література 21
Теоретична частина
Загальні властивості металів
Переважній більшості елементів Періодичної системи (понад 80%) у вільному стані відповідають прості речовини метали. До елементів, які існують у вигляді простих речовин-металів, належать s-елементи І і II груп (окрім Гідрогену), усі d- і f-елементи, а також р-елементи головних підгруп: ІІІ (крім В), ІV (Ge, Sn, Pb), V (Sb, Bi) і VI ( Po) груп. Деяким елементам (Германій, Стибій, Силіцій) відповідають прості речовини, що поєднують металічні властивості з неметалічними.
Атоми металів, як правило, мають у зовнішньому електронному шарі 1,2 і значно рідше 3 або 4 електрони та великі атомні радіуси.
Метали визначаються здатністю їхніх атомів легко віддавати свої зовнішні (валентні) електрони і перетворюватися на позитивні іони внаслідок низьких значень електронегативностей, які обумовлені невисокими енергіями іонізації атомів і невеликою (часто від'ємною) спорідненістю до електрона.
Прості речовини метали. За звичайних умов це тверді речовини кристалічної будови (крім ртуті) з металічним типом зв'язку. Для них характерні: особливий металічний блиск; висока тепло- та електропровідність; пластична деформація. Кристалічні гратки металів складаються з нейтральних атомів і позитивних іонів, які оточені вільними електронами. Рух електронів відбувається хаотично, подібно до руху молекул газу (рис. 1.1).
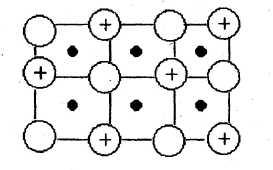
Рис. 1.1. Схематичне зображення металічних граток
Більшість металів кристалізується в одному з трьох типів кристалічної гратки (рис.1.2): щільна гексагональна (Mg, Be, Zn), щільна кубічна гранецентрована (Al, Cu, Ag, Au, Ni, γ-Fe), кубічна об’ємноцентрована (лужні метали, Cr, V, Pb, W, α-Fe).
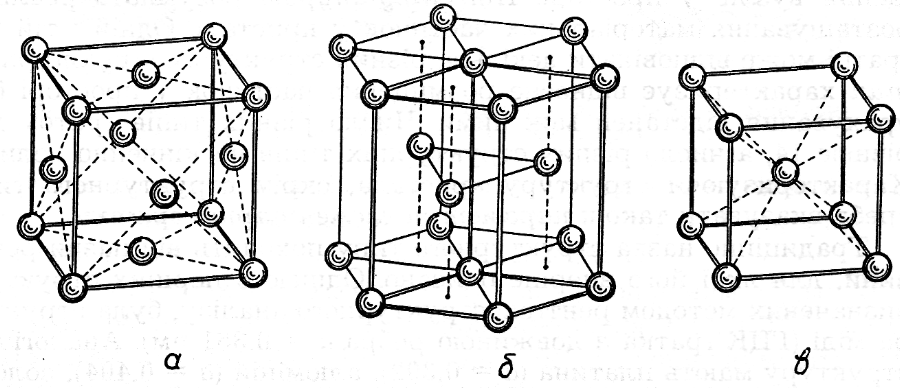
Рис. 1.2. Кристалічні гратки металів: а- кубічна гранецентрована;
б- гексагональна; в - кубічна об’ємноцентрована
Хімічні властивості металів. В хімічних процесах атоми металів можуть тільки віддавати електрони, виконуючи відновлювальну функцію: Meo – nе → Men+
Метали як відновники, взаємодіють з окисниками: неметалами (киснем, галогенами, сіркою, азотом, фосфором), водою, кислотами, солями, інколи лугами. Лужні та лужноземельні метали взаємодіють також з воднем:

Відновлювальна здатність різних металів не однакова. Для реакцій в водних розчинах вона визначається положенням металу в електрохімічному ряді напруг (величиною електродного потенціалу).
При зануренні металічної пластинки у розчин, який має однойменні іони металу, на межі поділу метал – розчин встановлюється рівновага
![]() ,
,
виникає подвійний електричний шар, різниця потенціалів в якому і називається електродним потенціалом. Абсолютне значення електродного потенціалу виміряти експериментально або розрахувати теоретично неможливо, тому визначають його відносну величину за допомогою електрода порівняння (водневого, каломельного тощо) чи обчислюють за рівнянням Нернста:
![]() (1)
(1)
де
![]() - стандартне значення електродного
потенціалу (при [Men+]=1
моль/л); [Men+]
– концентрація іонів металу, моль/л; n
– число електронів, що беруть участь в
електродному процесі (наприклад, для
процесу Fe2++2e-=Fe
n=2;
для процесу Fe3++e-=Fe2+
n=1);
R
–
універсальна газова стала;
T –
абсолютна температура;
F
–
число Фарадея.
- стандартне значення електродного
потенціалу (при [Men+]=1
моль/л); [Men+]
– концентрація іонів металу, моль/л; n
– число електронів, що беруть участь в
електродному процесі (наприклад, для
процесу Fe2++2e-=Fe
n=2;
для процесу Fe3++e-=Fe2+
n=1);
R
–
універсальна газова стала;
T –
абсолютна температура;
F
–
число Фарадея.
Для
водневого електрода
![]() (прийнято
в якості міжнародного стандарту).
Підставивши в рівняння (1) значення
сталихR,
F
і перейшовши до десяткових логарифмів
одержимо (для Т=298
К):
(прийнято
в якості міжнародного стандарту).
Підставивши в рівняння (1) значення
сталихR,
F
і перейшовши до десяткових логарифмів
одержимо (для Т=298
К):
![]() (2)
(2)
Концентрація іонів металу обчислюється за рівнянням:
[Men+]=С∙ z∙
де С – молярна концентрація розчину; z - число іонів металу, що утворюються із однієї молекули електроліту; - ступінь дисоціації, в частках одиниці.
Значення стандартних електродних потенціалів відносно водневого електрода визначені при 298 К (25ºС) і зведені в таблиці електродних потенціалів (див. Додаток, с.22). Для будь-якої іншої концентрації електроліту електродний потенціал розраховується за рівняннями (1),(2).
Приклад
1.
Обчислити потенціал мідного електрода,
якщо концентрація CuSO4
– 0,5 моль/л (![]() .
.
Розв’язання.
Для електродної реакції Cu2++2е-=![]() .
.
Концентрація іонів металу [Cu2+]=0,5 моль/л. Тому
![]() В.
В.
Розмістивши метали у порядку зростання значень їхніх стандартних електродних потенціалів (Додаток, с.22), одержують ряд стандартних електродних потенціалів (електрохімічний ряд напруг металів):
Li, Rb, К, Ва, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb,
H2,
Bi, Cu, Hg, Ag, Pd, Pt, Au
Електрохімічний ряд напруг характеризує властивості металів у водних розчинах:
Чим меншим є електродний потенціал металу, тим легше він окиснюється і тим важче відновлюються його катіони у водних розчинах.
Метали, що мають негативні значення електродного потенціалу, тобто стоять у ряду напруг до водню, здатні витісняти його із розведених розчинів кислот (HCl. H2SO4(розб.), СH3COOH, H3PO4) .
Кожен метал здатний витісняти (відновлювати) з розчинів солей ті метали, які мають більш високе значення електродного потенціалу.
Активні метали взаємодіють з водою за кімнатної температури, метали середньої активності — при нагріванні, малоактивні метали (Cu, Ag, Au, Pt) з водою не взаємодіють.
|
K, Ca, Na, Mg, Al, Mn, Zn, Fe, Ті |
Cu, Hg, Ag, Pt, Au | |
|
Витісняють водень Ео(Меn+/Me) < -0,41В |
Не взаємодіють | |
|
За звичайної температури |
За високих температур | |
2Na + 2H2O → 2NaOH + H2
Zn
+ H2O
![]()
![]() ZnO
+ H2
ZnO
+ H2
Метали взаємодіють з кислотами з утворенням солей, але в залежності від активності металу, природи та концентрації кислоти продукти відновлення кислоти можуть бути різними.
Метали, що стоять у ряді напруг до водню (крім свинцю), витісняють останній із таких кислот, як H3PO4, HCN, CH3COOH, HCl, HBr, HI, H2SO4(розб.) за загальною схемою
|
K, Na, Mg, Al, Mn, Zn, Fe, Ni, Sn |
Pb, Cu, Hg, Ag, Pt, Au |
|
H2+сіль |
Не взаємодіють |
Zn+2HCl=ZnCl2+ H2
Mg + H2SO4(розб.) = MgSO4 + H2
Свинець не взаємодіє з галогеноводневими кислотами і H2SO4(розб.) тому, що на поверхні металу утворюються нерозчинні плівки: PbCl2, PbBr2,. PbI2, PbSO4.
Із концентрованою H2SO4 метали взаємодіють за схемою:
|
K, Na, Mg, |
Al |
Mn, Zn |
Fe |
Ni, Sn, Pb, Cu, Ag |
Pt, Au |
|
H2S+сіль+H2O |
|
S+сіль + +H2O |
|
SО2+сіль+H2O |
Не взаємо-діють |
4Mg+5H2SO4® 4MgSO4+H2S+4H2O
3Zn+4H2SO4® 3ZnSO4+S+4H2O
Pb+3H2SO4®Pb(НSO4)2+SО2+2H2O
Алюміній і залізо за звичайних умов не взаємодіють із концентрованою сульфатною кислотою, тому що на поверхні цих металів утворюються щільні оксидні плівки Al2O3, Fe2O3.
При сильному нагріванні алюміній і залізо взаємодіють із концентрованою H2SO4 за схемою:
2Fe+6H2SO4®Fe2(SO4)3+3SО2+6H2O
2Al+4H2SO4®Al2(SO4)3+S+4H2O
Розглядаючи взаємодію металів з нітратною кислотою необхідно пам’ятати:
в даному випадку окисником є нітрат-іон за рахунок Нітрогену в ступені окиснення +5;
Нітроген відновлюється до різних ступенів окиснення (від +4 до –3);
чим активнішим є метал і чим розбавленішою є кислота, тим повніше йде відновлення Нітрогену.
Процеси, що при цьому протікають і продукти відновлення Нітрогену можна представити такою схемою:
|
Процес |
|
|
|
|
Продукт |
NO2 |
|
NO |
|
Процес |
|
|
|
|
Продукт |
N2O |
N2 |
NH3 NH4NO3 |
Ag + 2HNO3(конц) –> AgNO3 + NO2 + H2O
3Ag + 4HNO3(розб) –> 3AgNO3 + NO + 2H2O
4Zn + 10HNO3(розб) –> 4Zn(NO3)2 + NH4NO3 + 3H2O
Деякі метали (Zn. Be, Al, Cr, Pb, Sn, Sb), що утворюють амфотерні гідроксиди, розчиняються в водних розчинах лугів, або взаємодіють з лугами при сплавлянні:
в розчинах
Zn+2NaOH+2H2O=Na2[Zn(OH)4]+H2
2Al+6NaOH+6H2O=2Na3[Al(OH)6]+3H2
при сплавленні
2NaOH+ Zn=Na2ZnO2+H2
6NaOH+2 Al=2Na3AlO3+3H2
Метали взаємодіють з розчинами солей менш активних металів:
Zn+CuSO4 → ZnSO4 + Cu.
Активні метали ( Mg, Al, Na ) взаємодіють з оксидами металів:
![]()
Алюміній широко використовують у промисловості для добування багатьох металів з їхніх оксидів (алюмінотермія).
Сплави. У розплавлених металах можуть розчинятися інші метали, складні речовини та неметали. Під час охолодження таких розчинів утворюються сплави. Сплави, як і метали, у твердому стані мають кристалічну будову. Під час кристалізації деяких сплавів утворюються хімічні сполуки. Кристали інших сплавів складаються з атомів вихідних металів, які хімічно не зв'язані один з одним (тверді розчини).
У світі для потреб техніки виробляється 75 металів і близько 1500 різних сплавів. Наприклад, чавун — це залізовуглецевий сплав, у якому масова частка вуглецю понад 2.14%. Сталь — залізовуглецевий сплав з масовою часткою вуглецю меншою за 2.14%. Дюралюміній містить 95% Al, 4%Cu, 0.5%Mg і 0.5%Мn.
Властивості сплавів відрізняються від властивостей компонентів сплаву. Температура плавлення сплаву, як правило, нижча за температуру плавлення найбільш легкоплавкого його компонента, а твердість вища, ніж твердість складових частин сплаву. Особливо сильно зростає твердість сплаву, якщо під час сплавлення утворюються хімічні сполуки металів. Високою твердістю характеризуються сплави, що містять тверді розчини. Низькі температури плавлення, висока твердість надають сплавам більшої цінності для сучасної техніки, ніж цінність металів, з яких їх виготовляють.
Поширення у природі й одержання металів. У земних умовах більшість металів є стійкими в окисленому вигляді. У вільному стані в земній корі трапляються лише метали, які в ряду стандартних електродних потенціалів знаходяться праворуч від водню - Cu, Hg, Ag, Аu, Pt Переважно в природі метали існують у вигляді сполук — оксидів, сульфідів, сульфатів, хлоридів, карбонатів, фосфатів і нітратів.
Усі промислові способи одержання металів основані на окисно-відновних реакціях. У процесі добування металів їх переводять з хімічних сполук у нейтральні атоми.
В залежності від умов ведення процесів розрізняють піро-, гідро- та електрометалургійні способи добування металів.
Пірометалургія об'єднує хімічні способи відновлення металів їх сполук за високих температур. Для відновлення використовую вугілля, точніше, кокс - найбільш доступний та економічно вигідний відновник, оксид карбону(ІІ), водень, активні метали.
Гідрометалургія - вилучення металів з їх сполук у водних розчинах та збагачення руд різних металів із застосуванням води. Гідрометалургійні прийоми широко застосовують при добуванні золота, срібла, індію, кадмію, урану та багатьох інших металів. Наприклад:
CdSO4 + Zn = ZnSO4 + Cd.
Електрометалургія - добування металів за допомогою електричнoго струму (електролізом). Самі активні метали - від літію до мангану - добувають електролізом розплавів (електротермія), менш активні метали Zn, Ni, Cr, Sn, Cu та ін. - електролізом водних розчинів їх солей (гідроелектрометалургія). Електроліз застосовують також для нанесення декоративних і захисних металічних покриттів, для очищення (рафінування) багатьох металів від домішок тощо
