
Хімія / Общая химия конслек Модуль 1_
.pdfтвердих тіл менша від ентропії рідини, тому що тверді тіла мають більш упорядковану структуру, ніж рідина, тобто
Sгазу>Sрідини >Sтвердого тіла
Таким чином, при конденсації і кристалізації ентропія речовин зменшується. Навпаки, ентропія зростає при перетворенні твердих речовин у рідину, рідин у газ, а також при розчиненні. В той самий час ентропія зменшується при розчиненні газів у рідинах.
Отже перехід системи з більш упорядкованого в менш упорядкований стан супроводжується збільшенням ентропії. Чим більша ентропія, тим більш невпорядкована система. Рівноважний стан характеризується максимальною невпорядкованістю і найбільшим значенням ентропії.
Приклад. Для наведених нижче систем визначити якісно, як буде змінюватися ентропія при проходженні у них реакцій (Т=const).
1)2КСlO3=2KCl+3O2(г) ; 2) C+O2(г)=CO2(г) ; 3) 2H2(г)+O2(г)=2H2O.
Розв’язання. У першому випадку ентропія зростає, тому що збільшується об’єм системи за рахунок виділення газу – кисню.
Третій закон термодинаміки – закон про абсолютне значення ентропії. Він формулюється так: ентропія будь-якої індивідуальної бездефектної кристалічної речовини (ідеального кристалу) при абсолютному нулю дорівнює нулю.
Визначені на підставі цього закону ентропії хімічних речовин за стандартних умов (298 К, р=101,3 кПа) зведені в таблиці термодина-
мічних величин і позначені S298 .
Зміна ентропії Sº для перебігу хімічної реакції розраховується за тим самим принципом, що й зміна ентальпії хімічної реакції, тобто зміна ентропії реакції дорівнює різниці сум ентропій усіх продуктів
реакції і сум ентропій усіх вихідних речовин. Так, для |
реакції(5.3) |
Sx.p. (cSC dSD ) (aSA âSÂ ) |
(5.5) |
Приклад. За даними термодинамічних величин визначити зміну ентропії системи, в якій проходить така хімічна реакція:
Н2(г)+1/2О2(г)=Н2О(рід)
Розв’язання. Із таблиць термодинамічних величин знаходимо:
SH |
O |
ð³ä |
=70,1Дж/(моль·К); SH =130,5 Дж/(моль·К); |
SO =205 Дж/(моль·К); |
|||||||
2 |
|
|
|
|
|
|
|
|
2 |
2 |
|
Sx.p. |
SH |
|
O SH |
|
|
1 |
SO |
=70,1-130,5-102,5=-161,9 Дж/(моль·К). |
|||
|
|
|
|||||||||
|
|
|
|
2 |
|
2 |
2 |
|
2 |
|
|
71
Візольованій системі можливе проходження тільки таких процесів, які супроводжуються збільшенням ентропії.
Внеізольованих системах крім ентропійного необхідно враховувати і ентальпійний чинник. Для визначення напрямку перебігу хімічної реакції впроваджені термодинамічні величини, що називаються енергією Гіббса (за P і T = const), позначається G; або енергією Гельмгольця (за V і T=const), позначається F. Зміна енергії Гіббса визнача-
ється за формулою:
ΔG=ΔH-TΔS,
де ΔH, ΔS, - зміна відповідно ентальпії і ентропії реакції.
Якщо ΔG<0, то реакція може самовільно проходити в прямому напрямку. Якщо ΔG>0, перебіг прямої реакції неможливий. При ΔG=0 система перебуває в стані хімічної рівноваги.
Реакції горіння та інші, в яких Н<0 і ΔS>0, можливі без будь-яких обмежень. Екзотермічні реакції Н<0, що проходять із зменшенням ентропії ΔS<0, можливі при досить низьких температурах, для яких ТΔS менше за Н за абсолютною величиною.
Отже, за низьких температур самочинно можуть відбуватися екзотермічні реакції, а за високих - реакції, що супроводжуються збільшенням ентропії. За проміжних температур на знак і величину ΔG одночасно впливають як ентальпійні, так і ентропійні фактори (див. табл.).
Ентальпійний |
Ентропійний |
ЗмінаенергіїГіббса |
Темпера- |
Процес |
|
чинник |
чинник |
|
тура |
|
|
|
|
|
|
|
|
Н<0 |
ΔS >0 |
длякожногозначення |
довільна |
самочинний – відбувається |
|
|
|
Ні ΔS |
|
внаслідок зміни |
ентропії та |
|
|
ΔG<0 |
|
ентальпії |
|
Н<0 |
ΔS <0 |
Н >TΔS ;ΔG <0 |
низька |
самочинний - |
зумовлений |
|
|
|
|
виключнозміною ентальпії; |
|
|
|
ΔG >0 |
висока |
несамочинний |
|
|
|
|
|
|
|
Н>0 |
ΔS >0 |
ΔG >0 |
низька |
несамочинний |
|
|
|
Н <TΔS |
висока |
самочинний - зумовлений |
|
|
|
ΔG<0 |
|
виключнозміноюентропії |
|
|
|
|
|
|
|
Н>0 |
ΔS <0 |
ΔG >0 |
довільна |
несамочинний |
|
|
|
|
|
|
|
5.4.Питання для самоконтролю
1.Який зв'язок існує між внутрішньою енергією та ентальпією системи?
2.Яким чином робота газу, що розширюється, пов'язана з тиском, об'- ємом і температурою?
3.Чим відрізняються функції стану від інших функцій? У чому полягають зручності користування ними?
72
4.Чи належать тепло та робота до функцій стану?
5.У чому полягає перший закон термодинаміки, які функції стану згадуються в ньому?
6.Тепловий ефект реакції можна виразити через величини ΔU і Н. У чому різниця між ними? Написати рівняння зв'язку ΔU і Н.
7.Чим термохімічні рівняння відрізняються від хімічних?
8.Який зміст законів термохімії?
9.Чому закон Гесса є законом збереження енергії стосовно хімічних процесів?
10.Що являє собою стандартна теплота (ентальпія) утворення сполу-
ки?
11.Дати визначення понять: ентальпії розчинення, згоряння, нейтралізації.
12.Чому ентальпія нейтралізації всіх сильних кислот і основ однакова (-55,8 кДж/моль), а слабких кислот і основ — залежить від їхньої природи?
13.Який зміст другого закону термодинаміки.
14.Охарактеризуйте фактори, що впливають на перебіг хімічних реакцій.
5.5.Задачі і вправи для самостійної роботи
1.Стандартна теплота утворення рідкої води становить — 286 кДж/моль. Записати термохімічні рівняння цієї реакції з використанням теплового ефекту та ентальпії. Поглинається чи виділяється в реакції теплота? Чому дорівнює молярна теплота згоряння газуватого водню?
2.Обчислити стандартну ентальпію утворення бензолу, якщо теплота його згоряння становить 3169 кДж/моль, а ентальпія утворення вуглекислого газу та водяної пари відповідно -393 і -242 кДж/моль.
3.За стандартних умов теплота повного бромування білого фосфору дорівнює 229,1 кДж/моль, а теплота бромування червоного фосфору дорівнює 212,3 кДж/моль. Чому дорівнює теплота перетворення червоного фосфору в білий за стандартних умов?
4.Теплота згоряння ромбічної сірки дорівнює -296,8 кДж/моль. Розрахуйте: а) кількість теплоти, яка виділиться в результаті згоряння 64 г ромбічної сірки; б) об'єм кисню (н.у.), який витратиться в ході горіння сірки, якщо в результаті реакції виділяється 59,36 кДж теплоти.
5.Термохімічне рівняння реакції горіння метану:
73
СН4+2О2=СО2+2Н2О+878 кДж.
Скільки теплоти виділиться, якщо згорить 4,48 л (н. у.) метану? 6.Відновлення Fе3О4 оксидом карбону протікає за рівнянням
Fе3О4 (к)+СО(г) = 3FеО(к) + СО2(г)
Розрахуйте G298o і зробіть висновок про можливість самочинного протікання цієї реакції за стандартних умов. Чому дорівнює S298o в
цьому процесі?
7.Розрахуйте тепловий ефект реакції відновлення оксиду заліза(II) воднем, виходячи з наступних термохімічних рівнянь: FеО(к)+СO(г)=Fе(к)+СО2(г); ΔH=-13,18 кДж
СО (г) + 1/2О2(г) = СО2 (г); ΔH= -283,0 кДж H2 (г) + 1/2О2(г) = H2O(г); Н= -241,83 кДж
8.Визначте роботу при ізотермічному стисненні одного кіломоля CO2 при Т=298 К від тиску p1= 104 Н/м2 до p2= 105 Н/м2.
9.Використовуючи прийом алгебраїчного додавання термохімічних рівнянь, визначити Но утворення етилену за наступними експериме-
нтальними даними:
С2Н4 + 3О2 = 2СО2 + 2Н2О; Н1о = -1323,0 кДж;
С + О2 = СО2 ; Н2о = -392,5 кДж; Н2 + 1/2О2 = 2Н2О; Н3о = -241,5 кДж.
10.Записати аналітичний вираз залежності теплового ефекту реакції: СН3ОН(г) + 3/2О2 =СО2 + 2Н2О(г)
від температури та визначити Н цієї реакції при 700 К, використовуючи наступні дані:
Речовина |
Но·106,Дж/кмоль |
Сp·10-3,Дж/(кмоль·К) |
СО2 |
-393,5 |
31,1 |
Н2О |
-241,8 |
33,6 |
СН3ОН(г) |
-201,2 |
43,9 |
О2 |
0 |
29,4 |
74
6.Хімічна кінетика і рівновага
6.1. Загальні уявлення про швидкість хімічних реакцій
Розділ хімії, який вивчає перебіг хімічних процесів за певний час, має назву хімічної кінетики.
Дослідження кінетики хімічних процесів має не тільки теоретичний, а й практичний інтерес. Необхідність врахування кінетичного фактора при розгляданні хімічних реакцій можна побачити на прикладі взаємодії кисню і водню. Незважаючи на
те що реакція: 2Н2(г) + О2(г) = 2Н2О(г), Gо |
= - 456,4 кДж |
298 |
|
характеризується значним зменшенням ізобарного потенціалу, тобто є можливість самовільного перебігу процесу, за звичайних умов водень і кисень між собою не реагують, а їхня суміш може зберігатись будь-який час. При наявності каталізатора
або при нагріванні до 700о С ( G1000о = — 495,3 кДж) суміш реагує дуже швидко або навіть з вибухом. В обох випадках ізобарний потенціал системи майже однаковий, а кінетичні особливості різні.
Розглядаючи питання хімічної кінетики, треба розрізняти гомогенні і гетерогенні реакції. Хімічні реакції, які відбуваються в гомогенній системі, називаються гомогенними. Гомогенна система складається лише з однієї фази (газова фаза, рідкий розчин). Гетерогенні реакції відбуваються в неоднорідному середовищі між речовинами, які перебувають у різних фазах (газ і рідина, кристал і рідина тощо). Якщо гомогенні реакції відбуваються у всьому об'ємі системи, то перебіг гетерогенних реакцій можливий лише на поверхні поділу фаз.
Швидкість хімічних реакцій характеризує інтенсивність хімічного процесу, тобто число елементарних актів взаємодії або розкладання за одиницю часу в одиниці об'єму (для гомогенних реакцій) або на одиницю поверхні поділу фаз (для гетерогенних реакцій).
Для гомогенних процесів, що відбуваються без зміни об'єму, швидкість хімічної реакції визначають як зміну концентрацій реагуючих речовин або продуктів реакції за одиницю часу.
Зміна концентрацій дорівнює різниці між концентрацією С2, що відповідає моменту часу τ2, і початковою концентрацією С1 в момент часу τ1. Тоді середня швидкість реакції дорівнює:
v |
C |
|
C2 |
C1 |
(6.1) |
|
|
2 |
1 |
||||
|
|
|
Чим менший проміжок часу ∆τ, тим менша зміна концентрації ∆С і тим ближче відношення ∆С/∆τ до істинної швидкості хімічної реакції. Відомо, що концентрації речовин у хімічному процесі змінюються безперервно (рис.6.1), тому правильніше описувати хімічний процес у певний момент часу за допомогою істинної швидкості реакції. Точний математичний вираз істинної швидкості реакції є перша похідна від
концентрації за часом: |
v |
dC |
(6.2) |
|
d |
||||
|
|
|
75

Оскільки швидкість хімічних реакцій завжди додатна і характеризується зміною концентрацій реагуючих речовин (С2 < С1), то величина ∆С (dC) буде від'ємна і відношення ∆С/∆τ (dC/dτ) у формулах (6.1), (6.2) треба брати із знаком «мінус». Якщо швидкість реакції визначають за зміною концентрації одного з продуктів реакцій (див. рис.6 1), то величина ∆С (dC)додатна і відношення ∆С/∆τ (dC/dτ) у формулах (6.1), (6.2) треба брати із знаком «плюс». Швидкість хімічних реакцій,
а |
б |
Рис. 6.1. Зміна концентрацій С реагуючих речовин (а) та продуктів (б)
як правило, вимірюють у моль/(см3∙хв). Істинна швидкість реакцій дорівнює тангенсу кута нахилу дотичної до кривої залежності концентрації від часу (див. рис. 6.1):
v = tg α.
Швидкість хімічних реакцій залежить від природи реагуючих речовин, їх концентрацій, температури, наявності каталізатора і деяких інших зовнішніх факторів.
6.2. Закон діючих мас
Необхідною умовою перебігу хімічної реакції між двома речовинами є зіткнення їхніх молекул. Зрозуміло, що швидкість хімічної реакції залежить від числа таких зіткнень в одиниці об'єму. Вірогідність зіткнення взаємодіючих молекул для гомогенної реакції пропорційна концентраціям реагуючих речовин.
Отже. швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин у степенях, які дорівнюють коефіцієнтам, що стоять перед формулами речовин у відповідному рівнянні реакції. Ця закономірність має назву за-
кону діючих мас, відкритого російським ученим М.М.Бекетовим і норвезькими вченими К. Гульдбергом і П. Вааге.
Для взаємодії двох молекул, наприклад водню і йоду за рівнянням
Н2+I2=2НI,
в елементарному акті якої беруть участь по одній молекулі, закон діючих мас у математичній формі має вираз:
76
v kCH2 CI2
Для реакції
2NO + Сl2 = 2NOCl
швидкість дорівнює:
v kC |
2 |
C |
Cl2 |
|
NO |
|
|
Для загальної реакції |
|
|
|
аА + bB = dD +eE |
|||
швидкість дорівнює: |
|
|
|
v kCAaCBb |
(6.3) |
||
Величина k у рівнянні (6.3) є коефіцієнтом пропорційності між швидкістю і концентрацією і називається константою швидкості реакції. Вона чисельно дорівнює швидкості реакції, якщо концентрація відповідних речовин дорівнює одиниці. Константа швидкості при сталій температурі є величина стала і характеризує природу реагуючих речовин.
Для більшості хімічних реакцій сумарне стехіометричне рівняння не відображає дійсного механізму процесу (проміжних стадій), а є загальним виразом для вихідних речовин і продуктів реакції. При цьому показники степенів у законі діючих мас не дорівнюють стехіометричним коефіцієнтам і мають формальний характер.
Розглянемо приклад. Фотохімічне розкладання газоподібного НВг відбувається за стехіометричним рівнянням
2НВг(г) = Н2(г) + Вг2(г).
Відомо, що в механізмі цієї реакції немає стадії взаємодії двох молекул НВг. Насправді зазначена фотохімічна реакція відбувається за таким механізмом:
НВг + hv = Н + Вг; Н + НВг = Н2 + Вг;
Вг + Вг = Вг2.
Отже, ніякого зв'язку між стехіометрією рівняння і механізмом реакції, як і між стехіометричними коефіцієнтами і показниками степенів у кінетичному рівнянні, взагалі немає. Збіг, який спостерігається для деяких реакцій, має випадковий характер. Перебіг більшості хімічних реакцій такий, що утворення продуктів відбувається через ряд проміжних елементарних стадій (послідовних або паралельних), які можна вважати елементарними реакціями.
Зрозуміло, що швидкість реакції, яка складається з кількох елементарних стадій, зумовлюється швидкістю перебігу повільнішої з них. Сума показників степенів у рівнянні швидкості хімічної реакції (кінетичне рівняння) (6.3) є важливою характеристикою механізму процесу і називається порядком хімічної реакції. Якщо порядок реакції нульовий (швидкість не залежить від концентрації реагуючих речовин),
то v = const.
Швидкість реакції першого порядку описують кінетичним рівнянням v =kC.
77
Прикладом реакцій першого порядку є розкладання оксиду азоту(V): N205 = 2NO2 + 1/2O2
Для реакцій другого порядку кінетичне рівняння має вигляд v = kC2; v = kC1С2.
Прикладом реакцій другого порядку є взаємодія водню і йоду за рівнянням Н2+ I2 = 2НI
Для характеристики механізму реакцій застосовують також поняття молекулярності реакції. Під молекулярністю реакції розуміють кількість молекул, які беруть участь в елементарному акті взаємодії.
Реакція, для перебігу якої потрібна лише одна молекула, називається мономолекулярною реакцією. Це — реакція розкладання або перегрупування, наприклад:
I2 = 2I,
НВг = Н + Вг;
N205 = 2NO2 + 1/2O2
Бімолекулярна реакція потребує для елементарного акту двох частинок (молекул, іонів, атомів):
Н2+ I2 = 2НI
У тримолекулярних реакціях беруть участь одночасно три молекули (ці реакції відбуваються дуже рідко):
2NO + О2 = 2NO2.
Реакцій, молекулярність яких більше ніж три, не буває, оскільки одночасне зіткнення в одній точці чотирьох і більше молекул маловірогідне. Фактично всі елементарні хімічні реакції, крім сумарних, є мономолекулярними або бімолекулярними, тобто всі реальні хімічні реакції дуже прості, незважаючи іноді на складність сумарних стехіометричних рівнянь. Отже, сумарна форма рівняння хімічної реакції не виражає складності і багатостадійності процесу, який може складатися з кількох елементарних реакцій різного порядку.
6.3. Енергія активації
Як зазначалось, умовою елементарного акту взаємодії є зіткнення частинок реагуючих речовин. Проте не кожне зіткнення може спричинити хімічну взаємодію. Справді, хімічна взаємодія передбачає перерозподіл електронної густини, утворення нових хімічних зв'язків і перегрупування атомів. Отже, крім зіткнення, для взаємодії частинок необхідно, щоб їх енергія була більшою за енергію відштовхування (енергетичний бар'єр) між їхніми електронними оболонками.
Частина молекул у системі внаслідок перерозподілу енергії завжди має певний надмір енергії порівняно з середньою енергією молекул. Тому вони можуть подолати енергетичний бар'єр і вступити в хімічну взаємодію. Такі реакційнодатні молекули дістали назву активних молекул. Різниця між середньою енергією системи і енергією, необхідною для перебігу реакції, називається енергією активації реакції. Вона потрібна для подолання енергетичного бap'єру.
Наявність енергетичного бар'єру призводить до того, що багато які реакції, перебіг яких цілком можливий, самовільно не починаються. Наприклад, вугілля, дере-
78
во, нафта, які здатні окислюватись і горіти на повітрі, за звичайних умов не займаються. Це пов’язано з великою енергією активації відповідних реакцій окислення. Підвищення температури збільшує кількість активних молекул і тому дедалі більша кількість молекул кисню, вугілля, дерева і нафти має необхідний запас енергії для початку реакції. При певній температурі швидкість реакції досягає певної величини і починається реакція горіння. Отже, під час хімічного процесу перехід системи вихідних речовин з енергетичним станом Евих у енергетичний стан продуктів реакції Епр здійснюється через енергетичний бар'єр, який дорівнює енергії активації системи Еакт. При цьому тепловий ефект реакції дорівнює
∆H = Eпр - Евих
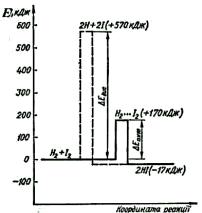
На рис.6.2 наведено енергетичну схему взаємодії водню і йоду. Характерною особливістю цієї реакції є те, що під час взаємодії активних молекул водню і йоду спочатку утворюється проміжна сполука Н2 • • • І2, яка називається активним комплек-
сом. Саме в цьому комплексі відбувається розрив зв'язків Н—Н і І—І і утворення нових зв'язків Н—І.
Як видно з рис.6.2, енергія активації реакції ∆Еакт менша за енергію дисоціації ∆Едис вихідних молекул на вільні атоми. Таким чином, перебіг реакції через проміжний активний комплекс енергетично вигідніший, ніж перебіг реакції через повний розрив зв'язків вихідних молекул і утворення вільних атомів. Більшість хімічних реакцій відбувається через стадію утворення проміжних активних комплексів, а енер-
гія їх утворення є енергією активації реакції. Енергія активації ∆Еакт — важлива характе-
ристика хімічних перетворень. Саме енергія активації затримує або робить неможливими багато які реакції, які з погляду термо-
динаміки можуть відбуватися самовільно. Якби енергія активації для всіх реакцій дорівнювала нулю (∆Еакт = 0), то в природі відбувалося б безліч хаотичних хімічних реакцій, для яких величина ∆G від'ємна. Так, вугілля і нафта при контакті з повітрям загорілися б, азот повітря і вода утворили б розчин азотної кислоти, живі клітини зруйнувалися б внаслідок гідролізу.
Отже, існування багатьох молекул, кристалічних речовин і навіть живих клітин можливе лише тому, що їхні перетворення і руйнування пов'язані з подоланням значного енергетичного бар'єру.
6.4. Вплив температури на швидкість реакції
Підвищення температури реагуючих речовин внаслідок збільшення швидкості молекул приводить до зростання загальної енергії системи і відповідно до збільшення відносного вмісту активних молекул, що рівнозначно зростанню швидкості
79

хімічної реакції. Вплив температури і енергії активації на швидкість хімічних реакцій можна виразити за допомогою залежності константи швидкості реакції k від температури Т і ∆Еакт:
Eакт |
|
k Ae RT , |
(6.4) |
де А — множник Арреніуса, пропорційний числу зіткнень молекул.
Якщо концентрації реагуючих речовин дорівнюють 1 моль/л, то рівняння Арреніуса (6.4) дає змогу виразити залежність швидкості реакцій від температури:
Eàêò |
|
v Ae RT |
(6.5) |
Оскільки в рівнянні (6.5) температура входить у показник степені, то швидкість хімічних реакцій дуже залежить від зміни температури.
Експериментально встановлено, що залежність швидкості хімічної реакції від температури можна виразити у вигляді емпіричного правила Вант-Гоффа: підви-
щення температури на кожні 10 градусів збільшує швидкість реакції приблизно
в2—4 рази.
Уматематичній формі правило Вант-Гоффа записується так:
t
v |
2 |
v 10 |
(6.6) |
|
1 |
|
де ∆to— збільшення температури; v1 — швидкість реакції до підвищення температури; v2— швидкість реакції після підвищення температури (при температурі t2); γ— температурний коефіцієнт швидкості реакції (γ == 2—4).
Рівняння (6.6) є приблизним, тому що швидкість реакції крім температури залежить також від енергії активації ∆Еакт, яка, в свою чергу, залежить від температури.
6.5. Каталіз
Швидкість хімічних процесів можна значно збільшити завдяки введенню у реакційну систему певних речовин, які називаються каталізаторами. Каталізатор — це речовина, що збільшує швидкість реакції, кількісно і якісно при цьому не змінюючись.
Речовини, які уповільнюють швидкість хімічних процесів, а самі при цьому не змінюються, називаються інгібіторами.
З наведеного визначення може здатись, що каталізатор не бере участі в хімічній взаємодії речовин. Експериментально доведено, що каталізатор тільки кількісно не змінюється під час реакції, але бере участь у проміжних стадіях хімічної взаємодії і саме завдяки ньому збільшує. швидкість хімічних реакцій.
Механізм дії каталізаторів різний. Найпоширенішою формою дії каталізатора є утворення проміжних сполук з реагуючими речовинами. Зміна швидкості при цьому пояснюється зменшенням енергії активації. Розглянемо механізм дії каталізатора з погляду утворення проміжних сполук на прикладі взаємодії речовин А і В з утворенням сполуки АВ. Нехай сполука утворюється через активний комплекс А---В, енергія активації якого ∆Еакт:
80
