
Хімія / Общая химия конслек Модуль 1_
.pdfВсі амфотерні гідроксиди металів нерозчинні у воді. Тому добувають їх з відповідних солей, витискуючи лугами. Але розчин лугу треба додавати обережно, невеликими порціями, бо осад гідроксиду, що утворюється, може розчинитися в надлишку лугу:
SnCl4 + 4NaOH=4NaCl + Sn(OH)4↓
Sn(OH)4+ 2NaOH= Na2[Sn(OH)6]
При нагріванні амфотерні гідроксиди втрачають воду і перетворюються на відповідні амфотерні оксиди. Ця реакція - необоротна.
2.2.3. Кислоти
За теорією електролітичної дисоціації Арреніуса кислоти - це сполуки, що складаються з кислотного залишку і йонів гідрогену, здатних заміщуватись на метал (у розчині дисоціюють з утворенням катіонів тільки гідрогену). Кількість таких йонів гідрогену визначає основність кислоти: НС1, HNO3 – одноосновні, H2SO4, H2CO3 - двоосновні, Н3РО4- триосновна і т.д. Кислоти, до складу яких входять атоми оксигену, називають кисневими, якщо атоми оксигену відсутні - без-
кисневими.
Назви безкисневих кислот походять від назв елементів, що їх утворюють, або від міжнародних назв кислотних залишків з закінченням -на: НС1 - хлороводнева або хлоридна (тривіальна назва - соляна), H2S - сірководнева або сульфідна, HF - флуороводнева або фторидна (тривіальна назва - плавикова).
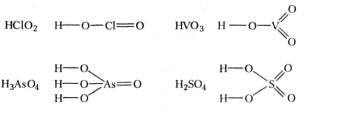
Згідно з правилами IUPAC назви кисневих кислот також походять під міжнародних назв відповідних кислотних залишків з додаванням закінчення -на: НС1О4 - хлоратна; H2SO4 -сульфатна; H2SO3 - сульфітна; HNO3, -нітратна; HNO2 -нітритна і т.д. Однак в хімічній літературі та побуті на сьогоднішній день ще досить часто зустрічаються загальновживані раніше назви кисневих кислот. Основу цих назв складають найменування центрального атома - елемента, навкруг якого розміщені атоми оксигену і гідрогену. Причому, якщо ступінь окиснення цього елемента відповідає номеру групи, в якій він знаходиться, назва кислоти має закінчення -на (-ва), якщо ступінь окиснення менший від номера групи, закінчення -иста.
7 |
6 |
5 |
H ClO4 - хлорна |
H2 S O4- сірчана |
H V O3 - ванадієва |
21
3 |
4 |
3 |
H ClO2 - хлориста |
H2 S O3 - сірчиста |
H N O2 - азотиста |
Але є кислоти, утворені одним і тим же елементом з однаковим ступенем окиснення, але до їх складу входить різна кількість атомів гідрогену і оксигену. Тоді там, де цих атомів менше, до назви кислоти додають префікс "мета", а де найбільше - "орто": H2SiO3 - метасилікатна (метакремнієва), H4SiO4 - ортосилікатна (ортокремнієва).
В графічних формулах безкисневих кислот атоми гідрогену зв'я- зані безпосередньо з атомом елемента, який утворив кислоту: Н-С1, H-S-H, H-F, а в кисневих кислотах атоми гідрогену, що визначають основність кислоти, сполучають з атомами оксигену, які в свою чергу з'єднують з центральним атомом:
Хімічні властивості кислот зумовлені йонами гідрогену (точніше - гідроксонію Н3О+), що утворюються при розчиненні й дисоціації кислот у воді. Ці ж йони зумовлюють кислий смак розчину і забарвлення індикатора в характерний колір. Оскільки атоми гідрогену зв'язані з кислотним залишком досить міцним ковалентним зв'язком, на йони дисоціюють не всі молекули кислоти, а процес дисоціації - оборотний.
При взаємодії кислот з основами та оксидами (основними й амфотерними) обов'язковими продуктами реакцій є сіль і вода. Кислоти взаємодіють також з солями. Такі реакції протікають з утворенням малорозчинних або летких продуктів, а також коли більш сильна кислота витискує більш слабку:
H2S + Pb(NO3)2 = 2HNO3 + PbS↓ 2HNO3 + СаСО3 = Са(NO3)2 + Н2О+СО2↑ HCl + CH3COONa= NaCl+CH3COOH
Важливою властивістю кислот є їх взаємодія з металами. Характер взаємодії залежить від активності металу і температури, а для де-
22
яких кислот – визначається їх особливою окисною функцією. Активні метали, що в ряді стандартних електродних потенціалів стоять до водню, витискують його з кислот:
2A1 + 3H2S04 = A12(S04)3 + 3H2↑
Zn + 2HCl = ZnCl2 + H2↑
Малоактивні ж метали, що стоять після водню, з кислотами, як правило, не взаємодіють за винятком азотної та концентрованої сірчаної кислот, які реагують як з активними, так і деякими неактивними металами, але виділяється при цьому не водень, а продукти відновлення нітрогену(азоту) чи сульфуру(сірки):
Cu (Zn та ін.) + 4HNO3 = Сu(NО3)2 + 2NО2 + 2Н2О
Си + 2H2SO4(к.) = CuSO4 + S02 + 2Н2О
Більшість кисневих кислот одержують взаємодією кислотних оксидів з водою. Кислоти, ангідриди яких з водою не реагують, добувають із відповідних солей за реакціями обміну:
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
(NH4)2MoQ4 + 2HNO3 = 2NH4N03 + H2MoO4↓
Так можна одержувати й інші кислоти, однак слід пам'ятати, що такі реакції протікають тільки тоді, коли виділяються газоподібні, малорозчинні чи малодисоційовані речовини.
2.3. Солі
Солі визначають або як продукт заміщення атомів гідрогену кислоти на метал, або як продукт нейтралізації кислоти основою. Як правило, це йонні сполуки, які при розчиненні у воді легко дисоціюють на катіони (металу, амонію) і аніони кислотного залишку. Розріз-
няють солі середні, кислі, основні, комплексні та деякі інші.
Середні солі - це продукт повної нейтралізації кислоти основою:
Н3РО4 + 3NaOH = Na3PO4 + ЗН2О
Кислі солі - продукт неповної нейтралізації багатоосновної кислоти основою:
Н3Р04 +2NaOH=Na2HP04 +2Н2О H3P04+NaOH=NaH2P04 + H20
23
Основні солі - продукт неповної нейтралізації багатокислотної основи кислотою:
Mg(OH)2 + HCl = MgOHCl + H20
Комплексні солі - численний клас сполук, до складу яких входять комплексні йони, утворені за донорно-акцепторним механізмом зв'язку:
Na[Al(OH)4]; K3[Fe(CN)6]; [Cu(NH3)4]SO4
Номенклатура солей включає назви катіона і кислотного залишку. Спочатку називають кислотний залишок, причому слід давати його міжнародну назву, а потім катіон в родовому відмінку із ступенем окиснення в разі потреби:
АІСІ3 |
-хлорид алюмінію |
|
Са3(РО4)2 |
- ортофосфат кальцію |
Na2S |
- сульфід натрію |
|
NaPO3 - |
метафосфат натрію |
Li2SO3 |
- сульфіт літію |
|
Ва(АІО2)2 |
- метаалюмінат барію |
FeSO4 |
-сульфатферуму(ІІ) |
КMnО4 |
- манганат(VІІ) калію |
|
Cr(NO3)3-нітрат хрому (III) |
Ag2CrO4 |
- хромат аргентуму |
||
NH4NO2 -нітрит амонію |
К[АІ(ОН)4] - тетрагідроксоалюмінат калію |
|||
В кислих солях до назви кислотного залишку включають початок найменування гідрогену - "гідро", а в основних - назву гідроксильної групи "гідроксо":
Mg(HCO3)2 - гідрокарбонат магнію |
КН2РО4- дигідрофосфат калію |
(СиОН)2СО3-гідроксокарбонат міді(II); |
АІ(ОН)2СІ–дигідроксохлорид алюмінію |
Найважливіші реакції утворення солей були розглянуті при вивченні оксидів, кислот і основ. Перегляньте ще раз цей матеріал і випишіть рівняння відповідних реакцій. Допоможе вам в цьому й схема генетичного зв'язку між класами неорганічних сполук (рис.2.2).
З хімічних властивостей найбільш характерні реакції взаємодії солей з металами і неметалами, кислотами і лугами, з водою та іншими солями, а також розклад солей при нагріванні:
1)Fe + CuSO4 = FeSO4 + Cu 2AgNO3+Cu=Cu(N03)2 + 2Ag
2)2KBr + CI2 = 2KCI + Br2 2KI + Br2 = 2KBr + H2
24
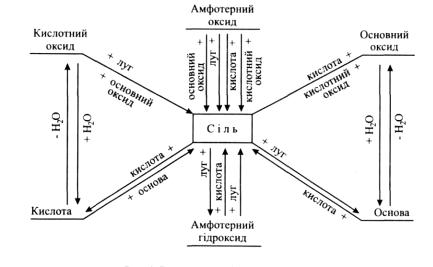
Рис.2.2. Генетичний зв'язок між класами неорганічних сполук
3)Na2CO3 + 2СН3СООН =2CH3COONa + H2O + CO2 Ca3(P04)2 + 2H2S04 = 2CaS04 + Ca(HzPO4)2
4)K2CO3 + Ba(OH)2 = BaCO3↓ + 2KOH
FeCl3 + 3KOH = 3KC1 + Fe(OH)3
5)Pb(NO3)2 + K2S = 2KNO3 + PbS↓ AgNO3 + KI = KNO3 +AgI↓
6)2NaHCO3 Na2CO3 + H2O + CO2
t
4KC1O3 KC1 + 3KC1O4
7)CuSO4 + 5H2O = CuSO4·5H2O - утворення кристалогідратів
8)K2SO3 + H2O ↔ KHSO3 + KOH - гідроліз ZnCl2 + H2O ↔ ZnOHCl + HCl CH3COONH4 + H2O ↔CH3COOH + NH4OH
2.4.Запитання для самоконтролю
1.Який існує взаємозв'язок між найважливішими класами неорганічних сполук?
2.Як поділяють сполуки з оксигеном за складом і властивостями?
25
3.Що таке оксиди? Які бувають оксиди? Їх номенклатура.
4.Які хімічні властивості характерні для солетворних оксидів?
5.Які найбільш розповсюджені способи добування оксидів?
6.Що таке гідроксиди? Як їх розрізняють за складом і властивостями?
7.Дати визначення понять основи, кислоти та солі.
8.Що таке луги? З чим взаємодіють луги і як їх добувають?
9.Що характерно для амфотерних гідроксидів?
10.Що таке кислоти? Їх номенклатура і графічні формули.
11.Які загальні властивості і способи добування характерні для кислот?
12.Які бувають солі за складом і властивостями?
13.Які найважливіші реакції солетворення? Які хімічні властивості характерні для солей?
2.4.Задачі для самоконтролю
1. Дайте назви і вкажіть хімічний характер оксидів: Cs2O; SiO2; MnO; MnO2; Mn2O7; N2O; N2O3; N2O5; C12O; C12O7. Які з цих оксидів реагують з водою? Складіть рівняння відповідних реакцій.
2.3 якими із вказаних речовин реагують оксиди натрію та силі-
цію(IV): HNO3; H2O; P2O5; Ba(OH)2; CuSO4; MgO? Наведіть рівнян-
ня відповідних реакцій.
3.Які з наведених оксидів попарно реагують один з одним: АІ2О3; СаО; SO3; Li2O; SiO2? Складіть рівняння відповідних реакцій.
4.Наведіть назви і графічні формули кислот: НАІО2; НВО2; Н3ВО3; НМпО4; НРО3; Н3РО3; Н3РО4. Напишіть формули ангідридів цих кислот.
5.Як дисоціює при розчиненні у воді та які має хімічні властивості ортофосфатна (фосфорна) кислота? Наведіть рівняння реакцій.
6.3 якими із вказаних речовин буде взаємодіяти розведена сірча-
на (сульфатна) кислота: Cu; CuO; FeS; FeO; Fe; Fe(OH)3; SiO2; SnO2; BaCl2; CaCO3? Складіть рівняння відповідних реакцій.
7.Скільки осаду утвориться при взаємодії 4,9 г сірчаної (сульфатної) кислоти і 10,4 г хлориду барію? (Відповідь: 11,65 г).
8.З якими із зазначених речовин взаємодіє гідроксид калію: FeO, CuSO4; Al(OH)3; P2O5; H2SiO3; FeI2? Наведіть рівняння реакцій.
26
9.Напишіть рівняння реакцій термічного розкладу таких сполук: Cu(OH)2; BaC03; LiOH; Ca(HCO3)2; H3BO3; NH4Cl; H2SiO3; (NH4)2CO3.
10.На прикладі гідроксиду алюмінію продемонструйте способи добування і хімічні властивості амфотерних гідроксидів.
11.Наведіть назви солей та рівняння електролітичної дисоціації
при розчиненні їх у воді: FeCl3; KH2PO4; A12(SO4)3; K3[A1(OH)6]; MgOHCl; (NH4)2Cr04. ,
І2. Запишіть формули солей, виразивши їх через формули оксидів, за допомогою яких вони утворені:
CaCO3; Mg3(P04)2; NaC104 Ва(С1О)2; Zn(NO2)2; Na2ZnO2; KA1O2; LiHSO4; K3A103; Са(Н2РО4)2; AlOHSO4; К2Сг2О7.
13. Складіть рівняння реакцій нейтралізації, внаслідок яких можна одержати солі:
CuSO4; Са3(Р04)2; Cr(NO3)3; К2СгО4; ВаНРО4; КMnО4; КСІО.
14.Наведіть можливі способи добування і хімічні властивості: а) хлориду натрію; б) карбонату кальцію; в) сульфату барію.
15.В розчин CuSO4 занурили залізну пластинку масою 10 г. Скільки міді виділилося з розчину, якщо маса пластинки збільшилась до
10,8 г? (Відповідь: 6,4 г).
16.Користуючись схемою генетичного зв'язку між класами неорганічних сполук (рис. 1.2), складіть рівняння реакцій можливих перетворень, взявши за вихідні такі речовини: SO3; A1(OH)3; ZnO; KOH; SiO2; HC1; СаО.
17.Складіть рівняння реакцій для здійснення таких перетворень:
а) Ва → Ва(ОН)2 → ВаСІ2 → Ba(NO3)2 → BaSO4 → Ba(HSO4)2; б) Zn → ZnO → Na2Zn02 → ZnCl2 → Zn(OH)2 → K2[Zn(OH)4]; в) P → P205 → H3P04 → Ca(H2P04)2 → CaC03 → Ca(HCO3)2;
г) Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe2O3.
Назвіть всі речовини.
27
3.Будова атома. Періодичний закон Д.І.Менделєєва
3.1.Загальні уявлення про будову атома, природа електрона і характеристики його стану в атомі
Слово “атом” у перекладі з грецької мови означає “неподільний”. За сучасними уявленнями атом — електронейтральна мікросистема, що складається з позитивно зарядженого ядра та негативно заряджених електронів. Ядра атомів складаються з двох типів мікрочастинок
(нуклонів) — протонів 11 p і нейтронів 01n, основні характеристики
яких подано в табл. 3.1.
Основна маса атома зосереджена в ядрі і характеризується масовим числом А, яке дорівнює сумі чисел протонів (тобто заряду ядра) Z інейтронів N:
A = Z + N
Таблиця3.1.
Основні характеристики елементарних частинок, які входять до складуатома
Частинка |
Символ |
Маса спокою |
Заряд |
|
|||
абсолютна, кг |
а.о.м. |
електричний, Кл |
відносний |
||||
|
|
||||||
Протон |
11 p |
1,673·10-27 |
1,007276 |
1,602·10-19 |
|
+1 |
|
|
|
|
|
|
|
|
|
Нейтрон |
01n |
1,675·10-27 |
1,008665 |
0 |
|
0 |
|
|
|
|
|
|
|
|
|
Електрон |
_ |
9,109·10-31 |
0,000549 |
1,602·10-19 |
|
-1 |
|
e |
|
||||||
|
|
|
|
|
|
||
Атом і ядро характеризуються такими лінійними розмірами: атома — ~ 10-10, ядра — ~ 10-14 – 10-15 м. Заряд ядра, як головна харак-
теристика атома, визначає число електронів, що обертаються навколо нього.
Отже, заряд ядра зумовлює належність атома до певного виду
хімічних елементів і відповідає порядковому номеру елемента в періодичній системі елементів Д. І. Менделєєва. У позначенні елемента відо-
бражають масове число А ікількість протонів Z, наприклад 1632S , 1940K .
28
Атоми з однаковими значеннями Z, але з різними значеннями А і N, наприклад 168O , 178O, 188O , називають ізотопами.
Атоми з однаковими значеннями N, але з різними значеннями Z і А, наприклад22888Ra,23090Th і 23191Po , називають ізотонами; з однако-
вими значеннями А, але різними Z і N, наприклад 1840Ar , 1940K ,2040Ca—
ізобарами.
За сучасними уявленнями рух електронів в атомі описується законами квантової механіки, в основі якої лежать уявлення про квантування енергії, хвильово-корпускулярну (двоїсту) природу електрона, хвильовий характер його руху. Енергія є найважливішою характеристикою електрона. Вона може приймати лише визначені дискретні значення, поглинається і випромінюється лише порціями – квантами.
Отже, електрон прийнято розглядати одночасно і як мікроматеріальну частинку (див. табл. 1.1), і як хвилю. Математично це положення описується рівнянням де Бройля (1924), відповідно до якого частинці, що має масу і рухається зі швидкістю v, відповідає хвиля довжини λ:
λ=h/mv,
де h — стала Планка (h = 6,626·10-34Дж • с).
Із поняття подвійної природи електрона випливає важливий ви-
сновок, відомий під назвою принципу невизначеності Гейзенберга:
мікрочастинка (електрон), так само як і електронна хвиля, не має одночасно точних значень координат та імпульсу (mv). Цей принцип виявляється в тому, що чим точніше визначаються координати частинки, тим більш невизначеним стає її імпульс (або пов'язана з ним швидкість частинки v), і навпаки. Тому для описування руху мікрочастинки користуються імовірнісним підходом, коли визначають не її точне положення, а ймовірність знаходження її в тій чи іншій ділянці навколоядерного простору. Наприклад, якщо для вимірювання координати електрона користуватися розсіюванням світлових квантів — фотонів (тобто «освітлювати» електрон), то похибка такого вимірювання дорівнюватиме довжині хвилі світла: Δx ~ λ. Причому, чим менше значення λ, тим вища точність вимірювання. Проте зі зменшенням довжини хвилі λ, світла одночасно зростає імпульс фотона
29
p=2nh/λ, який частково передаватиметься електрону під час зіткнення з ним кванта світла.
Отже, в числове значення імпульсу електрона вноситься неконтрольована величина — змінна рх, яка має порядок імпульсу фотона. Величини х, рх та інші однойменні компоненти пов'язані такими співвідношеннями:
Δx·Δpx ≥ h; Δy·Δpy≥h; Δz·Δpz≥h,
які називають співвідношеннями невизначеності Гейзенберга. Тому умови, сприятливі для точного вимірювання координати електрона (мала довжина хвилі), виявляються несумісними з умовами, необхідними для точного вимірювання його імпульсу (мале значення енергії кванта світла), і навпаки. Така ситуація є результатом того, що елект-
рон з огляду на свою подвійну природу не допускає одночасної локалізації в координатному та імпульсному просторі. Звідси випливає, що рух електрона не можна описати за допомогою поняття про траєкторію.
З огляду на хвильову природу електрон характеризується хви-
льовою функцією ψ, яка є амплітудою тривимірної електронної хвилі, тобто це амплітуда ймовірності перебування електрона у певній ділянці простору.
Ймовірність знаходження електрона в об'ємі атомного прос-
тору dV (об'ємі, що знаходиться між двома сферами з радіусами r i(r + dr), і розраховується як добуток 4πr2dr) визначають величиною ψ2dV, або ψ24πr2dr. Ця величина дає наочне уявлення про розподіл електронної густини в атомі, тобто про функцію радіального розподілу.
Густина ймовірності, або електронна густина, — квадрат аб-
солютної величини хвильової функції |ψ|2, розрахований для певного моменту часу та певної точки простору. Ця величина пропорційна ймовірності виявлення електрона у цій точці в зазначений час.
Електронна хмара, або атомна електронна орбіталь (АО), —
квантово-механічна модель стану (руху) електрона в атомі — ділянка навколоядерного простору атома, що обмежена умовною поверхнею, яка не має чітких меж і де густина ймовірності наявності електрона (тобто електронна густина) досягає наперед заданої величини (як пра-
вило, 90 %).
30
