
Хімія / Общая химия конслек Модуль 1_
.pdfРозрахунок хвильової функції ψ, тобто повне описування руху електрона в будь-якому тривимірному полі U{x, yf z), у квантовій механіці здійснюють за допомогою рівняння Шредінгера (1926):
2 |
|
2 |
|
2 |
|
8 2m |
(E U) 0 |
|
x2 |
y2 |
z2 |
h2 |
|||||
|
|
|
|
де h — стала Планка; т — маса електрона; U, Е — відповідно потенційна і повна енергія електрона.
Розв'язування рівняння Шредінгера, отже, математичне описування електронної орбіталі (АО) можливе лише за умови цілком визначених дискретних значень певних характеристик електрона, які називають квантовими числами: головним (п), орбітальним (l), магнітним (тl) і спіновим (ms).
3.2. Квантові числа
Головне квантове число визначає повний запас енергії елек-
трона (рівень енергії електронного шару), тобто ступінь віддалення його від ядра або розмір електронної хмари (орбіталі) і приймає значення 1, 2, 3, 4, 5, 6, 7 ..., які збігаються з нумерацією періодів у періодичній системі елементів Д. І. Менделєєва. Стан електрона, що характеризується певним значенням головного квантового числа, називають енергетичним рівнем електрона в атомі. Для енергетичних рівнів електрона в атомі, що відповідають різним значенням n прийняті позначення великими латинськими буквами.
Головне квантове число - 1, 2, 3, 4, 5, 6, 7...
Енергетичні рівні – K, L, M, N, O, P, Q...
Максимальна кількість енергетичних рівнів, яку може мати атом в основному стані, відповідає номеру періоду, в якому розміщений певний хімічний елемент.
Орбітальне квантове число l описує форму АО і уточнює енергетичну характеристику стану електрона – його підрівень, що позначається арабськими цифрами 0, 1, 2, 3,... або латинськими буквами s, p, d, f. Орбітальне квантове число може приймати значення від 0 до n- 1. Для s-підрівня l=0, для p-підрівня l=1,для d-підрівня l=2, для f- підрівня l=3.
Можлива кількість підрівнів для кожного енергетичного рівня дорівнює номеру цього рівня, тобто головному квантовому числу.
31
Так, на першому енергетичному рівні (n=1) може бути лише один підрівень з орбітальним квантом числом l=0. На другому енергетичному рівні (n=2) можуть бути два підрівні, яким відповідають орбітальні квантові числа l=0; 1. Третій енергетичний рівень (n=3) має три підрівні з відповідними орбітальними квантовими числами: l=0; 1; 2. На четвертому енергетичному рівні (n=4) можуть бути чотири підрівні, кожен з яких має своє значення орбітального квантового числа: l=0; 1; 2; 3.
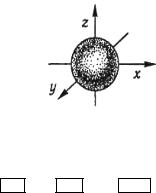
Відповідно до квантово-механічних розрахунків s-орбіталі мають форму кулі (сферичну симетрію), р-орбіталі – форму гантелі, d – і f-орбіталі – складні форми.
Форми атомних орбіталей (АО), що відповідають різним значенням l наведено на рис. 1.1-1.3. Отже, енергетичний підрівень визначає стан електрона в атомі, що характеризується певним набором квантових чисел n і l, наприклад підрівень 4p: n=4, l=1; підрівень 5d: n=5, l=2 тощо.
ns-AO, nsl і ns2; n = 1,2,3,4, 5, 6,7; l = 0, тl = 0. Куля (куль-
ова симетрія), всенапрямленність у просторі атома; позначається у графічних формулах як
; ↑ ; ↑↓
Рис. 3.1.Електронна s-орбіталь і s-електрони
Магнітне квантове число ml, визначає орієнтацію АО в просторі і змінюється від -l до +l, включаючи нульове значення. Магнітне квантове число визначає кількість АО на кожному підрівні: так s- підрівень характеризується однією кулястою атомною орбіталлю (l=0, ml=0); р-підрівень має три АО (l=1, ml=-1, 0, +1); d-підрівень має
32
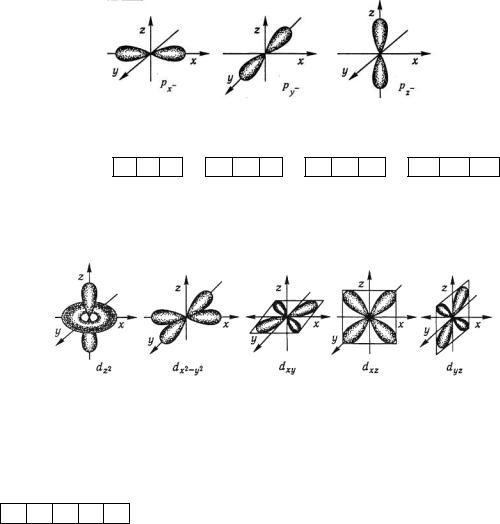
пр-АО, пр1 -пр6, п = 2, 3, 4, 5, 6, 7; l = 1, тl = -1, 0, +1. Ганте-
леподібні об'ємні фігури, напрямлені за осями координат, позна-
чаються у графічних формулах як |
|
|
↑ ↑ |
↑ ↑ ↑ |
↑↓ ↑↓ ↑↓ |
тощо
Рис. 3.2. Електронні p-орбіталі і p-електрони
(n-l) d -AO; (n-1)dl - (n-1)d10, n = 4, 5, 6, 7; l = 2; ml = -2, -1, 0, +1, +2. Одна АО — фігура типу труби, замкненої в кільце (тор) з об'ємною гантеллю на осі z. Чотири АО — чотирилопатеві об'ємні фігури, лопаті яких лежать: однієї — на осях x і у (х2-y2), трьох інших — у квадрантах трьох координатних площин (ху, xz, yz) та ще одна фігура на осі z – dz2 . Позначаються у графічних формулах як
↑ |
↑ |
↑ |
↑ |
↑ |
|
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
тощо.
Рис.3.3. Електронні d-орбіталі і d -електрони.
п’ять АО (l=2, ml=-2, -1, 0, +1, +2); f-підрівень має сім АО (l=3, ml=-3, -2, -1, 0, +1, +2, +3).
Слід зазначити, що кожну атомну орбіталь спрощено зображають як енергетичну комірку (квантову комірку) у вигляді □. Для s- електронів може бути лише одна енергетична комірка □; для р- електронів – три □□□ ; для d-електронів – п’ять □□□□□; для f-електронів
33
– сім □□□□□□□ . Число енергетичних комірок визначається значенням магнітного квантового числа.
Спінове квантове число ms, характеризує власний момент кількості руху електрона і приймає значення +1/2 або -1/2. Спрощено спін (від англійського spin – крутіння, обертання) можна уявити як рух електрона навколо своєї осі. Спін зображають протилежно напрямленими стрілками: ↑;↓. Спіни електронів, напрямлені в один бік, називаються паралельними, у протилежні – антипаралельними.
3.3. Розподіл електронів в атомі, електронні й електроннографічні формули елементів
Орбіталі багатоелектронних атомів заповнюються електронами в міру зростання їх енергії. При цьому обов’язково витримуються такі принципи: 1) найменшої енергії; 2) Паулі; 3) правило Гунда.
Згідно з принципом найменшої енергії найстійкішому стану електрона в атомі відповідає найменша енергія. Тому електрони розміщуються в першу чергу на найближчих до ядра енергетичних рівнях.
Послідовність заповнення атомних орбіталей залежно від значення головного та орбітального квантових чисел дослідив радянський учений В.М.Клечковський. Він встановив, що енергія електрона зростає із збільшенням суми величин (n+l). Відповідно до цього він сформулював положення (правила).
Перше правило Клечковського показує, що послідовне запов-
нення електронних рівнів та підрівнів відбувається в порядку зростання суми головного і орбітального квантових чисел (n+l). Так, сума n+l для 3d-орбіталей 3+2=5, для 4s-орбіталей 4+0=4. Тому спочатку заповнюються електронами 4s-, а потім 3d-орбіталі.
Друге правило Клечковського формулюється так: якщо для двох орбіталей сума (n+l) однакова, то спочатку електронами заповнюється орбіталь з меншим значенням головного квантового числа. Наприклад, для 3d- і 4р-орбіталей сума n+l однакова (3+2 і 4+1). Тому спочатку заповнюється 3d-, а потім 4р-орбіталі.
34

Правила Клечковського показують, у якій послідовності заповнюються підрівні кожного енергетичного рівня.
Таку послідовність можна зобразити у вигляді ряду:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d.
Для запам’ятовування цього ряду існує зручний метод, суть якого зрозуміла з такої таблиці
→↓ |
|
|
1s |
|
|
|
2s |
|
|
2p |
3s |
|
|
3p |
4s |
|
3d |
4p |
5s |
|
4d |
5p |
6s |
4f |
5d |
6p |
7s |
5f |
6d |
7p |
8s |
Таблиця читається по рядках зверху донизу, кожен рядок читається зліва направо.
Згідно з принципом Паулі в атомі не може бути двох електронів з однаковими значеннями всіх чотирьох квантових чисел.
Із цього виходить, що на кожній орбіталі, що характеризується певним значенням головного n, орбітального l і магнітного me квантових чисел, може знаходитися не більш двох електронів з протилежними спінами.
На основі принципу Паулі можна визначити максимально можливе число електронів на кожному енергетичному рівні і підрівні. Так, максимальне число електронів на s-підрівні є 2; р-підрівні – 6; d- підрівні – 10; f-підрівні – 14.
Максимальна кількість електронів на енергетичних рівнях визначається формулою:
N=2·n2, де n - головне квантове число.
N дорівнює: на першому рівні – 2; на другому – 8; на третьому
–18; на четвертому – 32.
Зурахуванням кількості електронів на кожному підрівні ряд
послідовності заповнення АО виглядає так:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
6p6 7s2 5f14 6d10
35
У цьому запису арабська цифра перед символом підрівня показує енергетичний рівень, а “показник ступеня” при символі підрівня – число електронів на цьому підрівні.
Розподіл електронів на енергетичних рівнях і орбіталях для атомів елементів називається електронною конфігурацією, яку можна подати двома способами:
у вигляді електронних формул, які є послідовним переліком позначень рівнів і підрівнів як тих, що повністю заповнені електронами, так і незавершених, наприклад, для Фосфору
15Р - 1s2 2s2 2p6 3s2 3p3.
у вигляді електронно-графічних формул, які є графічним зо-
браженням квантових комірок підрівнів відповідно до зростання їхньої енергії знизу вгору і розміщених на них стрілочок, напрям яких вказує орієнтацію спінів електронів. Наприклад, для Нітрогену 7N
2p3
2s2 ↑ ↑ ↑
1s2 ↑↓
↑↓
Згідно з правилом Гунда в межах енергетичного підрівня електрони в атомі розподіляються таким чином, щоб їх сумарний спін був максимальним. Наприклад, із трьох можливих варіантів розподілу трьох електронів на р-підрівні тільки третій відповідає цій умові:
1) |
↑↓ |
↑ |
|
|
|
|
2) |
↑ |
↑↓ |
|
3) |
↑ |
↑ |
↑ |
||||
1) ms |
|
1 |
; |
2) ms |
1 |
; |
3) ms 1 |
1 |
. |
|||||||||
|
|
|
|
|
||||||||||||||
|
|
|
2 |
|
|
2 |
|
2 |
|
|||||||||
Правило Гунда показує послідовність заповнення орбіталей на кожному підрівні. Наприклад, р-підрівень заповнюється електронами в такій послідовності:
_ |
↑ |
|
|
_ |
↑ |
|
↑ |
|
|
|
_ |
|
↑ |
↑ |
↑ |
_ |
↑↓ |
↑ |
↑ |
|||||
1 е |
|
|
|
2 е |
|
|
|
|
|
|
3 е |
|
|
|
|
|
|
|
4 е |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
_ |
|
↑↓ |
↑↓ |
|
↑ |
|
_ |
|
↑↓ |
↑↓ |
↑↓ |
|
|
|
|
|
|||||||
|
|
|
5 е |
|
|
|
|
|
|
|
6 е |
|
|
|
|
|
|
|
|
|
|
|
|
|
36
Із правила Гунда випливає, що стійким станам відповідають орбіталі і підрівні, які наполовину або повністю заповнені електронами.
Цим і пояснюються переходи (“провали”) електронів з вищих енергетичних рівнів на d-підрівень у атомів: Cr, Mo, Cu, Aq, Au та інші. Наприклад, для хрому (Z=24) електронна формула має вигляд
1s22s22p63s23p63d54s1 замість 1s22s22p63s23p63d44s2
“Провали” електронів характерні тільки для d-підрівнів і лише в тому випадку, коли для заповнення d-підрівнів наполовину або повністю не вистачає лише одного електрона.
На підставі аналізу електронних формул слід навчитися визначати період (за найбільшим головним квантовим числом), групу (за кількістю валентних електронів), підгрупу (за типом заповнення підрівня); s , р – головна підгрупа, d, f - побічна, а також металічність (неметалічність) елемента (у металів заповнюються s-, p- i d-підрівні, у неметалів – р-підрівень), вищу валентність (за кількістю валентних електронів), формулу оксиду і його характер. Розглянемо, наприклад, як охарактеризувати елемент з порядковим номером 23, електронна
формула якого має вигляд:
23Е, 1s22s22p63s23p63d34s2
Електрони розташовані на чотирьох енергетичних рівнях. Таким чином, елемент знаходиться в четвертому періоді. У нього заповнюються d-орбіталі, тому елемент належить до d-елементів і входить до складу побічної підгрупи. Валентні електрони знаходяться на останньому і d-орбіталях передостаннього рівня. Всього валентних електронів п’ять, тому цей елемент належить до п’ятої групи. Мала кількість електронів на останньому рівні визначає природу елемента – він має металічний характер. Вища валентність дорівнює п’яти, таким чином, склад оксиду Е2О5. Оксиди металів з валентністю металу (V- VII) мають кислотний характер.
3.4. Періодичний закон та періодична система елементів Д.І.Менделєєва
Періодичний закон формулюється так: Властивості елементів,
а також форми і властивості сполук елементів перебувають у періодичній залежності від зарядів ядер атомів елементів.
37
Графічним зображенням цього закону є періодична система, що поділена на періоди і групи.
Перший період вміщує 2 елементи (1s2); другий і третій – по 8 (ns2np6); четвертий і п’ятий – по 18 (ns2np6(n-1)d10); шостий - 32
(ns2np6(n-1)d104f14); сьомий – 23 елементів (не закінчений). Усі хімічні елементи поділяють на s-, p-, d-, f- сімейства за ознакою заповнення підрівнів.
Номер групи, в якій знаходиться елемент, збігається із кількістю валентних електронів на зовнішньому енергетичному рівні його атома. Слід добре знати, що кількість валентних електронів не завжди збігається з номером групи. Так, у елементів тріади заліза число валентних електронів менше за номер групи, в якій вони знаходяться. Є ще й інші винятки.
На основі теорії будови атомів було встановлено причину періодичної зміни властивостей елементів у системі, а саме: властивості елементів змінюються періодично завдяки тому, що розвиток атомних структур у горизонтальних рядах елементів за умови плавного зростання порядкових номерів супроводжується періодичним повторенням подібних електронних формул, що приводить до утворення двох типів подібних елементів:
•електронних аналогів, розміщених вертикально, — груп елементів, у яких електронні формули валентних електронів однакові, наприклад:
ІА |
IIА |
IIIВ |
- VIIВ - VIIА |
VIIIА |
ns1 |
ns2 |
ns2(n-1)d1 |
ns2(n-1)d5 - ns2np5 |
ns2np6; |
•електронних сімейств елементів, в яких заповнюється (від початку до кінця кожного горизонтального періоду) електронами один і той
самий підрівень, наприклад:
s-метали: ns1 – ns2;p-елементи: ns2 np1---ns2np6 ; d-метали: ns2(n-1)d1 ---ns2(n-1)d10;
f-елементи: ns2(n-2)f1 --- ns2(n-2)f14.
Отже, електронні аналоги є аналогами хімічними, оскільки вони мають однакову структуру валентних енергетичних рівнів і є подібними за хімічними та фізико-хімічними властивостями.
Оскільки електронна конфігурація хімічних елементів періодично змінюється зі зростанням їхніх порядкових номерів (Z), більшість фізико-хімічних характеристик атомів елементів змінюється також
38
періодично-закономірно у періодах і групах системи елементів. Серед таких фізико-хімічних характеристик елементів, які мають вирішальний вплив на їхні властивості, а отже, і на властивості сполук, похідних від них, слід виділити: порядкові номери елементів Z, радіуси їхніх атомів та йонів r, потенціали (або енергія) йонізації I1, енергію
спорідненості до електрона Eсп, електронегативність æ, ступені окиснення елементів z. Тому перелічені характеристики змінюються в періодах і групах системи елементів цілком передбачувано та закономі- рно-періодично і їх загалом можна назвати критеріями періодичності. Причому очевидними є взаємопов’язаність і взаємозумовленість цих критеріїв. Тобто закономірно-послідовна зміна одних із них зумовлює відповідну періодичну зміну інших, що можна подати такою послідовною схемою: періодична зміна значень Z —> зміна електронних конфігурацій елементів —> зміна радіусів атомів та йонів —>
зміна енергетичних характеристик: I1, Eсп , æ—> зміна ступенів окиснення елементів z —> періодична зміна хімічних і фізико-хімічних властивостей як самих елементів, так і простих речовин та складних сполук, які вони утворюють.
3.5.Радіуси атомів та йонів елементів
Увизначенні радіуса атома не спостерігається однозначності тому, що ізольований атом або йон не має чітко визначених зовнішніх меж. Тому залежно від типу хімічного зв'язку, структури речовини і ступеня окиснення елемента слід відрізняти такі види радіусів атомів:
1)ефективний радіус атома — радіус, розрахований на основі експериментальних даних між'ядерних відстаней у молекулах і кристалах;
2)ковалентний (атомний) радіус — половина між'ядерної відстані в молекулах або кристалах відповідних простих речовин; 3) металічний (атомний) радіус також дорівнює половині відстані між центрами двох сусідніх атомів у кристалічній гратціметалу; 4) йонний радіус — ефективний радіус, розрахований для кристалів з переважно йонним типом зв'язку (аніонний — більший за атомний радіус, катіонний — менший від нього); 5) орбітальний радіус — теоретично розрахована відстань від ядра до головного максимуму електронної густини зовнішньої орбіталі; він є характеристикою ізольованого атома або йона, що не залежить від природи хімічного зв'язку.
39
Зміна радіусів атомів елементів у періодичній системі має періодичний характер (див. рис. 3.4, а):
у періодах зліва направо |—»| у міру збільшення зарядів ядер (тобто порядкових номерів) і чисел валентних електронів елементів радіуси зменшуються;
у групах зверху донизу |↓| заряди ядер атомів зростають стрибкоподібно, але одночасно збільшується і число електронних енергетичних рівнів, що призводить до збільшення радіусів атомів. При цьому в групах А таке збільшення відбувається більш різко, ніж угрупах В.
3.6.Закономірності зміни енергетичних характеристик елементів.
Хімічна активність елемента визначається здатністю його атомів
відщеплювати чи приєднувати електрони. Кількісно ця здатність атомів елементів оцінюється за допомогою двох енергетичних характеристик: 1) енергії (потенціалу) йонізації; 2) енергії спорідненостідо електрона.
Енергія йонізації
Енергія йонізації (І, кДж/моль; еВ) — мінімальна енергія, потрібна для відщеплення найслабкіше зв'язаного електрона від незбудженого атома: R0 —> R+ +e, I1> 0, де R0 — символ будь-якого елемента, R+ — символ його йона. Потенціал (і енергія) йонізації є складною функцією деяких характеристик атома: заряду ядра, радіуса атома, конфігурації валентних електронних оболонок. Періодичність зміни величини I1 елементів залежно від їх порядкових номерів подано на рис.3.4,б.
Аналізуючиданнірис.3.4,б,можназробитивідповіднівисновки.
•У групах елементів зверху вниз зі зростанням радіусів атомів зменшується сила утримування валентних електронів. Отже, значення енергії йонізації знижується, тобто в цьому напрямі здатність віддавати електрони (окиснюватися) стає енергетично все легшою.
•У періодах елементів зліва направо |—»| у міру зменшення радіусів атомів і водночас зростання ступеня заповнення електронами (зокрема, парами електронів) валентних рівнів значення I1 зростають відповідно. Тобто в цьому напрямі відщеплення електронів атомами енергетично утруднюється.
40
