
Хімія / Общая химия конслек Модуль 1_
.pdf
1 m(Mg) mE(2 Mg) , m(O2) mE(1 O)
2
звідки
|
1 |
|
m ( |
1 |
O)m(Mg) |
|
8 1 |
|
|
|
|
2 |
|
|
|
||||
mE( |
Mg) |
E |
|
|
12,158 |
г/моль |
|||
2 |
|
m(O ) |
0,658 |
||||||
|
|
|
|
|
2 |
|
|
|
|
Таким чином, молярна маса еквівалента магнію дорівнює 12,158 г/моль, а еквівалент магнію – 1/2 моль, тому що молярна маса магнію
24,312 г/моль.
Якщо елемент утворює кілька хімічних сполук, проявляючи при цьому різну валентність, його еквівалент і молярна маса еквівалента в кожній сполуці будуть різними. Наприклад, залізо утворює дві сполуки з киснем: FeO – оксид заліза (ІІ); Fe2O3 – оксид заліза (ІІІ). Відповідно, еквівалент заліза у першій сполуці дорівнює 1/2 моль, у другій
– 1/3 моль; молярна маса еквівалента заліза у першому випадку дорів-
нює mE(1/2 Fe)=55,85/2=27,92 г/моль, у другому – mE(1/3 Fe)=55,85/3=18,62 г/моль.
Еквівалентний об’єм простих газоподібних речовин – це об’єм, який займає молярна маса еквівалента речовини за нормальних умов.
Для визначення еквівалентного об’єму простих газоподібних речовин необхідно молярний об’єм газу поділити на число еквівалентності.
Число еквівалентності в такій сполуці визначається за подвоєною кількістю зв’язків між атомами елемента, що входить у дану молекулу. Наприклад, для водню Н-Н, кисню О=О і азоту N≡N еквівалентні об’єми дорівнюють відповідно 22,4/2 = 11,2 л; 22,4/4=5,6 л; 22,4/6=3,7 л.
1.3.Запитання для самоконтролю
1.Що вивчає наука хімія? В чому суть хімічних перетворень?
2.Що таке атом, молекула, хімічний елемент, проста та складна речовини, алотропія, сталість складу речовин?
3.Що таке атомна і молекулярна маси? Як вони визначаються?
11
4.Що таке кількість речовини, моль, молярна маса?
5.Що таке валентність? Як вона визначається?
6.Як складають хімічні формули? Які є типи хімічних формул?
7.Які розрахунки слід проводити за хімічними формулами?
8.Як пояснити закон збереження маси речовин з позицій атомномолекулярного вчення? Яке значення має цей закон?
9.Чому закон Авогадро справедливий тільки для газів? Як використовують цей закон при хімічних розрахунках?
1.4.Задачі для самоконтролю
1.Які з перелічених речовин слід віднести до простих, а які - до складних: кокс, кварц, рубін, алмаз, гіпс, радон, озон, водяна пара, сажа, олеум, повітря, мельхіор, купорос, чавун?
2.Що таке валентність? Як її визначають? Визначте валентність елементів усполуках: NH3, A12S3, Ca3P2,CO2, Mg2Si, SF6,SiC, OsO4.
3.Обчисліть масові частки елементів у сполуках: СаСО3, Н2О, КОН.
4.У скількох грамах руди, що складається з 50% Fe2O3 і пустої породи, міститься 28 г чистого заліза?
5.У зразку руди міститься 62% магнетиту Fe3O4, решта - пуста порода. Визначте вміст заліза в руді, якщо в пустій породі заліза немає.
6.Обчисліть, скільки молекул містить: а) 1 л аміаку за н.у.; б) 1 мл води за 277 К; в) 0,1 моль СО2; г) 3 г оксиду нітрогену (II).
7.Деякий газ знаходиться в закритій посудиш об'ємом 10 л за температури 273 К і тиску 106 Па. Як зміниться тиск у посудині, якщо: а) підвищити температуру на 50°С; б) зменшити кількість газу в посудині на 2 моль?
8.Стальний балон для зберігання кисню об'ємом 50 л розрахований на тиск до 1 мПа і температуру до 50°С. Скільки г кисню можна максимально помістити в балон, якщо зарядка проводиться при 273 К?
9.Які ви знаєте способи визначення молярної маси газоподібних речовин? Складіть власні приклади.
10.Маса 1 л газу за н.у. складає 1,964 г. Визначте молекулярну масу газу і густину його за повітрям.
11.Обчисліть молярну масу газу, 6 г якого за температури 750 К і тиску83,1 кПа займають об'єм 7 л.
12.1 г деякого газу за нормальних умов займає об'єм 315,5 мл. Визначте молярну масу газу, його густину за воднем та масу однієї мо-
12
лекули в грамах. Визначте молекулярну формулу цього газу, якщо відомо, що він є простою речовиною.
13.Об'ємна частка вуглекислого газу в повітрі складає 0,03%. Визначте масу, кількість моль та кількість молекул вуглекислого газу в приміщенні об'ємом 150 м3 (н.у).
13
2. Основні класи неорганічних сполук
Хiмiчнi сполуки рiзного якiсного та кiлькiсного складу подiляють на дві великi групи: неорганiчнi сполуки та органiчнi. Складні неорганiчнi сполуки дiлять на основнi та неосновнi класи. До основних класiв неорганiчних сполук вiдносять: оксиди, основи, кис-
лоти та солi.
Взаємозв'язок між найважливішими класами неорганічних речовин ілюструє класична схема (рис.2.1).
2.1. Оксиди
Оксиди – це складні речовини, що складаються з двох елементів один з яких оксиген(кисень) в ступені окиснення -2
Уоксидах усі атоми оксигену безпосередньо зв'язані з атомами більш електропозитивних елементів, а співвідношення компонентів відповідає правилам валентності, на відміну від усіх інших сполук елементів з оксигеном (пероксидів, супероксидів, озонідів, субоксидів).
Усполуках оксигену з флуором (фтором) аніоноутворю-вачем є більш електронегативний флуор, тому, наприклад, сполуку OF2 відносять не до оксидів, а до фторидів, у яких ступінь окиснення оксигену
+2.
Трапляються кисневі сполуки, якi можна вважати змішаними оксидами, або ж солями, утвореними металом та кислотою того ж металу у вищому ступені окиснення, наприклад:
Pb2O3 = PbO·PbO2 = PbPbO3 ; Fe3O4 = FeO·Fe2O3 = Fe(FeO2)2.
При написаннi структурних формул оксидiв необхiдно пам'ятати, що в оксидах, до складу яких входять кiлька атомiв одного і того ж елемента, зв'язок мiж ними здiйснюється через оксиген, наприклад: N2O3 - O=N-O-N=O.
За здатністю утворювати солі розрізняють несолетворні (N2O, NO, CO) та солетворні оксиди. Останні поділяють на кислотні (СО2, N2O5, CrO3), основні (CaO, Na2O, CrO) і амфотерні (ZnO, AI2О3,
Сг2О3). В табл.1.1 наведено дані про хімічний характер оксидів залежно від ступеня окиснення елемента, а також формули відповідних гідратів оксидів.
14
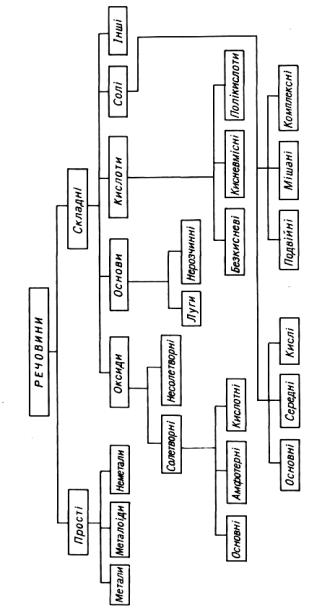
Рис.2.1. Схема взаємозв`язку між основними класами неорганічних сполук
15
За сучасною номенклатурою назви оксидів починаються словом "оксид", далі йде назва відповідного елемента в родовому відмінку, а якщо елемент: утворює кілька оксидів, вказують його ступінь окиснення, наприклад, Al2O3 – оксид алюмінію, FeO – оксид феруму(II), Fе2O3 – оксид феруму(ІІІ), Р2О5 – оксид фосфору(V), С12О7 – оксид хлору (VII) і т.д.
Кислотними називають оксиди, яким відповідають кислоти. Утворюють кислотні оксиди, як правило, неметали, а також метали з високим ступенем окиснення (від +5 до +8).
Таблиця 2.1. Хімічний характер оксидів та відповідних їм форм гідратів оксидів
Ступінь |
Фор- |
Формула |
Хімічний характер оксидів |
||
окис- |
мула |
кислоти, |
|
|
|
нення |
оксиду |
гідрок- |
|
|
|
еле- |
|
сиду |
Основний |
Амфотерний |
Кислотний |
мента |
|
|
|
|
|
+1 |
Е2О |
Е(ОН) |
Li, Na, K, Rb, Cs, |
— |
СІ, Вг |
|
|
|
Fr, Cu*, Ag*, |
|
|
|
|
|
Au*, Tl, Hg* |
|
|
+2 |
EО |
Е(ОН)2 |
Mg, Ca. Sr, Ba, |
Be, Zn, Cu, Ge, |
— |
|
|
|
Ra, Cd, Hg*, Eu, |
Sn, Pb |
|
|
|
|
Sm, Yb, V, Cr, |
|
|
|
|
|
Mn, Re, Fe, Co,Ni |
|
|
+3 |
Е2О3 |
Е(ОН)3 |
Y, La, Ac, Tl, Ce. |
Au, Al, Ga, In, |
В, N, Р, As |
|
|
ЕО(ОН) |
Gd, Yb, Am, Cm, |
Sc, Sb, Cr, Fe, |
|
|
|
|
Bk, Cf, Es, Bi, V, |
Ni, Co, Ir, Rh |
|
|
|
|
Mn, Re |
|
|
+4 |
EО2 |
Е(ОН)4 |
Th, U, Pu, Am, |
Ce, Ge, Sn, Pb, |
С, Si, S, Se, Те |
|
|
ЕО(ОН)2 |
Cm, Np |
Ті, Zr, V, Mn |
|
+5 |
Е2О5 |
Е(ОН)5 |
Pa, Np, Pu |
Nb, Та |
N, Р, V, As, Sb |
ЕО(ОН)3 |
|||||
|
|
ЕО2(ОН) |
|
|
|
+6 |
ЕО3 |
ЕО2(ОН)2 |
— |
U, Np, Pu, Am |
S, Se, Те, Сг, |
|
|
|
|
|
Мо, W, Mn*, |
|
|
|
|
|
Re, Fe*, Xe |
+7 |
Е2О7 |
ЕО3(ОН) |
— |
— |
СІ, І, Mn, Re |
|
|
|
|
|
|
+8 |
EО4 |
ЕО2(ОН)4 |
— |
— |
Os, Ru, Xe |
*) елементи, для яких гідрати оксидів у вільному стані не добуто
При взаємодії з основами та основними оксидами кислотні оксиди утворюють солі, причому кислотний оксид входить до кислотного залишку:
16
СО2 + 2NaOH = Na2CO3 + Н2О; |
SiO2 + СаО = СаSiO3 |
|
СгО3 + 2КОН = К2СrO4 + Н2О ; |
N2O5 |
+ Na2О = 2NaN03 |
Р205+ ЗСа(ОН)2 = Са3(Р04)2+ ЗН2О; |
Mn2O7 |
+ ВаО = Ba(MnO4)2 |
Більшість кислотних оксидів реагують з водою, утворюючи кис-
лоти:
SO3 + H2O = H2S04; N205 + Н20 = 2HN03 ,
але є оксиди, які з водою безпосередньо не взаємодіють (SiO2, MoO3). Їм відповідають нерозчинні у воді кислоти (H2SiO3, H2MoO4), які можна добути з відповідних солей реакціями обміну.
Якщо будь-яким способом від кислоти відняти воду, лишиться кислотний оксид. Тому кислотні оксиди ще називають ангідридами кислот (зневоднена кислота). На практиці, щоб знати, який ангідрид відповідає тій чи іншій кисневій кислоті, треба подумки відняти від кислоти воду до повного вилучення атомів гідрогену. Якщо ж до оксиду додати воду, знайдемо формулу кислоти, яка йому відповідає. Наприклад, кислотам H2SeO4, H3PO4, НСІО4, Н3ВО3, відповідають ан-
гідриди SeO3, P2O5, C12O7, B2O3, a оксидам SO2, N2O3, V2O5, C12O, CrO3, Мп,О7, відповідають кислоти H2SO3, HNO2, HVO3, HC1O, H2CrO4, HMnO4.
Основним оксидам відповідають основи. Утворюють їх метали з низьким ступенем окиснення +1 або +2. Реагуючи з кислотами і кислотними оксидами, основні оксиди утворюють солі:
СuO + 2HNO3 = Сu(NО3)2, |
Ag2O + СгО3 = Ag2CrO4 |
З водою основні оксиди, як правило, не реагують, за винятком |
|
оксидів самих активних металів - лужних і лужноземельних: |
|
Li2O + Н2О = 2LiOH |
BaO + H2O = Ba(OH)2 |
Амфотерні оксиди мають властивості як основних, так і кислотних оксидів. Це залежить від того, з чим даний амфотерний оксид реагує - з кислотою (кислотним оксидом) чи з лугом (основним оксидом). Амфотерні оксиди утворюють теж лише метали, але із ступенем окиснення +3, +4, (іноді +2): BeO, ZnO, АІ2О3, SnО2 та інш.
При вивченні хімічних властивостей амфотерних оксидів інколи труднощі викликають рівняння реакцій взаємодії їх з лугами та основними оксидами. Слід пам'ятати, що обов'зковим продуктом таких реакцій є сіль, а оскільки амфотерний оксид виступає при цьому в ролі кислотного, він входить до кислотного залишку солі. Щоб визначити
17
склад кислотного залишку, треба, як уже говорилося, подумки додати до оксиду воду (насправді, амфотерні оксиди з водою не реагують) і встановити, яка кислотна форма відповідає даному оксиду. Так, оксиду ZnO відповідає кислотна форма H2ZnО2, у оксиду А12О3 є дві кислотні форми: НА1О2 і Н3А1О3, оксиду SnO2 відповідає кислота Н2SnO3 і т. д.
t |
t |
А12О3+ 2NaOH 2NaAlO2+ Н2О; ZnO + ВаО BaZnO2 |
|
t |
t |
Al2O3 + 6NаОН 2Nа3АlOз+ЗН2О; SnO2+K2O K2SnO3
З кислотами та кислотними оксидами амфотерні оксиди реагують як основні:
t
ZnО + 2НСІ = ZnCl2 + Н2О; А12О3+3SO3 Al2(SO4)3
Таким чином, аналізуючи рівняння реакцій за участю оксидів приходимо до висновку, що між собою реагують оксиди, наділені протилежними функціями - кислотною і основною. Внаслідок реа-
кції утворюється тільки сіль. При взаємодії оксидів з кислотою чи основою обов'язковими продуктами реакцій є сіль і вода.
Є кілька загальних способів добування оксидів, які широко застосовуються на практиці:
1) найпростіше оксид добути при взаємодії двох простих речовин за реакцією сполучення, але так можна одержати далеко не всі оксиди:
4Al + 3O2 = 2Al2O3 |
|
2Mg + O2 = 2MgO |
4P + 5O2 = 2P2O5 |
|
t |
|
S + O2 SO2 |
|
2) розклад складних |
кисневмісних речовин при нагріванні: |
|
t |
|
t |
H2SiO3 SiO2+H2O |
|
NH4NO3 N20+2Н20 |
t |
|
t |
2Аu(ОН)3 Аu2О3 + ЗН2О |
СаСОз СаО + СО2 |
|
t |
|
t |
Cu(ОН)2 СuО + Н2О |
|
4HNО2 2HNО3 +NO+ Н2О |
3) горіння (окиснення) складних речовин у присутності кисню: |
||
t |
|
t |
4NH3+502 4NO+6H20; |
СН4 +202 С02 +2Н20 |
|
t |
; |
t |
2ZnS+302 2ZnO+2S02 |
2NO2 +O3 N2О5 + O2 |
|
г) з інших оксидів:
18
N02 +N0 = N2O3 ; |
t |
Fе2О3 + C0 2FеО+C02 |
2.2. Гідрати оксидів
Важливу групу серед складних сполук становлять гідрати оксидів (гідроксиди) – продукти прямої або посередньої взаємодії оксидів з водою. Наприклад, основні оксиди утворюють з водою основні гід-
роксиди (основи), кислотні оксиди – кислотні гідроксиди (кислоти), а
амфотерні оксиди – амфотерні гідроксиди (амфоліти). Склад гідроксидів виражають загальною формулою ЕОm(ОН)n (табл. 1.1) , де m=0…4, а n=1...6 у реально існуючих гідроксидів. Якщо m=0, то гідроксиди Е(ОН)n можуть мати як основний, так і кислотний характер, причому зі збільшенням ступеня окиснення елемента Е основні властивості послаблюються, а кислотні посилюються. Якщо m 0, то гідроксиди ЕОm(ОН)n мають винятково кислотні властивості, і зі зростанням m сила кислот зростає.
2.2.1. Основи
За теорією електролітичної дисоціації Арреніуса до основ нале-
жать сполуки, які складаються з катіонів (металів, амонію) і гідроксо-
-
груп ОН , здатних заміщуватись на кислотний залишок, для їх назви ще часто використовують загальний термін гідроксиди: NaOH - гідроксид натрію, NH4OHгідроксид амонію, Fe(OH)2 - гідроксид феруму (II), Fe(OH)3 - гідроксид феруму (III) і т.д. Основи ділять на розчинні у воді або луги (гідроксиди найбільш активних металів - лужних та лужноземельних) і практично нерозчинні - гідроксиди інших металів.
Носієм основних властивостей у водних розчинах є гідроксильні
-
групи ОН , які утворюються в процесі розчинення і електролітичної дисоціації вказаних сполук і зумовлюють мильні на дотик властивості розчину, забарвлення індикаторів і характерні хімічні властивості. Завдяки йонному зв'язку розчинні у воді гідроксиди металів (луги) прак-
тично повністю дисоціюють на йони і мають високу хімічну актив-
-
ність. Нерозчинні гідроксиди надсилають луже мало ионів ОН у розчин і тому в хімічному відношенні досить інертні.
Всі без винятку основи взаємодіють з кислотами (реакція нейтралізації), внаслідок чого утворюються сіль і вода:
19
2NaOH + Н2SiОз = Na2Si03 + 2Н2О
Cu(OH)2 + 2НNО3 = Cu(N03)2 + 2Н2О
Крім того, луги взаємодіють з оксидами (кислотними і амфотерними):
Ва(ОН)2 + СО2 = ВаСО3 + Н2О 2КОН+Сr2О3 =2КСrО2 + Н2О
солями, витискуючи нерозчинні у воді й газоподібні продукти: 2NaOH+CuS04=Na2SO4+Cu(OH)2↓ Ba(OH)2+Na2SО4=2NaOH+BaS04↓
Ca(OH)2+2NH4Cl =СаС12+2Н20+2NНз↑
Більшість основ, крім гідроксидів лужних металів, при нагріванні розкладаються на відповідний оксид і воду:
t |
t |
2А1(ОН)3 АІ2О3 + ЗН2О; |
Са(ОН)2 СаО + Н2О |
Луги добувають при взаємодії металу або його оксиду з водою, |
|
а також з солей шляхом обмінних реакцій з іншими лугами: |
|
2Li +2Н2О = 2LiOH + Н2; |
СаО+Н20=Са(ОН)2 |
К2СО3 +Са(ОН)2 = 2КОН + СаСО3
Основи, які мають промислове значення (NaOH, KOH), одержують у великих масштабах електролізом водних розчинів їх солей:
електроліз
2NaCl+2H20 2NaOH + H2↑ + Cl2↑
катод анод
2.2.2. Амфотерні гідроксиди
Амфотерні гідроксиди – це гідрати амфотерних оксидів. В за-
лежності від умов вони можуть відщеплювати при дисоціації йони H+
-
чи ОН і, як і відповідні амфотерні оксиди, взаємодіють з кислотами і лугами. Але записують їх як основи: Zn(OH)2, AI(OH)3, Sn(OH)4. Коли амфотерний гідроксид взаємодіє з кислотою, проявляється його основна функція:
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H20,
якщо ж до нього додавати луг, проявляється кислотна функція, і метал. що утворив амфотерний гідроксид, входить до складу кислотного залишку:
Сг(ОН)3 + NaOH = Na[Cr(OH)4] - у водному розчині,
t
Cr(OH)3+NaOH NaCiO2 +2H20 - при нагріванні.
20
