
- •Глава 5. Термодинамика однокомпонентных систем
- •5.1. Термодинамические потенциалы идеальных газов
- •5.2. Реальные газы. Летучесть
- •5.3. Стандартное состояние
- •5.4. Зависимость летучести от температуры
- •5.5.Фазовые превращения. Уравнение Клаузиуса – Клапейрона.
- •5.6.Диаграммы состояния.
- •5.7. Энантиотропные и монотропные превращения
5.5.Фазовые превращения. Уравнение Клаузиуса – Клапейрона.
Индивидуальное вещество может находиться в газообразном, жидком или твердом (в различных кристаллических модификациях) состояниях. В равновесной системе, состоящей из нескольких фаз чистого вещества, возможны переходы из одной фазы в другую – плавление, испарение, сублимация, переход из одной кристаллической модификации в другую. Эти процессы характеризуются определенным тепловым эффектом, скачкообразным изменением объема и энтропии при непрерывности изобарного потенциала. Их называютфазовыми переходамипервого рода, или агрегатными превращениями.
Рассмотрим равновесный переход одного моля вещества из одной фазы 1 в другую 2 при постоянных давлении и температуре. В таком процессе производится только работа расширения и изменение внутренней энергии будет равно
U2–U1=Т(S2–S1) –р(V2–V1), (5.33)
или
U2 – TS2+pV2=U1–TS1+pV1. (5.34)
Левая и правая суммы равенства равны, по определению, изобарным потенциалам G2иG1моля вещества в сосуществующих фазах, т.е. изобарные потенциалы единицы массы вещества в двух фазах, находящихся в равновесии, равны между собой:
G2=G1. (5.35)
Изменение температуры (или давления) приводит к нарушению равновесия, и новое равновесие устанавливается при другом давлении (или температуре). При этом изобарные потенциалы фаз изменяются:
dG1= –S1dT+V1dp, (5.31)
dG2= –S2dT+V2dp. (5.32)
Но в новых условиях остаются справедливыми условия равновесия (5.35) и G2+dG2=G1+dG1, т.е.dG2=dG1и после вычитания уравнений получим
(V2–V1)dp= (S2–S1)dT, (5.38)
или
![]() . (5.39)
. (5.39)
Так как фазовые превращения представляют собой равновесный изотермический процесс, то изменение энтропии
S=S2–S1=![]() , (5.40)
, (5.40)
где Нф.п.– изменение энтальпии при фазовом переходе (теплота фазового перехода). После подстановки уравнения (5.40) в (5.39) получим:
![]() . (5.41)
. (5.41)
Уравнение (5.41) называется уравнением Клаузиуса – Клапейронаи приложимо ко всем агрегатным превращениям индивидуальных веществ.
Рассмотрим некоторые частные случаи использования уравнения Клаузиуса – Клапейрона для фазовых переходов первого рода.
Плавление. В процессе плавления происходит поглощение тепла, т.е. всегдаНпл> 0. В подавляющем большинстве случаев мольный объем жидкости больше мольного объема твердого тела, т.е.V2>V1, и для процессов плавления в соответствии с уравнением (5.41)dp/dT> 0. Это значит, что при повышении давления температура плавления веществ обычно увеличивается. Исключением является вода (плотность льда меньше плотности жидкой воды), висмут, галий и некоторые другие вещества, для которыхV2<V1, поэтому для нихdp/dT< 0 и их температура плавления падает при повышении давления.
Испарение. Теплота испарения, как и теплота плавления, всегда положительна. Объем газа (пара) также всегда больше объема жидкости, поэтому всегдаdp/dT> 0, т.е. при повышении внешнего давления температура кипения жидкости повышается или при повышении температуры давление насыщенного пара над жидкостью возрастает.
При температурах, далеких от критических, объем газа во много раз больше объема жидкости, поэтому последним можно пренебречь и считать в уравнении (5.41) V2–V1=Vгаз. В этих же условиях пар можно рассматривать как идеальный газ, объем которогоV=RT/p. Обозначим теплоту испаренияН=, и после соответствующих подстановок в (6.9) получим:
![]() , (5.42)
, (5.42)
или после разделения переменных
![]() . (5.43)
. (5.43)
Уравнение (5.43) является частным случаем уравнения Клаузиуса – Клапейрона и выражает зависимость давления насыщенного пара над жидкостью от температуры. Если считать, что в небольшом температурном интервале теплота испарения не зависит от температуры, то интегрирование этого уравнения дает:
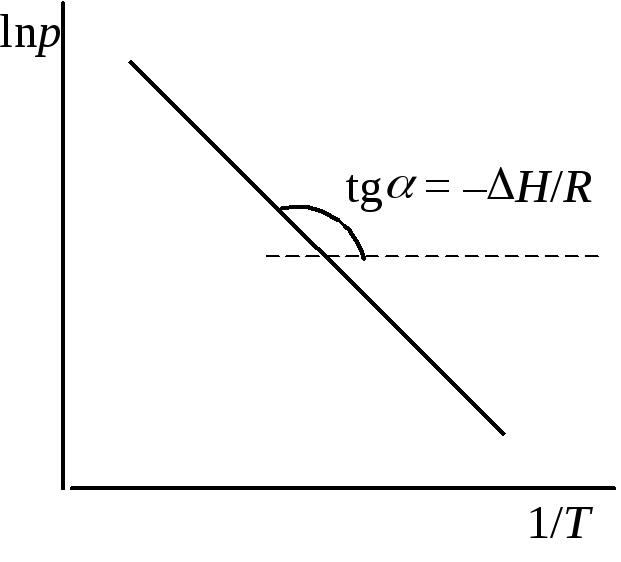
lnp=–
![]() + const, (5.44)
+ const, (5.44)
т.е. логарифм давления насыщенного пара является линейной функцией обратной величины температуры. Интегрирование уравнения (6.5) в пределах от p1доp2и отT1доT2дает
![]() . (5.45)
. (5.45)
Рис. 5.5. Зависимость
lnp
от 1/Т
для насыщенного
пара
Теплоты испарения жидкостей связаны с их нормальными температурами кипения. По правилу Трутона, мольные энтропии испарения различных жидкостей при нормальных температурах кипения одинаковы:
Sвип=![]() = 80 – 90Джмоль–1К–1. (5.46)
= 80 – 90Джмоль–1К–1. (5.46)
Правило Трутона приближенно выполняется для углеводородов и их производных, эфиров и других классов неполярных веществ, но не выполняется для полярных и ассоциированных жидкостей (вода, спирты и т.п.).
Более точным является правило Гильдебранда, согласно которому энтропии испарения жидкостей равны между собой при температурах, для которых мольные объемы насыщенного пара одинаковы. При этом изменение энтропииSсоставляет 80 – 90 Дж моль–1.К приV= 49,5 л/моль.
Кроме рассмотренных, существуют также фазовые переходы второго рода, для которых характерно не только равенство изобарных потенциалов, но и равенство объемов и энтропий сосуществующих фаз:
G= 0;V= 0;S= 0. (5.47)
Такие превращения не сопровождаются тепловым эффектом, но характеризуются изменением теплоемкости, коэффициента теплового расширения, сжимаемости. К ним относятся переходы ферромагнитных тел в парамагнитные при температуре, называемой точкой Кюри, переходы металлов в сверхпроводящее состояние, превращение гелия I в гелий II и т.п.
