
- •Глава 9. Диаграммы состояния двухкомпонентных систем с конденсированными фазами
- •9.1. Объемная и плоская диаграммы
- •9.2. Двухкомпонентные системы с простой эвтектикой
- •9.3. Термический анализ
- •9.4. Бинарные системы с химическим соединением, плавящимся конгруентно (без разложения)
- •9.5. Системы с химическим соединением, плавящимся инконгруентно (с разложением)
- •9.6. Твердые растворы
- •9.7. Двухкомпонентные системы с ограниченной взаимной растворимостью в твердом состоянии
- •9.8. Физико-химический анализ
9.2. Двухкомпонентные системы с простой эвтектикой
Рассмотрим диаграмму плавкости системы, образованной двумя твердыми компонентами A и B, которые не растворяются друг в друге в твердом состоянии, неограниченно смешиваются в жидком состоянии и не образуют химических соединений (рис. 9.2). Примером может служить система Сd – Ni. Проследим за процессами кристаллизации в такой системе при постоянном давлении для расплавов различного состава.
При температурах выше точки а существует одна жидкая фаза – расплавленный компонент А. При охлаждении эта фаза сохраняется вплоть до достижения температуры кристаллизации (точка а). При дальнейшем отнятии тепла начинается кристаллизация и появляется вторая твердая фаза – кристаллы A. Процесс кристаллизации чистого вещества протекает при постоянной температуре и фигуративная точка а не смещается, а система остается условно инвариантной (s = 0). После окончания процесса кристаллизации система вновь становится однофазной (кристаллы A), а при охлаждении фигуративная точка опускается по прямой akcA, система условно моновариантна.
Рис.
9.2. Диаграмма
состояния
двухкомпонентной
системы с
простой
эвтектикой
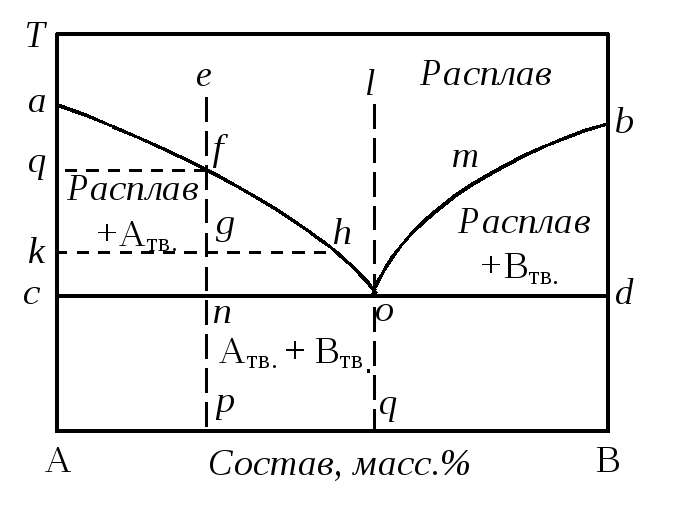
Расплав, который может находиться в равновесии с кристаллами двух компонентов, называется жидкой эвтектической смесью, или просто, жидкой эвтектикой, а температура ее кристаллизации – эвтектической точкой. Процесс кристаллизации жидкой эвтектики завершается ее переходом в твердую эвтектику. Вследствие постоянства состава кристаллизация жидкой эвтектики протекает при постоянной температуре, как кристаллизация расплава индивидуального вещества. При температурах ниже точки o система двухфазна и состоит из кристаллов A и B.
Таким образом, кривая afho соответствует предельно охлажденной жидкой фазе и называется линией ликвидуса. Любая фигуративная точка системы, лежащая в области afhoc соответствует существованию равновесной двухфазной системы, состоящей из расплава двух компонентов и кристаллов A.
Если в исходном расплаве имеется избыток компонента B по сравнению с составом эвтектики, то в процессе охлаждения происходит выделение из расплава кристаллов B, а состав расплава меняется по линии ликвидуса bmo, и он постепенно обогащается компонентом A. В остальном процессы кристаллизации протекают аналогично описанным для компонента A.
При охлаждении расплава, состав которого точно соответствует составу эвтектики (фигуративная точка l), однофазная жидкая система сохраняется вплоть до достижения эвтектической точки o, где начинается кристаллизация двух компонентов одновременно. При этой температуре система проходит последовательно три состояния: одна фаза (расплав, s = 2) – три фазы (расплав, кристаллы A, кристаллы B; s = 0) – две фазы (кристаллы A, кристаллы B; s = 1).
Многие водные растворы солей представляют собой системы без химических соединений, при затвердевании они образуют эвтектические смеси. Затвердевшие эвтектические смеси воды и солей называются криогидратами. Водные растворы солей эвтектического состава используются для приготовления охлаждающих смесей. Эти смеси удобны тем, что они охлаждаются до определенной температуры (криогидратная температура), которая затем самопроизвольно поддерживается до тех пор, пока в системе есть еще не растаявший лед и не растворившаяся соль. Лед, постепенно плавясь, отнимает от системы теплоту, а соль, растворяясь в воде, образующейся изо льда, поддерживает в жидкой фазе концентрацию эвтектической смеси. Различные соли дают самые разнообразные криогидратные температуры. Например, криогидратная температура сульфата натрия (3,85% Na2SO4) равна –1,2 оС, хлорида натрия (22,42% NaСl) –21,2 оС, хлорида кальция (29,9% СaСl2) –55 оС.
Фигуративные точки, выражающие составы двух равновесных фаз, называют сопряженными точками (например, точки k и h, q и f), а кривые, образованные совокупностью этих точек – сопряженными кривыми (например, линии ac и ao). Сопряженные точки соединяются нодами.
Согласно правилу рычага (7.33), фигуративная точка системы, например, точка g, делит проходящую через нее ноду (kh) на два отрезка, длины которых обратно пропорциональны массам фаз, из которых состоит равновесная система:
![]() .
.
Правило рычага широко используется для вычисления масс сосуществующих фаз.
