
elektroxim
.pdfМІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ “ЛЬВІВСЬКА ПОЛІТЕХНІКА”
ЕЛЕКТРОХІМІЧНІ МЕТОДИ АНАЛІЗУ (ПОТЕНЦІОМЕТРІЯ, КОНДУКТОМЕТРІЯ, КУЛОНОМЕТРІЯ)
МЕТОДИЧНІ ВКАЗІВКИ
для студентів хімічних спеціальностей
Затверджено на засіданні кафедри аналітичної хімії
Протокол № 3 від 20.11.2008 р.
Львів ― 2008
Електрохімічні методи аналізу (потенціометрія, кондуктометрія, кулонометрія): Методичні вказівки для студентів хімічних спеціальностей. Укл.: Д.І.Семенишин, О.Я.Борова, Г.О.Маршалок, П.Й.Шаповал, І.П.Полюжин, М.М.Ларук. – Львів: Видавництво Національного університету „Львівська політехніка”, 2008. – 25 с.
Укладачі |
Семенишин Д.І., д-р хім. наук, проф. |
|
Борова О.Я., канд. хім. наук, доц. |
|
Маршалок Г.О., д-р техн. наук, доц. |
|
Шаповал П.Й., канд. хім. наук, доц. |
|
Полюжин І.П., канд. техн. наук, доц. |
|
Ларук М.М., канд. техн. наук, доц. |
Відповідальний за випуск |
Ятчишин Й.Й., д-р хім. наук, проф. |
Рецензенти |
Калимон Я.А., д-р хім. наук, проф. |
|
Цюпко Ф.І., канд. хім. наук, доц. |
2

1. ПОТЕНЦІОМЕТРИЧНИЙ МЕТОД АНАЛІЗУ
Метод визначення кількості речовини, оснований на вимірюванні потенціалу електроду, зануреного в досліджуваний розчин, називається потенціометричним.
Значення електрохімічного потенціалу залежить від природи речовин, концентрації (активності) їх іонів у розчині та температури. Ця залежність описується рівнянням Нернста:
|
0 |
|
RT |
lna |
|
|
|
0 |
|
RT |
ln |
aок |
|
|
|
|
|
|
|
n |
або ок |
ок |
|
|
|
, |
(1.1) |
||
|
nF |
M |
nF |
авідн |
||||||||||
|
|
|
|
|
|
відн |
відн |
|
|
|
де φ – потенціал індикаторного електрода при даній активності речовини; φ0 – стандартний потенціал; аМn+, аок, авідн - активності іонів металу, окисненої та відновленої форм речовини, відповідно; R – універсальна газова стала; Т – абсолютна температура; n – число електронів, які беруть участь у даній електрохімічній реакції.
Якщо R = 8,314 Дж/моль·К, Т = 298 К, F = 96485 Кл/моль і при переході до десяткового логарифму рівняння (1.1) записують у вигляді:
|
0 |
|
0,059 |
lga |
|
|
|
0 |
|
|
0,059 |
lg |
aок |
|
|
|
|
|
|
|
n |
або ок |
ок |
|
|
|
|
, |
(1.2) |
||
|
|
|
|
n |
авідн |
||||||||||
|
|
|
n |
M |
|
|
відн |
відн |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Ці залежності є основою потенціометричних методів аналізу ― прямої потенціометрії та потенціометричного титрування.
Аналітичним сигналом методу є значення величини потенціалу.
Оскільки значення потенціалу залежить не тільки від природи речовини, а й від її концентрації, тому потенціометричні методи не можуть бути використані для якісного аналізу.
В основі кількісного аналізу лежить лінійна залежність потенціалу електрода від логарифма концентрації (активності) аналізованої речовини, або логарифма відношення концентрацій (активностей) окисненої і відновленої форми цієї речовини.
Метод прямої потенціометрії оснований на вимірюванні точного значення електродного потенціалу і обчисленні концентрації визначуваних іонів. Пряма потенціометрія широко використовується для визначення концентрації водневих іонів в розчині за допомогою скляного індикаторного електрода та хлоридно-срібного електрода порівняння. Електрорушійна сила (ЕРС) такої комірки описується формулою:
ЕРС скл0 |
.ел ду 0,059pH . |
(1.3) |
3
Метод потенціометричного титрування ― це титриметричний метод аналізу, в якому точку еквівалентності визначають за зміною потенціалу індикаторного електрода в процесі титрування визначуваної речовини стандартним розчином відповідного реаґенту. Точка еквівалентності характеризується різкою зміною (стрибком) потенціалу.
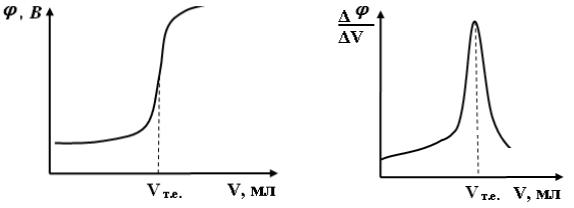
Характерна крива потенціометричного титрування показана на рис. 1, де по осі ординат відкладені значення потенціалу (φ, В) або рН розчину, а по осі абсцис ― об’єм титранту (V, мл). Графічно можна встановити точку еквівалентності (т.е.) як точку перетину перпендикуляра, опущеного з середини перегину кривої, з віссю абсцис. Якщо по осі ординат відкласти відношення φ/ΔV або pH/ΔV, то одержимо диференційну криву (рис. 2), яка дає можливість точніше визначити т.е. за максимумом на кривій титрування.
Рис. 1. Крива потенціометричного |
Рис. 2. Диференційна крива |
титрування |
потенціометричного титрування |
Потенціометричне титрування можна використати для аналізу мутних і забарвлених розчинів, слабких і дуже слабких кислот та основ, суміші кислот та основ різної сили, солей, багатоосновних кислот.
Переваги методу: висока точність, добра відтворюваність результатів, різка зміна потенціалу індикаторного електрода біля точки еквівалентності, відсутність індикаторної похибки, можливість титрування розбавлених розчинів та визначення кількох компонентів в суміші без розділення.
При потенціометричних вимірюваннях у досліджуваний розчин опускають два електроди ― індикаторний і порівняння, які з’єднують з приладом ― потенціометром, іономіром або рН-метром.
Індикаторні електроди ― це електроди, значення потенціалу яких залежить від концентрації (активності) визначуваної речовини, або від відношення концентрацій (активностей) окисненої і відновленої форм цієї речовини. Індикаторні електроди вибирають залежно від типу реакції та природи визначуваної речовини.
4
Уокисно-відновних реакціях використовують індиферентні платиновий або золотий електроди, які чутливі до зміни концентрації окисненої та відновленої форми досліджуваної речовини.
Уреакціях нейтралізації використовують скляний, водневий або хінгідронний електроди, які чутливі до зміни концентрації іонів водню.
Іоноселективні електроди мають високу специфічність до окремих іонів
(Cl–, Br–, I–, F–, NO3–, S2–, CN–, SCN–, PO43–, CO32–, NH4+, K+, Na+, Li+, Ca2+, Sr2+, Ba2+, Cu2+, Fe2+, Fe3+) і використовуються для їх визначення.
В реакціях осадження та комплексоутворення найчастіше використовують
металеві електроди із срібла і ртуті, які призначені для визначення концентрації Ag+, Hg2+, Cl–, Br–, I–, CN–.
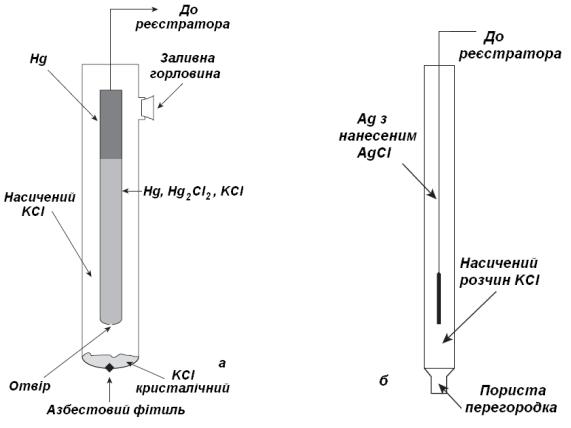
Електроди порівняння (стандартні електроди) ― це електроди, які мають відоме і постійне значення потенціалу при постійній температурі. Всі ці електроди є електродами другого роду, які містять метал в контакті з його малорозчинною сіллю, занурений в розчин електроліту з аніоном малорозчинної солі більшої концентрації. Найчастіше використовують насичений каломельний Hg, Hg2Cl2 | KCl || (рис. 3а) та хлоридно-срібний Ag, AgCl | KCl || (рис. 3б) електроди, які мають високу відтворюваність і є компактними.
Рис. 3. Електроди порівняння:
а - насичений каломельний; б - хлоридно-срібний
5
Експериментально можна виміряти лише різницю електрохімічних потенціалів, а не абсолютне значення потенціалу. Індикаторний електрод і електрод порівняння, сполучені послідовно, складають гальванічний ланцюг, ЕРС якого дорівнює:
ЕРС інд.ел. ел.пор. |
0 |
0,059 |
lgC . |
(1.4) |
|
||||
|
|
n |
|
|
За виміряним значенням ЕРС розраховують концентрацію іону.
Лабораторна робота № 1
ВИЗНАЧЕННЯ ВМІСТУ НСl І Н3РО4 ПРИ ЇХ СУМІСНІЙ ПРИСУТНОСТІ МЕТОДОМ ПОТЕНЦІОМЕТРИЧНОГО ТИТРУВАННЯ
Потенціометричне визначення вмісту НСl і Н3РО4 при їх сумісній присутності основане на різній силі цих кислот (НСl є сильною, а Н3РО4 ― набагато слабшою кислотою).
Константи іонізації ортофосфатної кислоти мають такі значення:
Н3РО4 Н+ + |
Н2РО4– |
К1 |
= |
7,6·10–3; |
рК1 |
= |
2,12 |
Н2РО4– Н+ + |
НРО42– |
К2 |
= |
6,2·10–8; |
рК2 |
= |
7,21 |
НРО42– Н+ + |
РО43– |
К3 |
= |
4,2·10–13; рК3 |
= |
12,36. |
|
При потенціометричному титруванні суміші одноосновних кислот різної сили сильною основою можна визначити вміст кожної кислоти без їх розділення, якщо відношення констант їх іонізації буде не менше, ніж 104, а константа іонізації слабшої кислоти ≥ 10–8.
При титруванні багатоосновних кислот на кривих титрування з’являється кілька точок перегину, що пояснюється ступінчатою іонізацією кислоти, продукти іонізації якої ведуть себе подібно до суміші кислот різної сили.
Тому на кривій потенціометричного титрування Н3РО4 розчином NaOH спостерігаються два стрибки, які відповідають нейтралізації Н3РО4 за І та ІІ ступенями. За ІІІ ступенем Н3РО4 не титрується, бо К3 < 10–8.
При потенціометричному визначенні вмісту НСl і Н3РО4 титруванням їх суміші розчином NаОН, будуть спостерігатися дві т.е., які на графіку зобразяться двома стрибками рН.
Перший стрибок рН відповідає відтитруванню НСl і Н3РО4 за І ступенем: НСl + NаОН = NаСl + Н2О,
Н3РО4 + NаОН = NaH2PO4 + H2O.
В першій т.е. в розчині знаходяться NаСl і NaH2PO4, тому величину рН1, яка визначається присутністю NaH2PO4, розраховують за формулою:
pH1 |
|
pK1 pK2 |
|
2,12 7,21 |
4,66. |
|
|
||||
|
2 |
2 |
|
||
|
|
|
6 |
|
|
Оскільки відношення констант іонізації НСl і Н3РО4 |
за І |
ступенем |
є |
||||||||||||||||||
меншим, ніж 104: |
|
|
K(HCl) |
|
|
|
|
1 |
|
1,32 102 104 , |
то |
хлоридна |
і |
||||||||
|
|
K |
(H |
PO ) |
7,6 10 3 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
1 |
3 |
|
4 |
|
|
|
|
|
|
|
|
|
|
|
||||
фосфатна кислота за І ступенем відтитровуються разом. |
|
|
|
||||||||||||||||||
Другий стрибок рН відповідає відтитруванню Н3РО4 за ІІ ступенем: |
|
||||||||||||||||||||
|
|
|
NaH2PO4 + NаОН = Na2HPO4 + H2O. |
|
|
||||||||||||||||
В другій т.е. в розчині знаходиться Na2НРO4 і рН розраховують за |
|||||||||||||||||||||
формулою: |
|
|
|
|
pK2 |
pK3 |
|
|
|
|
|
|
|
|
|
||||||
|
|
pH2 |
|
|
7,21 12,36 |
9,79. |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
Оскільки відношення констант |
іонізації H3PO4 за І |
та ІІ |
ступенем |
є |
|||||||||||||||||
більшим, ніж 104: |
K (H |
PO ) |
|
|
7,6 10 3 |
1,23 105 104 , тому H3PO4 титруєть- |
|||||||||||||||
|
1 |
3 |
4 |
|
|
|
|
|
|
|
|
||||||||||
K |
2 |
(H PO ) |
|
6,2 10 8 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
3 |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
ся окремо за цими ступенями. Титрування H3PO4 за ІІІ ступенем зафіксувати не можна, бо К3(H3PO4) = 4,2·10–13 < 10–8.
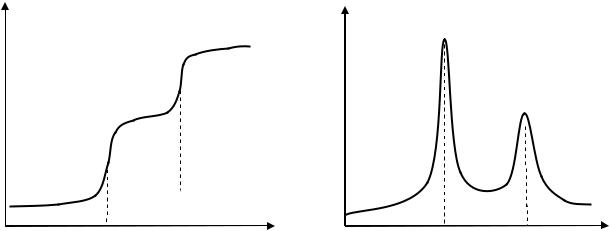
В результаті потенціометричного титрування суміші двох кислот різної сили одержують два стрибки рН на кривих титрування (Рис. 4).
pH |
ΔpH |
а |
ΔV |
б |
V1 |
V2 |
V, мл |
V1 |
V2 V, мл |
Рис. 4. Інтегральна (а) та диференційна (б) криві потенціометричного титрування суміші кислот різної сили.
Обладнання та реактиви
1.Установка для потенціометричного титрування (рН-метр, скляний та хлоридно-срібний електроди, штатив і бюретка).
2.Стандартний розчин натрій гідроксиду, 0,1÷0,2 М.
3.Буферні розчини з рН = 4,0 та 9,2.
4.Розчини хлоридної та ортофосфатної кислот, 0,1÷0,2 М.
7
Виконання роботи
Оскільки титрування кислот основане на реакції нейтралізації, то гальванічний елемент складають із скляного електроду, який є індикатором на іони Н+, і хлоридно-срібного електроду порівняння.
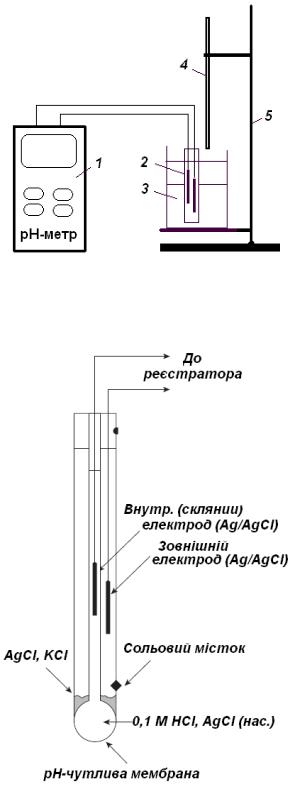
Установка для потенціометричного титрування зображена на рис. 5.
Рис. 5. Схема установки для потенціометричного титрування:
1 – рН-метр;
2 – скляний комбінований електрод;
3 – стакан з розчином;
4 – бюретка;
5 – штатив.
рН-Метр марки рН-150М призначений для потенціометричного вимірювання величини рН, окисно-відновного потенціалу (Eh, мВ) та температури водних розчинів.
Первинним перетворювачем є скляний комбінований електрод, потенціал якого залежить від концентрації (активності) іонів водню H+ та температури розчину. Скляний комбінований електрод, зображений на рис. 6, складається з двох електродів: вимірювального скляного (чутливий елемент ― поверхня скляної кульки) та порівняння - хлоридно-срібного.
Рис. 6. Електрод скляний комбінований (ЕСК).
8
Вимірювання рН. Вмикають прилад рН-150М в мережу електричного струму за допомогою блока живлення і готують його до роботи згідно з інструкцією.
Титрування суміші кислот. Заповнюють бюретку стандартним розчином NaOH. Наливають в чистий стакан досліджуваний розчин суміші кислот. Опускають в нього скляний комбінований електрод і додають дистильованої води стільки, щоб електрод був занурений в розчин приблизно на 2 см. На табло рН-метра висвітлюється початкове значення рН розчину, яке записують в таблицю.
Розчин NaOH додають з бюретки в стакан, перемішують протягом 5–10 с і
вимірюють значення рН. |
|
Розчин NaOH рекомендується додавати такими порціями: |
|
по 0,5 мл до досягнення рН = 2,5–3; |
|
по 0,1 мл в межах |
рН = 3–5,5; |
по 0,5 мл в межах |
рН = 5,5–7,5; |
по 0,1 мл в межах |
рН = 7,5–10; |
по 0,5 мл в межах |
рН = 10–11. |
Результати титрування заносять у таблицю і обчислюють |
рН, V, |
||||
pH/ΔV. |
|
|
|
|
Таблиця |
|
|
|
|
|
|
V(NaOH), мл |
рН |
рН |
V |
|
pH/ΔV |
|
|
|
|
|
|
За даними таблиці будують графіки в координатах рН – V та ΔpH/ΔV – V. За графіком знаходять об’єми NaOH (V1 та V2), що витрачаються на титрування досліджуваного розчину суміші кислот.
Розраховують вміст Н3РО4 і НСl в розчині, мг: m(Н3РО4) = (V2 – V1) · С(NaOH) · M(Н3РО4),
V2 – V1 = V3,
m(НСl) = (V1 – V3) · С(NaOH) · M(HCl),
де V1 - об’єм NaOH, який витрачається на титрування НСl і Н3РО4 за І ступенем; V2 – об’єм NaOH, який витрачається на титрування НСl і Н3РО4 за І і ІІ ступенем; V3 – об’єм NaOH, який витрачається на титрування Н3РО4, як одноосновної кислоти; (V1 – V3) – об’єм NaOH, який витрачається на титрування НСl
9
Лабораторна робота № 2
ВИЗНАЧЕННЯ ВМІСТУ ФЕРУМУ (ІІ) В СОЛІ МОРА МЕТОДОМ ПОТЕНЦІОМЕТРИЧНОГО ТИТРУВАННЯ
Аналіз основано на титруванні феруму (ІІ) калій дихроматом: 6 Fe2+ + Сr2O72– + 14 Н+ 6 Fе3+ + 2 Сr3+ + 7 Н2О
Стандартні окиснювально-відновні потенціали пар, що реаґують, мають
значення: φ0 (Fe3+/Fe2+) = +0,77 B; φ0(Cr2O7 |
2-+14H+/2Cr3+)= +1,33 B. |
|||||
При титруванні розчину феруму (ІІ) калій дихроматом потенціал |
||||||
окиснювально-відновної пари Fе3+/Fе2+ визначається рівнянням: |
||||||
(Fe3 /Fe2 ) 0(Fe3 /Fe2 ) |
0,059 |
lg |
[Fe3 |
] |
(до точки еквівалентності). |
|
|
|
|
||||
1 |
|
[Fe2 |
] |
|||
Значення потенціалу поступово зростає із збільшенням співвідношення [Fe3+]/[Fe2+], змінюється стрибкоподібно при повному окисненні Fe2+, тобто біля точки еквівалентності. Після точки еквівалентності потенціал змінюється плавно і незначно згідно з рівнянням:
(Cr O |
2 14H /2Cr3 ) 0(Cr O 2 |
14H /2Cr3 ) |
0,059 |
lg |
[Cr2O7 |
2 ] [H ]14 |
||
|
|
|
||||||
2 |
7 |
2 |
7 |
6 |
|
[Cr3 ]2 |
||
|
|
|
|
|
||||
Обладнання та реактиви
1.Установка для потенціометричного титрування, яка складається з рН-метра, платинового і насиченого каломельного електродів, штатива з мікробюреткою, магнітної мішалки, стаканчика для титрування.
2.Зразок солі Мора з невідомим вмістом феруму.
3.Стандартний розчин калій дихромату, С(16 К2Сr2О7) = 0,05 н.
4.Сульфатна кислота (1:4).
5.Фосфатна кислота, 30 %-ний розчин.
Виконання роботи
Масу наважки солі Мора беруть з такого розрахунку, щоб на титрування витрачалося ~6 мл 0,05 н розчину К2Сr2О7:
|
C(1 |
K Cr O ) V(K Cr O ) M((NH |
) |
Fe(SO ) |
2 |
6H |
O) |
|||
m |
6 |
2 2 7 |
2 2 7 |
4 |
2 |
4 |
2 |
|
, |
|
нав |
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
де mнав― маса наважки солі Мора, г; С( 16 К2Сr2О7) = 0,05 н; V ― об’єм розчину К2Сr2О7 (~6 мл); М((NH4)2Fe(SO4)2·6H2O) = 392,11 (г/моль-екв) ― молярна маса екв. солі Мора.
10
