
- •Енергозберігаючі технології
- •4. Основні термодинамічні процеси в ідеальних газах та їх аналіз
- •4.1. Ізохорний процес
- •За рівнянням першого закону термодинаміки
- •4.2. Ізобарний процес
- •4.3. Ізотермічний процес
- •4.4. Адіабатний (ізоентропійний) процес
- •4.5. Політропний процес
- •5. Процеси течіння газів та рідин
- •5.1. Рівняння I-го закону термодинаміки для потоку робочого тіла (відкрита система)
- •Запишемо рівняння (5.8) у вигляді
- •5.2. Витікання газів та пари із сопел, які звужуються.
- •5.2.1. Швидкість руху потоку робочого тіла
- •Рівнянням:
- •5.2.2. Швидкість звуку
- •5.2.3. Перехід через швидкість звуку. Сопло Лаваля
- •5.3. Дроселювання газів і парів. Ефект Джоуля –Томсона
- •6. Процеси стиснення газу в компресорі
- •7. Способи охолодження робочого тіла.
- •7.1. Ізоентальпійне розширення робочого тіла (дроселювання)
- •7.2. Адіабатне розширення робочого тіла з віддачею зовнішньої роботи (детандування)
- •7.3. Аналіз ідеальних процесів розширення робочого тіла в детандерах
- •Література
- •Навчальне видання
- •Енергозберігаючі технології
4.5. Політропний процес
Термодинамічний процес, який протікає в ідеальному газі (фізичній системі) при постійній теплоємності, називається політропним.
Цей процес характеризується заданим коефіцієнтом - розподілення теплоти між зміною внутрішньої енергії робочого тіла u та виконаною ним роботою l. Політропний процес є узагальнюючим, оскільки значення показника політропи визначає характер процесу і можна доказати, що всі процеси, які ми розглянули раніше, є лише окремими його випадками.
1. Рівняння політропного процесу.
Для виведення рівняння політропного процесу використаємо рівняння 1-го закону термодинаміки:
в 1-ій формі запису
dq = du + pd;
в 2 -ій формі запису
dq = di - dp.
Відомо, що
du = C•dT (а)
та
di = Cp•dT. (б)
Виходячи із поняття теплоємності політропного процесу Сп запишемо кількість теплоти політропного процесу:
dqп = Cп dT. (в) (4.55)
Підставивши формули (а), (б) та (в) в попередні вирази отримаємо наступні рівняння 1-го закону термодинаміки.
В 1-шій формі запису:
dqп = C••dT + p•d
та
Cп••dT = C•dT + p•d;
в 2-гій формі запису:
dqп = Cp•dT - •dp
та
Cп•dT = Cp•dT - •dp.
Отримані рівняння запишемо у вигляді:
1-ша форма запису:
(Cп - C)•dT = p•d, (г)
2-га форма запису:
(Сп - Сp)•dT = - •dp. (д)
Поділивши рівняння (д) на рівняння (г) отримаємо значення показника політропи:
(Сп - Сp)/(Cп - C) = n; (4.56)
- •dp/p•d = n. (4.57)
де n- коефіцієнт політропи.
Перепишемо рівняння (4.57) у вигляді:
- •dp = n•p•d,
або
n•p•d + •dp = 0.
Поділивши останнє рівняння на вираз (p•) отримаємо:
(n•p•d/p•) + (•dp/ p•) = 0,
звідки
(n•d/) + (dp/ p) = 0.
Прологарифмуємо останнє рівняння і отримуємо рівняння політропного процесу:
n•ln + lnp = 0, (4.58)
або
ln(p•n) = 0. (4.59)
Звідки, рівняння стану політропного процесу, тобто закон взаємозв’язку між термічними параметрами в політропному процесі має вигляд:
p•n =const. (4.60)
2. Зв'язок між параметрами політропного процесу.
Отже, рівняння стану політропного процесу , тобто закон взаємозв’язку між термічними параметрами в політропному процесі має вигляд, ф.(4.60):
p•n = const.
Звідки
p1/p2 = (2/l)n;
T2/T1 = (/2)(n-l);
T2/T1 = (p2/p1)(n- 1)/n . (4.61)
Тоді показник політропи можна обчислити за рівняння:
n = ln(pl/p2)/ln(2/l). (4.62)
Варто зазначити, що рівняння (4.60) справедливе як для ідеального, так і для реального процесів, в той час як рівняння (4.61) та (4.62) справедливі тільки для ідеального процесу.
Таким чином, рівняння (4.60) є узагальнюючим по відношенню до розглянутих нами термодинамічних процесів.
Показник політропи, як і показник адіабати, залежить від теплоємності газу. Являючись для конкретного газу постійною величиною він може змінюватись в широких межах. Тобто
+ > n > -
Теплоємність робочого тіла в політропному процесі.
Запишемо рівняння (4.56)
n = (Cn - Cp)/(Cn - C) та k = Cp/C,
або у вигляді
n•(Cn - C) = Cn - Cp та k•C = Cp.
Зробимо відповідну підстановку і отримаємо
n = (Cn - k•C)/(Cn - C).
Розділивши це рівняння на (C) ми отримаємо:
n = (n – k)/(n – 1)
або, так як n = Cn/C, то
Cn = C••(n - k)/(n - 1). (4.63)
Робота розширення ідеального газу в політропному процесі.
В загальному вигляді роботу розширення робочого тіла (газу) в процесі 1-2 запишемо у вигляді:
l1-2 = 12 p•d.
В цей вираз підставимо рівняння p = p1•1n/n і отримаємо :
l1-2 = 12 pl•ln •d/n = pl•l•1 – (1/2)(n – 1)/(n - 1). (4.64)
Зробивши відповідні заміни в цьому рівнянні рівняннями (4.61) ми отримаємо:
l пол.= Ri•(T1 - T2)/(n - 1) = (p1•1 -.p2•2)/(n - 1) =
= pl•l 1 – (p2/p1) (n – 1)/n/(n - 1). (4.65)
5. Теплота політропного процесу.
Теплоту процесу розраховують в загальному за рівнянням:
q1-2 = 12 C•dT.
Для політропного процесу
Cп = C•(n - k)/(n - 1),
тоді
qпол = 1 2 C (n-k)/(n-1)•d = C•(2 - 1)(n-k)/(n-1). (4.66)
Або
q2-1= (u2 - u1) + l1-2. (4.67)
6. Зміни внутрішньої енергії, ентальпії та ентропії не залежать від процесу, тому для довільного процесу їх можна обчислити за відомими формулами:
-зміна внутрішньої енергії
duпол = C •dT,
-зміна ентальпії
diпол = Cp•dT
-зміна ентропії
s2 - s1 = C•ln(T2/T1) + Ri ln(2/1)
або у вигляді
s2 - s1 = C• ln(T2/T1) - Ri• ln(p2/p1).
Поряд з останнім рівнянням при дослідженні політропного процесу використовується наступна формула:
s = 1 2 C•(n - k)/(n - 1)•dT/T = C••(n - k)/(n - 1)•ln(T2/T1). (4.68)
Частка теплоти, яка тратиться на зміну внутрішньої енергії газу в політропному процесі:
пол = u/q = C•/C••(n - k)/(n - 1) = (n - 1)/(n - 1). (4.69)
8. Частка теплоти, яка витрачається на виконання роботи в політропному процесі:
= l/q = 1 - пол = (1 – k)/(k – n). (4.70)
9. Графічне зображення політропного процесу:
З рівняння стану політропного процесу p• n = const, для різних значень показника політропи отримаємо наступні вирази:
n = 0; p•0 = p = const - ізобара.
n = ; p• = const; p1/• = const; = const - ізохора.
n = 1; p•1 = const; T = const - ізотерма.
n = k; p•k = const - адіабата.
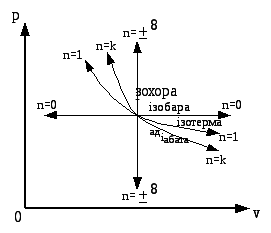
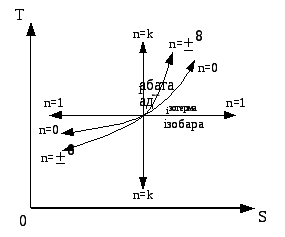
Рис. 4.7. Графічне зображення політропного (узагальнюючого) процесу в p- (а) та -s (б) координатах
