
- •Енергозберігаючі технології
- •4. Основні термодинамічні процеси в ідеальних газах та їх аналіз
- •4.1. Ізохорний процес
- •За рівнянням першого закону термодинаміки
- •4.2. Ізобарний процес
- •4.3. Ізотермічний процес
- •4.4. Адіабатний (ізоентропійний) процес
- •4.5. Політропний процес
- •5. Процеси течіння газів та рідин
- •5.1. Рівняння I-го закону термодинаміки для потоку робочого тіла (відкрита система)
- •Запишемо рівняння (5.8) у вигляді
- •5.2. Витікання газів та пари із сопел, які звужуються.
- •5.2.1. Швидкість руху потоку робочого тіла
- •Рівнянням:
- •5.2.2. Швидкість звуку
- •5.2.3. Перехід через швидкість звуку. Сопло Лаваля
- •5.3. Дроселювання газів і парів. Ефект Джоуля –Томсона
- •6. Процеси стиснення газу в компресорі
- •7. Способи охолодження робочого тіла.
- •7.1. Ізоентальпійне розширення робочого тіла (дроселювання)
- •7.2. Адіабатне розширення робочого тіла з віддачею зовнішньої роботи (детандування)
- •7.3. Аналіз ідеальних процесів розширення робочого тіла в детандерах
- •Література
- •Навчальне видання
- •Енергозберігаючі технології
4.3. Ізотермічний процес
Ізотермічний процес - процес, який відбувається у фізичній системі при постійній температурі (T = const, dT = 0).
Приклад: перехід робочого тіла (газу) із рідкого (скрапленого) стану у пароподібний і навпаки - скраплення газоподібного робочого тіла (конденсація). Ці процеси відбуваються при постійній температурі.
![]()
Графічне зображення ізотермічного процесу
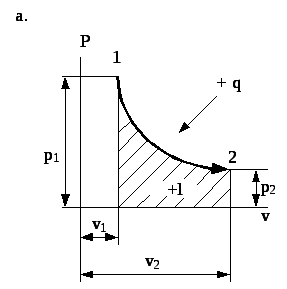
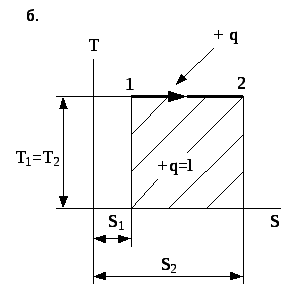
Рис. 4.5. Зображення ізотермічного процесу в P- та T-s координатах.
Зв’язок між параметрами.
Рівняння Клапейрона p•/T = const при T = const приймає вигляд
p• = const тa p• = Ri T = const.
Рівняння стану ізотермічного процесу (за рівнянням Бойля- Маріотта) можна записати у вигляді:
pl•l
= p•
або
pl/p
= /![]() l .
(4.26)
l .
(4.26)
Залежність об’єму від тиску на ізотермі в p- - координатах для ідеального газу має характер рівнобокої гіперболи (рис. 4.5а). Тобто, в ізотермічному процесі при підвищенні тиску газу його об’єм зменшується.
3. Робота розширення системи від стану 1 до стану 2 визначається із загального рівняння:
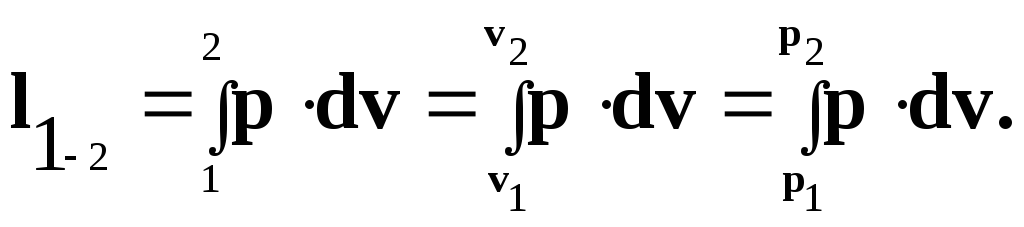 (4.27)
(4.27)
Для ідеального газу дане рівняння можна представити у такому вигляді:
![]() (4.27
a)
(4.27
a)
Для ізотермічного процесу ці рівняння можна записати наступним чином:
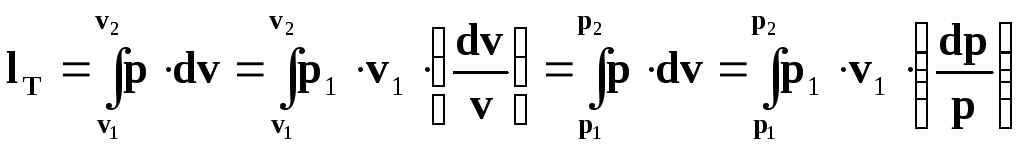 (4.28)
(4.28)
Звідки
![]() (4.29)
(4.29)
lт = Ri•T•ln(/l) = Ri•T•ln(р/рl). (4.30)
На графіку в p- - координатах робота розширення газу (робочого тіла) зображається площею під кривою 1-2 (рис. 4.5а).
4. Теплота в ізотермічному процесі.
Кількість теплоти, яка підводиться до системи (або відводиться від неї) знайдемо, виходячи із загального рівняння ІІ-го закону термодинаміки:
dq = T•ds,
але так як T = const, то
qт = T(s2 - s1). (4.31)
Запишемо рівняння 1-го закону термодинаміки в І-ій формі:
dq = du + dl,
але в нашому випадку T = const, то
du = C•dT = 0,
але dT = 0, тоді
dqт = C•dT + dlт = dlт, або dqт =dlт, (4.32)
де роботу необхідно визначити за рівнянням (4.30).
В умовах ізотермічного процесу вся підведена до робочого тіла теплота витрачається на виконання ним роботи. На T-s -діаграмі кількість теплоти визначається площею під лінією 1-2-(прямокутник із основою s та висотою T).
Теплоємність в ізотермічному процесі.
Відомо, що
C = dq/dT,
але в ізотермічному процесі
dT = 0,
тоді
Ст = ± ∞. (4.33)
Тобто, для ізотермічного процесу, для якого підведення або відведення теплоти не призводить до зміни температури системи, теплоємність ідеального газу нескінченно велика. Знак «плюс» відповідає підведенню теплоти до системи, знак «мінус» – відведенню теплоти від системи.
Зміна ентропії в ізотермічному процесі.
Зміну ентропії в ізотермічному процесі 1-2 визначимо за рівнянням:
ds = dq/T, але dqт =dlт,
то можна записати, враховуючи рівняння (4.30):
dsт = dlт/T,
s = l/=q/.
Або, враховуючи рівняння (4.30), отримаємо:
s2 - s1 = Ri ln(2/1)= Ri•ln(p1/p2). (4.34)
Зміна внутрішньої енергії та ентальпії робочого тіла в ізотермічному процесі.
Із визначення: внутрішня енергія ідеального газу не залежить від об’єму, а залежить тільки від температури. Тобто
dU = C d, або U = C• - .
Але в ізотермічному процесі dT = 0, тобто
T = const,
тому
U2 = U1.
Отже
ΔU = 0. (4.35)
А також
i = Cp• - = 0,
тобто
i = i - i або i = i.
Отже
i = 0. (4.36)
Таким чином, в ізотермічному процесі внутрішня енергія та ентальпія ідеального газу залишаються постійними.
Частка теплоти, яка затрачається на зміну внутрішньої енергії газу (робочого тіла).
Відомо, що α = Δu/q, але для ізотермічного процесу = const звідки
Δu = 0,
тому
αт = 0. (4.37)
Тобто, в ізотермічному процесі підведена до робочого тіла теплота витрачається тільки на виконання ним роботи , так як зміни його внутрішньої енергії не буде.
