
- •Енергозберігаючі технології
- •4. Основні термодинамічні процеси в ідеальних газах та їх аналіз
- •4.1. Ізохорний процес
- •За рівнянням першого закону термодинаміки
- •4.2. Ізобарний процес
- •4.3. Ізотермічний процес
- •4.4. Адіабатний (ізоентропійний) процес
- •4.5. Політропний процес
- •5. Процеси течіння газів та рідин
- •5.1. Рівняння I-го закону термодинаміки для потоку робочого тіла (відкрита система)
- •Запишемо рівняння (5.8) у вигляді
- •5.2. Витікання газів та пари із сопел, які звужуються.
- •5.2.1. Швидкість руху потоку робочого тіла
- •Рівнянням:
- •5.2.2. Швидкість звуку
- •5.2.3. Перехід через швидкість звуку. Сопло Лаваля
- •5.3. Дроселювання газів і парів. Ефект Джоуля –Томсона
- •6. Процеси стиснення газу в компресорі
- •7. Способи охолодження робочого тіла.
- •7.1. Ізоентальпійне розширення робочого тіла (дроселювання)
- •7.2. Адіабатне розширення робочого тіла з віддачею зовнішньої роботи (детандування)
- •7.3. Аналіз ідеальних процесів розширення робочого тіла в детандерах
- •Література
- •Навчальне видання
- •Енергозберігаючі технології
4. Основні термодинамічні процеси в ідеальних газах та їх аналіз
Тема носить чисто теоретичний характер, але ми докажемо її практичне застосування. Аналіз будь-якого термодинамічного процесу проводиться з метою виявлення особливостей перетворення енергії та закономірностей зміни параметрів робочого тіла.
Для цього аналіз процесів проведемо в такому порядку:
виведемо рівняння процесу в p-V - координатах;
вияснимо залежність між основними термодинамічними параметрами (p,V,T);
визначимо зовнішню теплоту для здійснення процесу Q;
визначимо термодинамічну роботу процесу L;
вияснимо залежності калоричних параметрів (U, I, C, S);
зобразимо процес в p-V та T-S - координатах.
Отримані дані дозволять вияснити особливості перетворення енергії для конкретних процесів, скласти схему енергобалансу, тобто вияснити на що і в яких пропорціях затрачається тепло в кожному процесі, та визначити частку теплоти, яка затрачається на зміну внутрішньої енергії робочого тіла:
![]() (4.1)
(4.1)
Процеси в газах проходять при зміні p,V,T (термічні параметри) і в залежності від них змінюються калоричні параметри U, I, C, S.
Розрізняють п’ять ідеальних термодинамічних процесів в газах:
ізохорний процес V = const;
ізобарний процес p = const;
ізотермічний процес T = const;
адіабатичний процес Q = const;
політропний процес - узагальнюючий.
4.1. Ізохорний процес
Ізохорний процес - процес, який проходить у фізичній системі при постійному об’ємі (V = const, dV = 0).
Приклад: процеси, які проходять в наземному резервуарі для зберігання газу (газгольдері) під впливом зовнішніх природних явищ нагрівання та охолодження.
Газгольдери - резервуари кулястої або циліндричної форми (D = H) діаметр яких D = 20...50 м.
Рис. 4.1. Схема ізохорного газгольдера
Проаналізуємо параметри газу, при його переході від стану 1 до стану 2.
1. Графічне зображення ізохорного процесу.
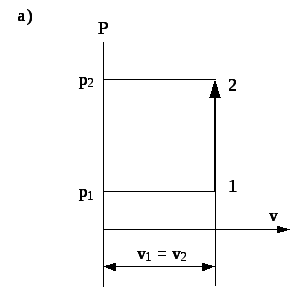
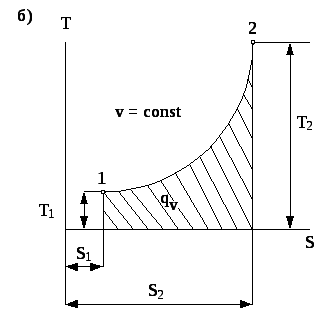
Рис. 4.2. Зображення ізохорного процесу в координатах p- v (а) та T- s (б)
Зв'язок між параметрами.
Із характеристичного рівняння стану ідеального газу (рівняння Клапейрона):
![]() або
або
![]() ,
але
,
але
![]() тоді
тоді
![]() .
.
Звідси
![]() або
або
![]() . (4.2)
. (4.2)
Тобто, при підвищенні температури газу його тиск зростає.
3. Робота, яка здійснюється в процесі робочим тілом (газом).
Відомо, що при підведенні до системи теплоти газ розширюється і при цьому виконує роботу розширення, яка дорівнює:
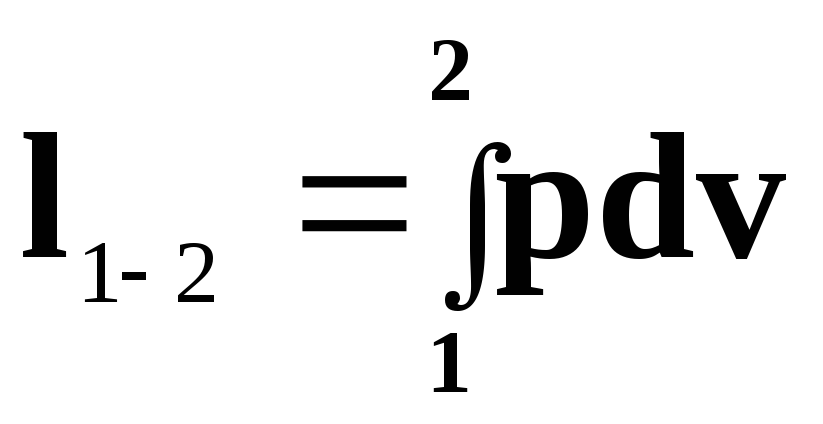 ,
але d
= 0
тому що
= const.
,
але d
= 0
тому що
= const.
Отже
lv = 0. (4.3)
На p-v діаграмі процес розширення зображається прямою, яка паралельна до осі ординат (рис. 4.2а). Звідки випливає, що робота в ізохорному процесі дорівнює нулю.
4. Теплота ізохорного процесу
Із першого закону термодинаміки відомо, що
dq = du + pd, але pd = 0
тоді
dqv = du або qv = u1 – u2,
тобто
qv = u. (4.4)
А також
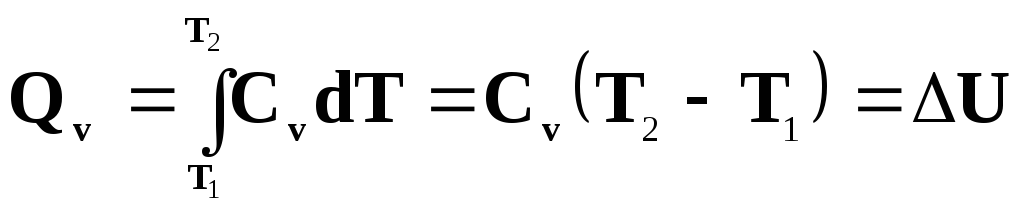 .
(4.5)
.
(4.5)
Кількість теплоти, яка підводиться до робочого тіла в ізохорному процесі дорівнює різниці його внутрішніх енергій. На T-s -діаграмі (рис. 4.2б) ця кількість теплоти еквівалентна площі під кривою процесу розширення 1-2.
5. Теплоємність газу в ізохорному процесі.
В загальному випадку теплоємність газу можна розрахувати за рівнянням:
![]() ,
,
але для ізохорного процесу dq = du звідки
![]() .
(4.6)
.
(4.6)
Зміна ентропії в ізохорному процесі.
Зміна ентропії системи визначається за рівнянням:
![]()
![]() ,
,
а також
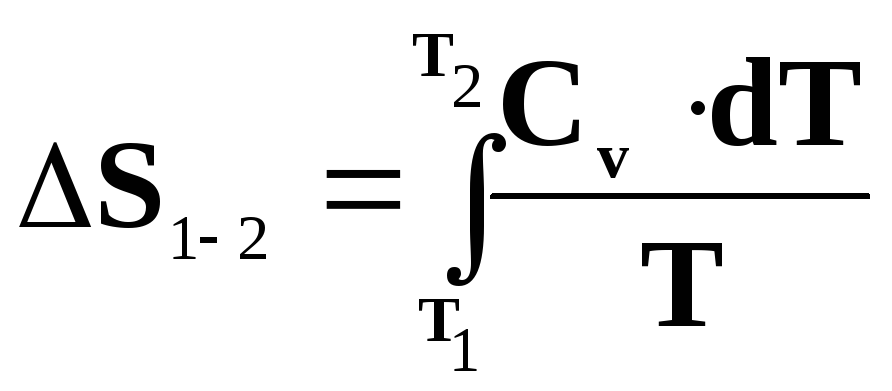 .
.
Для ізохорного процесу зміну ентропії можна записати у вигляді:
![]() ,
(4.7)
,
(4.7)
а також
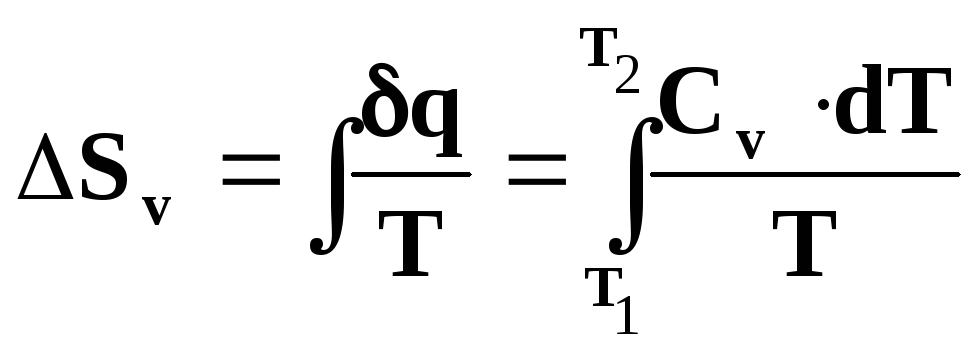 (4.8)
(4.8)
Отже, в координатах T-s ізохорний процес зображається логарифмічною кривою 1-2.
7. Зміна внутрішньої енергії робочого тіла(газу) в ізохорному процесі.
