
- •Енергозберігаючі технології
- •4. Основні термодинамічні процеси в ідеальних газах та їх аналіз
- •4.1. Ізохорний процес
- •За рівнянням першого закону термодинаміки
- •4.2. Ізобарний процес
- •4.3. Ізотермічний процес
- •4.4. Адіабатний (ізоентропійний) процес
- •4.5. Політропний процес
- •5. Процеси течіння газів та рідин
- •5.1. Рівняння I-го закону термодинаміки для потоку робочого тіла (відкрита система)
- •Запишемо рівняння (5.8) у вигляді
- •5.2. Витікання газів та пари із сопел, які звужуються.
- •5.2.1. Швидкість руху потоку робочого тіла
- •Рівнянням:
- •5.2.2. Швидкість звуку
- •5.2.3. Перехід через швидкість звуку. Сопло Лаваля
- •5.3. Дроселювання газів і парів. Ефект Джоуля –Томсона
- •6. Процеси стиснення газу в компресорі
- •7. Способи охолодження робочого тіла.
- •7.1. Ізоентальпійне розширення робочого тіла (дроселювання)
- •7.2. Адіабатне розширення робочого тіла з віддачею зовнішньої роботи (детандування)
- •7.3. Аналіз ідеальних процесів розширення робочого тіла в детандерах
- •Література
- •Навчальне видання
- •Енергозберігаючі технології
4.4. Адіабатний (ізоентропійний) процес
Адіабатний процес – такий термодинамічний процес, що відбувається у фізичній системі, яка не отримує та не віддає теплоту, тобто в даній системі відсутній теплообмін між робочим тілом та навколишнім середовищем. Отже
dq = 0, q = const
та
ds = const, s = const.
Приклад: процеси стискання газу (робочого тіла), які відбуваються настільки швидко, що теплота не встигає передатися від нього до навколишнього середовища та навпаки.
1. Графічне зображення процесу:
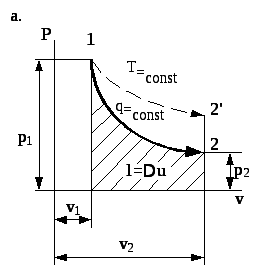
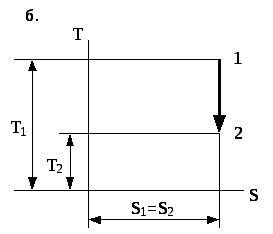
Рис. 4.6. Зображення адіабатичного процесу в координатах p- та T-s
Зв’язок між параметрами газу - рівняння стану адіабатичного процесу.
Запишемо рівняння 1-го закону термодинаміки
в 1-ій формі:
dq = du + pd,
де
du = C dT,
та в 2-ій формі :
dq = di - dp,
де
di = Cp dT.
Але в адіабатичному процесі dqад = 0. Тоді ці рівняння можна записати у вигляді:
C dT = -pd (a)
та
Cp•dT = •dp (б).
Знайдемо відношення цих величин поділивши рівняння (б) на (а):
Cp•dT/ C dT = - •dp/ pd,
тобто
Cp/C = •dp/ pd.
Звідки
k = Cp/C,, (4.38)
або
k = - •dp/ pd, (4.39)
де k - показник адіабати.
Отже
k•p•d = •dp. (4.40)
Шляхом інтегрування останнього рівняння отримаємо рівняння Пуассона:
p•k = const. (4.41)
Отже, в координатах p- адіабата зображається нерівнобокою гіперболою p•k = const, а так як k 1, то адіабата 1-2 буде розміщена крутіше ізотерми 1-2 (рис. 4.6а). Звідси випливає, що при однаковому ступені розширення
ад т.
Таким чином, рівняння, які описують зв'язок між параметрами стану ідеального газу в адіабатному процесі, будуть мати наступний вигляд:
2/1 = (p1/p2)1/k;
p1/p2 = (2/1)k;
T1/T2 = (2/1)k-1;
T1/T2 = (p1/p2)(k-1)/k, (4.42)
де k - показник адіабати (ізоентропи).
3. Робота розширення системи.
Із рівняння
dq = du + pd
очевидно, що для будь-якого адіабатного процесу (dq = 0) справедливо
duад = -p•d. (4.43)
Отже, відсутність теплообміну при протіканні адіабатного процесу вказує на те, що робота розширення ідеального газу здійснюється за рахунок зменшення внутрішньої енергії газу:
lад = -(u - u = u1 - u2. (4.44)
Але відомо, що
du = C•d,
тоді
lад = C•( - ). (4.45)
Отже, адіабатне розширення ідеального газу викликає зниження його температури, а стиснення - підвищення.
Але p• = Ri T, тоді
lад = C•(p1•1 – p2•2)/Ri. (4.46)
Але Ri = C•(k-1), тоді
lад = (p1•1 – p2•2)/(k-1) = Ri T•[1 - (p1/p2)(k-1)/k]/(k-1) =
= p1•1•[1-((p1/p2)(k-1)/k)]/(k-1). (4.47)
На p- -діаграмі (рис. 4.6а) робота розширення робочого тіла буде еквівалентна площі під кривою процесу 1-2.
4. Кількість теплоти, підведеної до системи (робочого тіла) в адіабатному процесі.
Із визначення оборотного адіабатного процесу: кількість теплоти, яка підводиться в ізотермічному процесі до робочого тіла або відводиться від нього, дорівнює нулю.
dqад = 0, та qад = const. (4.48)
Теплоємність газу в адіабатному процесі
Із визначення теплоємності: C = dq/dT , але для адіабатного процесу
dqад = 0,
тоді
Cад = 0 = const. (4.49)
Цей висновок очевидний: якщо в системі здійснюється адіабатний процес, то температура в системі змінюється, хоча теплота до системи і не підводиться (тобто, ця зміна відбувається тільки за рахунок зміни внутрішньої енергії робочого тіла).
Зміна ентропії газу в адіабатному процесі.
Із визначення ентропії: ds= dq/T, але оскільки в адіабатному процесі
dsад. = q/, а qад. = 0, то для нього справедливий наступний запис:
dsад = 0, або S = const, (4.50)
тобто, оборотний адіабатний процес є процесом ізоентропійним. Отже, в координатах -s (рис. 4.6б) адіабатний процес зобразиться у вигляді прямої, яка паралельна до осі ординат.
7. Зміна внутрішньої енергії та ентальпії робочого тіла (газу) в адіабатному процесі.
Зміна внутрішньої енергії робочого тіла (газу) та виконана ним робота рівні за величиною, але протилежні за знаком. Тобто,
uад = - lад; (4.51)
а також
du = C dT,
тобто
uад = C (T2 - T1). (4.52)
Зміна ентальпії газу в адіабатному процесі:
di = Cp•dT,
тобто
iад = Cp•(T2-T1). (4.53)
Частка теплоти, яка затрачається на зміну внутрішньої енергії газу в адіабатному процесі.
ад = uад/qад = - lад/qад. (4.54)
Отже, в адіабатному процесі внутрішня енергія системи змінюється не за рахунок підведеної теплоти (яка не підводиться і не відводиться, тобто qад = 0), а тільки за рахунок виконаної робочим тілом роботи.
