
- •Енергозберігаючі технології
- •4. Основні термодинамічні процеси в ідеальних газах та їх аналіз
- •4.1. Ізохорний процес
- •За рівнянням першого закону термодинаміки
- •4.2. Ізобарний процес
- •4.3. Ізотермічний процес
- •4.4. Адіабатний (ізоентропійний) процес
- •4.5. Політропний процес
- •5. Процеси течіння газів та рідин
- •5.1. Рівняння I-го закону термодинаміки для потоку робочого тіла (відкрита система)
- •Запишемо рівняння (5.8) у вигляді
- •5.2. Витікання газів та пари із сопел, які звужуються.
- •5.2.1. Швидкість руху потоку робочого тіла
- •Рівнянням:
- •5.2.2. Швидкість звуку
- •5.2.3. Перехід через швидкість звуку. Сопло Лаваля
- •5.3. Дроселювання газів і парів. Ефект Джоуля –Томсона
- •6. Процеси стиснення газу в компресорі
- •7. Способи охолодження робочого тіла.
- •7.1. Ізоентальпійне розширення робочого тіла (дроселювання)
- •7.2. Адіабатне розширення робочого тіла з віддачею зовнішньої роботи (детандування)
- •7.3. Аналіз ідеальних процесів розширення робочого тіла в детандерах
- •Література
- •Навчальне видання
- •Енергозберігаючі технології
За рівнянням першого закону термодинаміки
dq = du + dl = du + pd, але dl = 0,
тоді
dqv = du та qv = u. (4.9)
Отже
duv = CvdT,
або
Δu = qv = Cv (T2-T1). (4.10)
Частка теплоти, яка затрачається в ізохорному процесі на зміну внутрішньої енергії робочого тіла:
![]() .
.
Для ізохорного процесу вираз, що описує алгоритм розподілення теплоти, яка підводиться до робочого тіла, має вигляд:
![]()
Вся теплота, яка підводиться до системи ідеального газу в ізохорному процесі, затрачається на зміну його внутрішньої енергії.
Практичне
застосування - розрахунок необхідної
товщини стінки газгольдера при збільшенні
тиску в системі в результаті підведення
теплоти до газу, який знаходиться в
ньому
![]() .
.
4.2. Ізобарний процес
Ізобарний процес - процес, який відбувається у фізичній системі при постійному тиску (р = const, dр = 0).
Приклад: процеси, які проходять в спеціальній споруді для зберігання газу в ізобаричних умовах (в ізобаричному газгольдері).
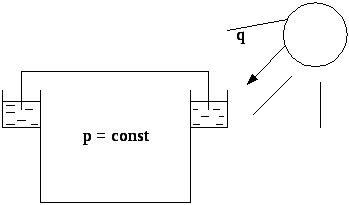
При нагріванні Сонцем газ розширюється, його об’єм збільшується і кришка апарата піднімається підтримуючи тиск в апараті постійним.
Рис. 4.3. Схема ізобарного газгольдера
Графічне зображення ізобарного процесу.

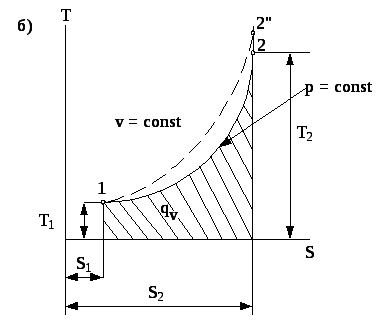
Рис. 4.4. Зображення процесу в координатах p- v (а) та T-s (б).
2. Зв’язок між параметрами.
Рівняння стану ідеального газу p/T = const для ізобарного процесу приймає вигляд:
![]() .
(4.11)
.
(4.11)
А також
![]() або
або
![]() .
(4.12)
.
(4.12)
Тобто, при зростанні температури газу пропорційно зростає і його об’єм.
Робота ізобарного процесу.
Робота розширення системи в ізобарному процесі 1-2 при p = const розраховують за рівнянням:
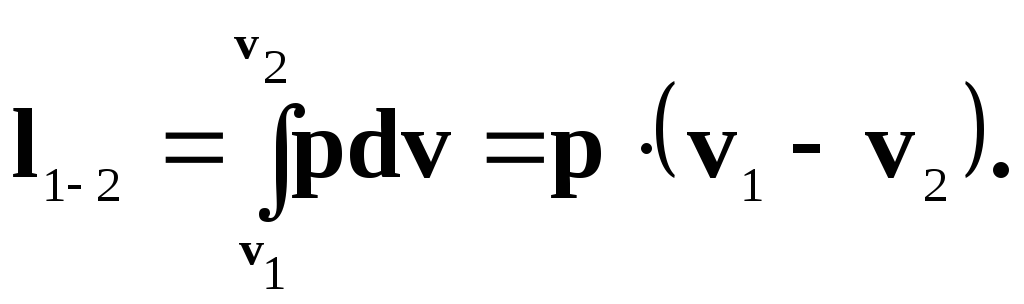
Для ізобарного процесу (р = const) робота розширення газу буде дорівнювати:
![]() (4.13)
(4.13)
Але так як pv = RіT, то
![]() (4.14)
(4.14)
На p- - діаграмі площа заштрихованого прямокутника (рис. 4.4а) буде еквівалентна роботі ізобарного процесу (роботи розширення газу)
Теплота ізобарного процесу.
Кількість теплоти, яка підводиться до системи при нагріванні газу в ізобарному процесі визначимо із наступних міркувань.
Із рівняння 1-го закону термодинаміки (2-гої форми запису)
dq = di - dp
випливає, що для ізобарного процесу (dp = 0)
dqp = di, або qp = Δi. (4.15)
Значить, кількість теплоти, підведеної до робочого тіла (газу) в ізобарному процесі, дорівнює різниці ентальпій.
Кількість теплоти можна підрахувати також із наступних рівнянь:
![]() ,
або
,
або
![]() ,
,
звідки
![]() ,
або
,
або
![]() qp
=
Cp∙∙T. (4.16)
qp
=
Cp∙∙T. (4.16)![]()
На
T-s
-
діаграмі
(рис. 4.4б) цей процес зображається кривою
1-2, а
заштрихована
площа, яка знаходиться під цією кривою
еквівалентна кількості теплоти, яка![]() підводиться до системи в ізобарному
процесі.
підводиться до системи в ізобарному
процесі.
5. Зміна ентропії ідеального газу в ізобарному процесі (при Cp = const) описується наступним рівнянням:
dsp = dqp/T = Cp•dT/T. (4.17)
Проінтегруємо дане рівняння та отримаємо:
sp = Cp•ln(T/T) = Cp •ln(/). (4.18)
Звідси випливає, що в координатах T-s процес зображається логарифмічною кривою 1-2 (рис. 4.4б).
Розраховуємо зміну ентропії, використовуючи рівняння 1-го закону термодинаміки (1-шу форму запису):
dq = du + pd
та рівняння Клапейрона:
p• = Ri T або p/T = Rі/.
Тоді
dsp = dqp/T = (du + pd)/T = du/T + pd/T.
Нами вже доказано (рівняння 4.6), що du = C•dT, а також відомо, що p/T = Ri/, тоді попереднє рівняння запишемо у вигляді:
dsp = C dT/T + Ri d/, (4.19)
або, логарифмуючи це рівняння, отримаємо:
s – s1 = C ln(T/T1) + Ri•ln(/1)=C•ln(T/Tl) + Ri•ln(T/Tl) =
= C•ln(/l) + Ri•ln(/l)=C•ln(/l) + Ri•ln(T/Tl). (4.20)
Отже, теплота в ізобарному процесі тратиться на зміну внутрішньої енергії та виконання роботи. Тобто
ΔS = ΔU + L або s = u + l.
Теплоємність газу в ізобарному процесі.
В загальному вигляді C = dq/dT. Але в ізобарному процесі dqp = di.
В нашому випадку, при р = const отримаємо:
Cp = dqp/dTp або Cp = qp/(Т2 - Т1). (4.21)
Але, так як dqp = di, то отримаємо:
Cp = di/dT або Cp = i/(Т2 - Т1). (4.22)
Якщо порівняти формули (4.18) та (4.8), то можна побачити, що так як Cp > C , то в одному і тому ж інтервалі температур Tl та T2 зміна ентропії в ізобарному процесі буде більшою ніж в ізохорному, тобто крива процесу р = const пройде нижче, ніж крива процесу v = const.
7. Зміну внутрішньої енергії робочого тіла (газу) в ізобарному процесі можна підрахувати за формулою (4.9):
dup = C•dT або up = C•(T - Tl). (4.23)
Тобто
Δu = C•ΔT.
8. Частка
теплоти, яка затрачається на зміну
внутрішньої енергії газу:![]()
![]() =
Δu/qp. (4.24)
=
Δu/qp. (4.24)
Але для ізобарного процесу
Δu = C•ΔT та qp = Cp•ΔT.
Тоді
![]() = C/Cp
= l/k,
(4.25)
= C/Cp
= l/k,
(4.25)
де k
-
коефіцієнт адіабати. Так як Cp
>
C,
то k
> l.
Наприклад, для повітря k
= 1,4,
тоді
![]() пов
=
0,715.
Тобто,
в ізобарному процесі із всієї підведеної
до робочого тіла теплоти 71% її кількості
витрачається на зміну його внутрішньої
енергії і тільки 29% - на виконання ним
роботи.
пов
=
0,715.
Тобто,
в ізобарному процесі із всієї підведеної
до робочого тіла теплоти 71% її кількості
витрачається на зміну його внутрішньої
енергії і тільки 29% - на виконання ним
роботи.
Практичне застосування - підрахунок необхідного об’єму газгольдера при максимально можливій кількості підведеного від Сонця теплоти (щоб не скинуло кришку із резервуара)
![]()
