
- •Енергозберігаючі технології
- •4. Основні термодинамічні процеси в ідеальних газах та їх аналіз
- •4.1. Ізохорний процес
- •За рівнянням першого закону термодинаміки
- •4.2. Ізобарний процес
- •4.3. Ізотермічний процес
- •4.4. Адіабатний (ізоентропійний) процес
- •4.5. Політропний процес
- •5. Процеси течіння газів та рідин
- •5.1. Рівняння I-го закону термодинаміки для потоку робочого тіла (відкрита система)
- •Запишемо рівняння (5.8) у вигляді
- •5.2. Витікання газів та пари із сопел, які звужуються.
- •5.2.1. Швидкість руху потоку робочого тіла
- •Рівнянням:
- •5.2.2. Швидкість звуку
- •5.2.3. Перехід через швидкість звуку. Сопло Лаваля
- •5.3. Дроселювання газів і парів. Ефект Джоуля –Томсона
- •6. Процеси стиснення газу в компресорі
- •7. Способи охолодження робочого тіла.
- •7.1. Ізоентальпійне розширення робочого тіла (дроселювання)
- •7.2. Адіабатне розширення робочого тіла з віддачею зовнішньої роботи (детандування)
- •7.3. Аналіз ідеальних процесів розширення робочого тіла в детандерах
- •Література
- •Навчальне видання
- •Енергозберігаючі технології
7. Способи охолодження робочого тіла.
7.1. Ізоентальпійне розширення робочого тіла (дроселювання)
Якщо на шляху потоку робочого тіла (газу, рідини), який рухається теплоізольованим горизонтально розміщеним каналом постійного перетину помістити місцевий опір у вигляді перегородки з отвором малого діаметра (діафрагму, не повністю закритий кран або вентиль), то в місці звуження параметри робочого тіла змінять своє первісне значення.
Виходячи із закону нерозривності потоку в місці різкого звуження (в діафрагмі) швидкість потоку різко зросте (w2 >>w1), а зразу ж за ним прийме своє первісне значення w2 = w1, бо f2 = f1 В свою чергу в місці звуження потоку тиск впаде, а за діафрагмою його величина дещо зросте, але не досягне свого первісного значення, отже р1 < р2, тобто р1 – р2 = р. Це викликано тим, що частина кінетичної енергії потоку (швидкісний напір) буде використовуватися для компенсації втрат енергії потоку, на удари та завихрення потоку робочого тіла, які створюються за перешкодою (місцевим опором).
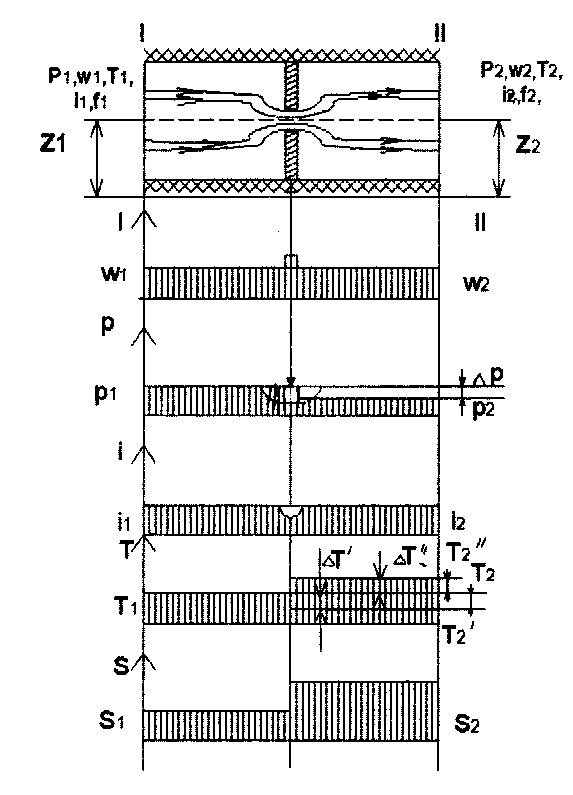
Рис. 7.1. Схема дроселя та графіки зміни параметрів потоку по його довжині
Незворотний адіабатний процес зниження тиску потоку робочого тіла при проходженні його через звуження (без виконання роботи або відведення теплоти) називається дроселюванням.
Проаналізуємо, як змінюються інші параметри потоку робочого тіла.
І-ий закон термодинаміки для потоку робочого тіла записується в наступному вигляді:
І-ша форма запису:
qзовн.= u + lкінет. + lпотенц..+ lтехн.. + lпрошт. = u + lт.д.
де
lт.д. = lкінет. + lпотенц..+ lтехн.. + lпрошт.
або
dqзовн.= du + dlт.д. ,
ІІ-га форма запису:
qзовн.= i + lкінет. + lпотенц..+ lтехн. = i + l0
де
l0 = lкінет. + lпотенц..+ lтехн.
або
dqзовн..= di + dl0,
отже
lт.д. = l0 + lпрошт.
Зробимо наступні допущення:
1) перетини каналу (потоку) до і після перешкоди постійні (f2 = f1), тоді і швидкість потоку буде також незмінною (2 = 1). Це дозволяє знехтувати зміною кінетичної енергії потоку.
Отже,
lкінет. = 0;
2) канал, яким рухається потік робочого тіла, розміщений горизонтально, тобто,
z2 = z1.
Отже
lпотенц.. = 0;
3) потік, який рухається каналом з постійним перетином, не виконує зовнішньої роботи.
Отже,
lтехн.. = 0;
4) приймаємо, що до робочого тіла, яке рухається каналом, ззовні не підводиться теплота, а також від нього не відводиться теплота, тобто - потік адіабатний.
Отже,
qзовн.. = 0;
5) процес проходження потоку робочого тіла через раптове звуження, при якому тратиться частина його швидкісного напору - незворотний процес.
Отже,
dS > 0,
тобто, даний процес супроводжується підвищенням ентропії робочого тіла
Враховуючи вказані допущення, запишемо рівняння 1-го закону термодинаміки для потоку в П-ій формі:
qзовн..= (i2 – i1) + lкінет. + lпотенц..+ lтехн..
тобто
0 = i2 – i1.
Звідки випливає, що
і2 = і1. (7.1)
Тобто, при адіабатичному дроселюванні газу його ентальпія не змінюється, тобто, di = 0.
Ми розглядаємо тут стан дросельованої речовини до дроселя і за дроселем. Що стосується процесу, який проходить в самому дроселі, то необхідно зауважити, що при течінні всередині дроселя ентальпія газу (рідини),може змінюватися, оскільки дросель являє собою звуження прохідного перетину труби, то при протіканні через дросель потік газу (рідини) прискорюється, його кінетична енергія зростає. Отже, ентальпія потоку зменшується. Після того, як за дроселем перетин потоку знову зростає, швидкість потоку сповільнюється (гальмується), його кінетична енергія зменшується і ентальпія зростає до первісного значення.
Для ідеального газу можна записати
і = Ср(Т2 - Т1), тобто і2 - і1 = Ср(Т2 - Т1) , |
але так як
і2 – і1 = 0, то Ср(Т2 - Т1) = 0;
але
Ср
![]() 0,
тоді випливає, що Т2
-
Т1
=
0,
отже
0,
тоді випливає, що Т2
-
Т1
=
0,
отже
Т2 = Т1. (7.2)
Тобто, при дроселюванні ідеального газу його температура не змінюється. Це одна із характерних ознак ідеального газу.
Але при дроселюванні реального газу його температура може зростати, знижуватися або залишатися постійною в залежності від природи цього газу. В цьому полягає відмінність між дроселюванням реального та ідеального газів.
Явище зміни температури газів та рідин при їх адіабатному дроселюванні називається ефектом Джоуля- Томсона. Таким чином, ефект Джоуля- Томсона має місце тільки для реальних газів і рідин.
Чим більша різниця між тисками р2 та р1, тим більшою буде різниця між її температурами Т2 та Т1.
При
значному зниженні тиску на дроселі
зміна температури робочого тіла
![]() називаєтьсяінтегральним
дросель-ефектом.
Він розраховується за рівнянням:
називаєтьсяінтегральним
дросель-ефектом.
Він розраховується за рівнянням:![]()
Т2
-
Т1
=
![]() і•dp,
(7.3)
і•dp,
(7.3)
де
![]() (7.4)
(7.4)
Рівняння (7.4) називається диференційним дросель-ефектом - відношення безмежно малої зміни температури робочого тіла до безмежно малої зміни його тиску в процесі адіабатичного дроселювання робочого тіла.
Ця
величина носить ще назву коефіцієнта
адіабатного дроселювання, або коефіцієнта
Джоуля-Томсона.
Стан, при якому
![]() і
=
0
називається
точкою
інверсії
ефекту Джоуля-Томсона
і
=
0
називається
точкою
інверсії
ефекту Джоуля-Томсона
Якщо в результаті дроселювання робоче тіло не змінює свою температуру, то ця температура називається температурою інверсії (Тінв.). Цю температуру можна розрахувати за рівнянням:
Тінв..
=
(![]() р.
(7.5)
р.
(7.5)
Геометричне
місце точок температури інверсії для
яких
![]() і
= 0
на р-Т
– діаграмі
дає
інверсійну криву
(побудовану за рівнянням (7.5)).
і
= 0
на р-Т
– діаграмі
дає
інверсійну криву
(побудовану за рівнянням (7.5)).
Зміна
дросель-ефекту
(![]() і)
називається інверсією,
а температура, при якій
і)
називається інверсією,
а температура, при якій
![]() і =
0 -
температурою інверсії.
і =
0 -
температурою інверсії.
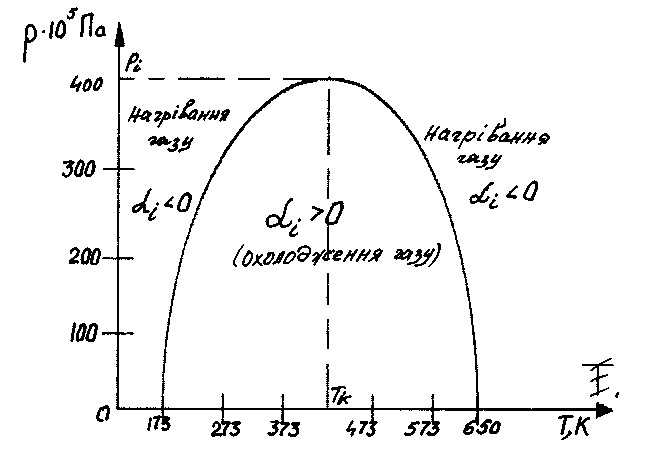
Рис. 7.2. Крива інверсії в координатах р - Т (для азоту)
У
всій області, яка знаходиться всередині
інверсійної кривої
![]() і
>
0,
і значить,
в ній при дроселюванні газ (азот) буде
охолоджуватися.
і
>
0,
і значить,
в ній при дроселюванні газ (азот) буде
охолоджуватися.
Поза
цією областю
![]() і
<
0
і
тому тут при дроселюванні азот буде
нагріватися.
і
<
0
і
тому тут при дроселюванні азот буде
нагріватися.
Таким чином, дроселювання газоподібного азоту при всіх значеннях початкової температури Т < Тшв. буде супроводжуватися його охолодженням, а при Т > Тшв., навпаки - нагріванням.
Крива інверсії при р = 0 пересікається із віссю температур в двох точках; зліва – при Т0,1 = 0,75Тк і справа – при Т0,2 = 6,75Тк. Значення Т0,2 для реальних газів добре узгоджується з величиною 6,75Тк при атмосферному тиску. В точці
максимуму інверсійної кривої макс = к, рмакс = 9рк і Тмакс = ЗТк. ,
Оскільки
і для інших робочих тіл криві інверсії
мають аналогічний характер, то можна
стверджувати, що для всіх речовин, які
знаходяться в газоподібному стані,
при Т
< Тінв.
дроселювання
супроводжується охолодженням, а при
Т
> Тінв.-
нагріванням
речовини.![]()
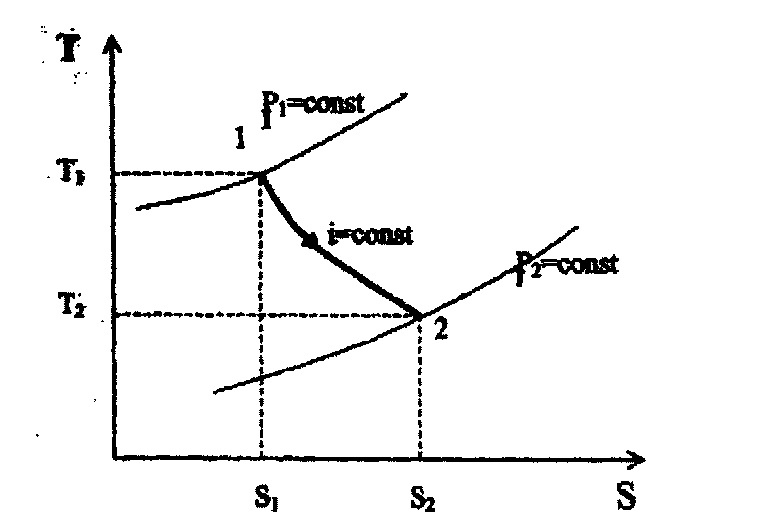
Рис. 7.3. Графічне зображення процесу дроселювання в координатах Т – s
Ізоентальпійне
розширення (при
і = const)
адіабатного потоку робочого тіла
при його дроселюванні (без віддачі
зовнішньої роботи) використовується
як ефективний
спосіб охолодження газів. Зрозуміло,
що
газ охолоджуватися
буде тільки в тому випадку, коли його
температури будуть знаходитися
в тій області стану, в якій
![]() і
>
0, тобто
в області всередині інверсійної
кривої.
і
>
0, тобто
в області всередині інверсійної
кривої.
Процес ізоентальпійного розширення газу при його дроселюванні зображено на рис. 7.3 в координатах Т-s.
Із рисунка видно, що при перепусканні газу із області з високим тиском в область низького тиску (р1 > р2) температура робочого тіла зменшується (Т1 > Т2), - ентропія зростає(s2 > s1), а ентальпія залишається постійною і = соnst.
